Le micro-organisme Coniothyrium minitans est reconnu efficace contre les sclérotinioses dues à Sclerotinia sclerotiorum. Mais la laitue est sensible à deux espèces de Sclerotinia : S. sclerotiorum et S. minor. Est-ce que C. minitans parasite aussi ce dernier, ou seulement S. sclerotiorum ? On aura davantage de chance d'utiliser ce biofongicide avec succès dans le premier cas que dans le second. Le travail rapporté ici répond en partie à la question.
Situation sur laitues
Les sclérotinioses en général
Rappel : les sclérotinioses, maladies d'importance économique sur de nombreuses cultures, sont dues à des champignons ascomycètes du genre Sclerotinia. Ceux-ci produisent des sclérotes. Ces masses compactes de mycélium aggloméré adaptées à la survie en conditions défavorables sont souvent la cause des infections primaires.
Le cas des salades
Sur salades et notamment laitue, les attaques, causées principalement par les espèces S. sclerotiorum et S. minor, occasionnent une pourriture sur les parties de la plante au contact du sol, notamment les feuilles sénescentes, pour finalement envahir d'autres feuilles et le collet. Elles aboutissent en général à une destruction totale de la plante (photo).
Il n'existe actuellement pas de variétés commerciales résistantes ; la lutte repose essentiellement sur des techniques culturales (gestion de l'irrigation et de la fertilisation, élimination des débris végétaux, baisse de l'hygrométrie pour les cultures sous abris...) et sur l'utilisation de fongicides conventionnels.
Pourquoi étudier l'action de C. minitans sur S. minor
Hyperparasitisme de S. sclerotiorum par C. minitans, on connaît déjà
Des alternatives prometteuses de lutte, basées notamment sur l'utilisation d'agents de protection biologique, ont été identifiées. Un produit de biocontrôle, Contans WG, est autorisé en France depuis 2003 en « traitements généraux » donc entre autres sur salade (v. Pour en savoir plus).
Des essais menés sur différentes espèces végétales ont montré que le champignon Coniothyrium minitans souche CON/M/91-08, matière active du Contans WG, a une bonne efficacité de protection contre les attaques de différentes espèces de Sclerotinia, et notamment contre l'espèce S. sclerotiorum, en condition de laboratoire et plein champ (Penaud et Michi, 2009 ; Whipps et al., 2008). Des observations au microscope électronique à balayage (MEB) ont de plus mis en évidence la capacité de C. minitans à parasiter le mycélium et les sclérotes de S. sclerotiorum (Bennett et al. 2006 ; Huang et Kokko, 1988 ; Phillips et Price, 1983 ; Tu, 1984).
Relations S. minor/C. minitans, le mystère
En revanche, peu d'études ont été réalisées sur l'interaction entre C. minitans et l'espèce S. minor, agent phytopathogène pourtant largement répandu dans différentes régions de production de laitue dans le monde (http://ephytia. inra.fr/). Ces rares études ont révélé une efficacité contrastée de C. minitans en conditions de productions commerciales, par exemple sur laitue ou arachide (Chitrampalam et al., 2008 ; Chitrampalam et al., 2010 ; Partridge et al., 2006).
Mais, à notre connaissance, aucune étude de microscopie n'a été réalisée pour évaluer le parasitisme direct de C. minitans sur les sclérotes de cette espèce.
L'objectif de ce travail est donc de décrire l'interaction in vitro entre l'agent de protection biologique C. minitans (matière active de Contans WG) et l'agent phytopathogène S. minor. Ainsi l'essai effectué a consisté à évaluer par microscopie électronique à balayage la capacité de C. minitans à infecter et dégrader les sclérotes de S. minor.
De la boîte de Petri au film d'or
Préparation de l'agent pathogène
Les sclérotes de S. minor ont été produits en boîtes de Petri sur un milieu gélosé PDA (Potato Dextrose Agar). Pour ceci, un sclérote de S. minor désinfecté à l'alcool (30 secondes) puis à l'eau de Javel (diluée de moitié pendant 30 secondes), suivi de trois rinçages à l'eau stérile, est déposé au centre de la boîte de Petri. Les boîtes sont incubées dans une enceinte climatisée à 21 °C.
Après développement mycélien durant 3 semaines d'incubation, les sclérotes produits sont récoltés stérilement à la surface du milieu gélosé. Ils sont ensuite disposés dans un tube stérile et stockés à 21 °C à l'obscurité. Ils sont conservés pendant 2 semaines maximum avant leur utilisation.
Préparation de l'agent de lutte biologique
Le produit Contans WG contenant le champignon Coniothyrium minitans souche CON/M/91-08 utilisé dans cette étude a été produit par la société Prophyta et fourni au laboratoire par Belchim. Une solution est réalisée en mélangeant 0,5 g de poudre du produit commercial à 50 ml d'eau distillée stérile. Les spores de C. minitans sont dosées et la suspension de spores ajustée à la concentration de 105 spores/ml à l'aide d'un hémacymètre de Malassez sous microscope optique (grossissement x100).
Afin de vérifier la viabilité des spores contenues dans le produit commercial, 100 μl de sa suspension dans l'eau sont déposés à la surface d'un milieu PDA dans une boîte de Petri. Après 24 heures d'incubation à 21 °C, le taux de germination est mesuré sous microscope optique (gross. x 100) en comptant l'ensemble des spores germées sur un total de 100 spores observées. Trois répétitions sont réalisées.
La pureté de la préparation est évaluée pendant 3 semaines par suivi quotidien du développement éventuel de contaminants sur le milieu de culture.
Mise en présence des deux champignons : inoculation et incubation des sclérotes
Douze sclérotes de S. minor sont déposés individuellement dans chaque puits d'une lame de microscopie stérile. La suspension de spores de C. minitans est déposée sur la face supérieure de chaque sclérote, à raison de 2 μl par sclérote, soit environ 200 spores. En parallèle, une autre lame porte 6 sclérotes non traités avec la suspension (sclérotes témoins).
Chaque lame est ensuite placée dans une boîte de Petri en verre préalablement stérilisée dans laquelle est disposé sur le fond un papier filtre humide stérile afin d'assurer des conditions d'humidité favorables au développement de C. minitans. Ces boîtes de Petri sont placées dans des boîtes rectangulaires de polystyrène transparent avec couvercles (photo) et incubées en chambre climatisée à 21 °C.
Observations microscopiques, la couche d'or entre en scène
Les observations microscopiques sont réalisées après 1, 4, 7, 14, 21 et 28 jours d'incubation, à l'aide d'un microscope électronique à balayage (MEB, FEI-Philips XL30). Six sclérotes de S. minor traités avec la suspension de spores de C. minitans et 6 sclérotes témoins non traités sont utilisés pour les observations réalisées pour chacun des six temps d'incubation (1, 4, 7, 14, 21 et 28 jours).
Pour chaque modalité, deux sclérotes sont coupés en deux morceaux afin d'observer l'intérieur des tissus, les quatre autres sont laissés intacts.
Les sclérotes entiers ou coupés sont traités par la technique de pulvérisation cathodique qui consiste à recouvrir l'échantillon d'une très fine couche d'or d'environ 15 nm (Balzers – SCD 004) afin de réaliser les observations en MEB.
Résultats
La bonne croissance de C. minitans sur milieu PDA est vérifiée
Sur milieu PDA, après 24 heures d'incubation à 21 °C, les spores de C. minitans ont un taux de germination compris entre 60 et 70 %. Ceci suggère une bonne viabilité des spores formulées dans le produit commercial Contans WG utilisé dans cette étude. Un filament germinatif cloisonné qui se divise en différents fragments mycéliens est produit dès 48 heures après inoculation.
Après 7 jours d'incubation à 21 °C, des pycnides sont formées, produisant ainsi sur le milieu de culture un grand nombre de spores. Après 3 semaines d'incubation à 21 °C, l'ensemble du milieu nutritif PDA est recouvert de mycélium et de pycnides. Aucune contamination bactérienne ou fongique n'a été détectée au cours de ces essais, suggérant l'absence de contaminants dans le produit commercial.
Non inoculés, les sclérotes de S. minor restent « nets »
Les observations réalisées en MEB confirment que les sclérotes de S. minor ont un aspect globalement circulaire et mesurent entre 1,1 et 1,9 mm de diamètre (moyenne de 1,5 mm pour 11 sclérotes sains mesurés). Sur les sclérotes de S. minor témoins (non inoculés avec des spores de C. minitans), aucun développement mycélien n'est observé.
Rapidement, C. minitans germe puis croît sur les sclérotes de S. minor
Dans nos conditions de test, les spores de C. minitans déposées sur les sclérotes de S. minor germent dès 24 heures après inoculation et, après 48 heures, la plupart des spores ont germé.
Ceci aboutit à un développement abondant du mycélium de C. minitans à la surface des sclérotes de S. minor après 4 jours.
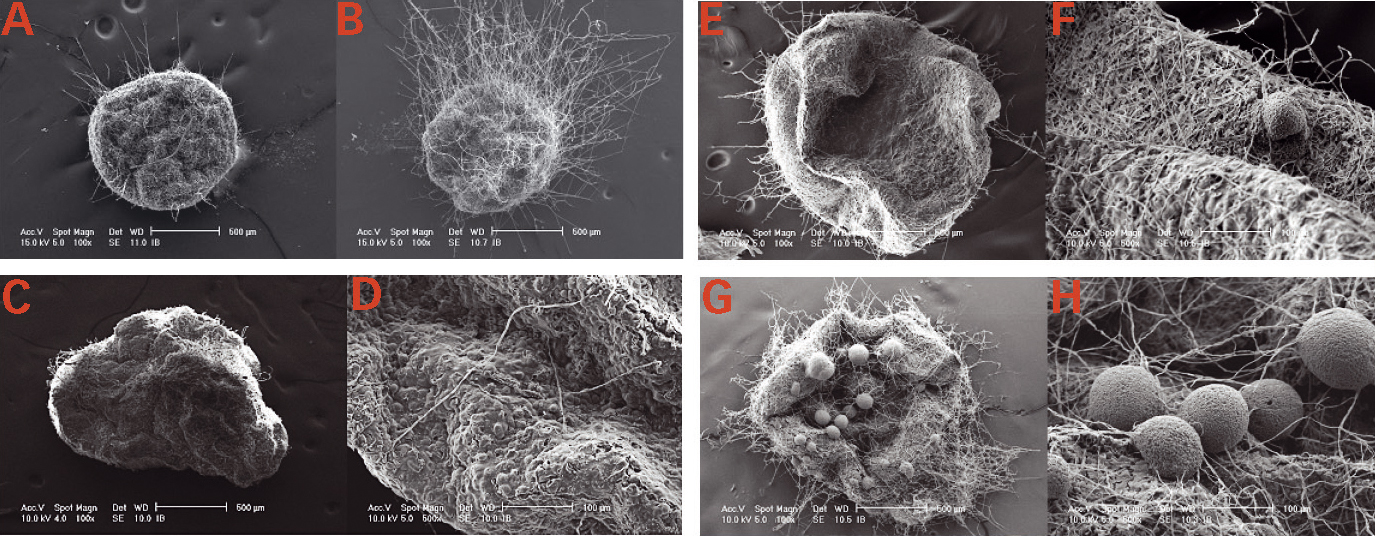
En augmentant la dose de spores de C. minitans inoculées sur les sclérotes (10 fois plus de spores par rapport à la dose utilisée dans les autres tests, soit 2 000 spores inoculées), la croissance mycélienne est beaucoup plus forte, suggérant une infection plus importante des sclérotes (Fig. 1A et 1B).
À 7 jours, C. minitans commence à dégrader les sclérotes de S. minor
Après 7 jours d'incubation à 21 °C, le mycélium de C. minitans se développe à la surface des sclérotes de S. minor (Fig. 1C et 1D).
L'observation des coupes révèle que les tissus internes des sclérotes traités avec C. minitans sont plus lâches avec dépressions, comparés aux sclérotes témoins non traités. Ceci suggère un effet de C. minitans sur la structure des tissus internes des sclérotes de S. minor dès 7 jours après inoculation.
En revanche, aucun filament mycélien n'est encore visible à l'intérieur des sclérotes et aucune pycnide n'est observée, ni à la surface ni à l'intérieur des sclérotes.
À 14, 21, 28 jours...
À 14 jours, le réseau mycélien de C. minitans est beaucoup plus dense à la surface des sclérotes de S. minor, sur laquelle apparaissent des pycnides (Fig. 1E et 1F).
En coupe, on observe la présence de dépressions assez importantes dans les tissus internes chez les sclérotes traités en comparaison aux sclérotes non traités.
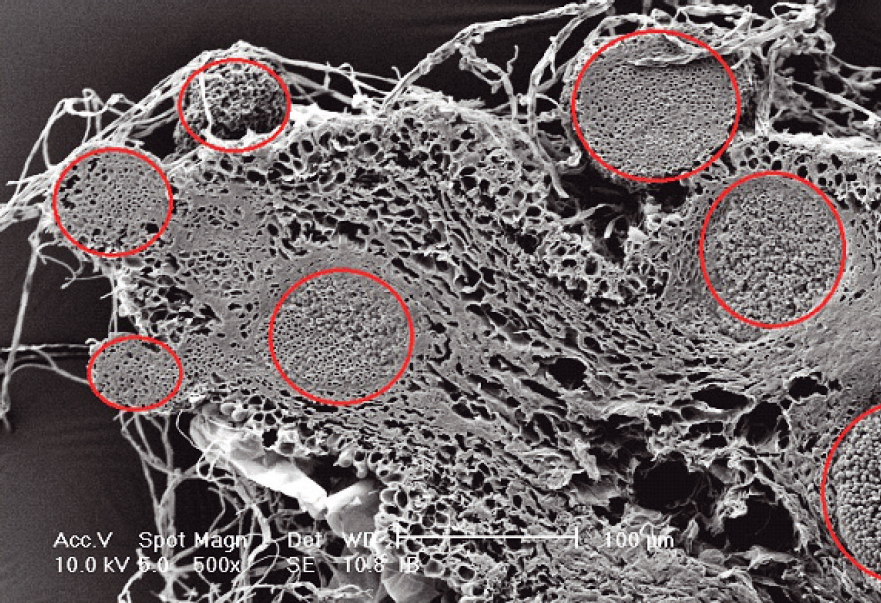
À 21 jours, les sclérotes sont totalement recouverts de mycélium de C. minitans avec de nombreuses pycnides visibles à leur surface. En coupe (Fig. 2), on observe des tissus internes dégradés et le développement de nombreuses pycnides dans les sclérotes traités avec C. minitans.
À 28 jours, les sclérotes de S. minor sont très dégradés et entièrement couverts de pycnides de C. minitans (Fig. 1G et 1H). En coupe, on observe des tissus internes de S. minor fortement dégradés et le développement de nombreuses pycnides de C. minitans.
Conclusion
Activité prouvée
Ces résultats mettent en évidence la capacité de C. minitans, principe actif de Contans WG, à parasiter les sclérotes de S. minor. Ils suggèrent que cet hyperparasitisme se met en place rapidement après le traitement. En effet, la structure des tissus internes des sclérotes se modifie en 7 jours, et à partir de 14 jours quelques pycnides se développent à leur surface. Après 3 à 4 semaines, les sclérotes sont fortement dégradés et C. minitans s'y développe abondamment, produisant de nombreuses pycnides. Ces expériences, bien que réalisées in vitro, illustrent ce qui peut potentiellement se produire dans le sol.
Ces observations complètent des travaux précédents réalisés en MEB et qui décrivent l'infection de sclérotes de S. sclerotiorum par C. minitans et la production de pycnides par le champignon hyperparasite (Bennett et al., 2006). Ainsi chez S. sclerotiorum, les auteurs observent les premiers signes d'infection des sclérotes par C. minitans après 7 jours, la production de pycnides après 14 jours, et l'invasion complète des sclérotes et la production abondante de pycnides après 30 jours.
Perspectives : réaliser une cinétique et évaluer si C. minitans parasite aussi les hyphes mycéliens de S. minor
Une des suites de ce travail sera la réalisation d'une cinétique de survie des sclérotes de S. minor traités par C. minitans, en particulier dans les premiers jours de l'infection avant que les signes de la présence du champignon hyperparasite ne soit visibles (ex. durant les 7 premiers jours après traitement). Ceci permettrait d'évaluer le temps nécessaire à C. minitans pour modifier la viabilité des sclérotes de S. minor.
Par ailleurs, il serait intéressant d'évaluer la capacité de C. minitans à parasiter aussi les hyphes mycéliens de S. minor. En effet cette propriété, très intéressante en terme d'efficacité contre ce pathogène, a déjà été mise en évidence vis-à-vis de S. sclerotiorum (Huang et Kokko, 1988 ; Tu, 1984) mais à notre connaissance pas vis-à-vis de S. minor.
Et avec Botrytis cinerea ?
En culture de laitue, les champignons du genre Sclerotinia sont souvent associés à Botrytis cinerea dans les attaques des feuilles basses et du collet (http://ephytia.inra.fr/). Ce dernier champignon, ascomycète comme Sclerotinia, produit lui aussi des sclérotes considérés en général comme sa principale structure de survie (Holz et al., 2004).
À notre connaissance, peu d'études ont été réalisées sur l'interaction possible entre C. minitans et B. cinerea. Les seules études publiées à ce jour fournissent des résultats contrastés, probablement liés aux caractéristiques des souches utilisées.
Ainsi, on observe une réduction de la quantité de sclérotes produits lorsqu'on associe B. cinerea et C. minitans en co-culture sur un milieu PDA (Whipps, 1987). Selon d'autres travaux, l'inoculation simultanée de C. minitans avec B. cinerea sur tige de tomate entraîne une diminution de la progression de B. cinerea dans la plante, sans que C. minitans n'infecte les sclérotes de B. cinerea (Gerlagh et al., 1996). Une étude antérieure avait pourtant décrit l'infection possible de sclérotes de B. cinerea par C. minitans au laboratoire (Turner et Tribe, 1976)...
Il serait intéressant d'étudier, par observation en MEB, l'effet direct de différentes souches de C. minitans sur les sclérotes et le mycélium de B. cinerea.
 Imprimer
Imprimer