Les plantes sont cultivées en conditions contrôlées à partir de graines d'adventices récoltées en fin de saison. Photo S. Buchet
Dans les zones d'agriculture intensive d'Europe de l'Ouest, la protection des grandes cultures (céréales à paille, maïs, colza, tournesol, etc.) contre leurs adventices se fait principalement à l'aide d'herbicides issus de la chimie de synthèse. Mais le contexte devient de plus en plus contraignant pour l'emploi de ces produits.
Pourquoi il faut évaluer la résistance des adventices
La résistance se développe
L'usage systématique des pesticides contesté par la société a conduit au Grenelle de l'environnement et au plan Écophyto en France, au rejet des OGM en Europe, ainsi qu'à une remise en question par une partie de la population urbaine du modèle d'agriculture productiviste des pays développés.
Cela a entraîné le renforcement de la législation européenne (et nord-américaine) en matière de produits phytosanitaires avec des contraintes croissantes tant sur les plans toxicologique (homme) qu'écotoxicologique (environnement).
La diversité des produits issus de la chimie de synthèse autorisés a donc diminué. Cette tendance pourrait favoriser la sélection d'adventices résistantes en raison de la raréfaction des modes d'action.
De même, certaines pratiques culturales (rotations courtes, passage tardif d'herbicide sur adventices développées, etc.) peuvent également favoriser ce phénomène.
De fait, l'utilisation des produits a entraîné l'apparition de résistances des adventices à certaines substances herbicides. Dans le monde, 246 espèces d'adventices sont résistantes à un ou plusieurs modes d'action herbicide, et 22 des 25 modes d'action herbicide connus sont touchés par la résistance d'au moins une espèce d'adventice (Heap, 2015). Un problème d'ampleur !
Suivi des résistances : les avantages
Les contraintes sociétales, réglementaires et techniques obligent à suivre le devenir des résistances aux herbicides de façon précise chaque année. Ce suivi (monitoring) permet de détecter des résistances avant leur généralisation, de préserver les molécules autorisées et d'anticiper des solutions agronomiques si elles sont possibles.
Nous allons évoquer les méthodologies disponibles pour le suivi des résistances, méthodologies conventionnelles (criblage phénotypique) et moléculaires.
Avant cela, il faut savoir de quoi nous parlons et quelles sont les résistances aux herbicides recherchées.
Qu'espère-t-on détecter ?
La résistance : définition
Avant tout, revenons à la définition de la résistance d'une adventice à un herbicide : il s'agit de la capacité héritable d'une plante à ne pas être contrôlée par un herbicide appliqué conformément aux usages (dose, stade, conditions) et à produire une descendance viable. Cette définition est la pierre angulaire du monitoring, elle suppose un caractère héritable de la résistance, donc stable.
Analyser l'individu ou la population ?
Une autre contrainte est que les échantillons prélevés au champ et dans lesquels une résistance est soupçonnée ne sont pas constitués d'individus génétiquement identiques mais de lots d'individus, certains résistants (R) et d'autres sensibles (S). La question est donc celle de la taille de l'échantillon à prélever : faut-il réaliser des analyses individuelles ? Ou de populations (en « bulk ») ?
Comme pour les monitorings fongicides, la méthode la plus précise est l'analyse individuelle, mais elle a des limites en termes de faisabilité. S'il faut réaliser l'analyse individuelle de quarante plantes pour rendre compte de l'état d'une parcelle, on est très vite limité par le nombre de tests, surtout si l'on veut tester un grand nombre de parcelles dans différentes régions, voire différents pays ! L'analyse globale reste donc la méthode la plus utilisée pour des monitorings de sensibilité aux herbicides.
Il faut veiller à ce que la même méthode soit utilisée d'une année sur l'autre afin de permettre des comparaisons. Et ne pas s'interdire de tester des présomptions de résistance en réalisant des analyses individuelles dans des cas particuliers.
Où prélever l'échantillon ?
La nature de l'échantillon est importante : faut-il prélever la population d'adventices au hasard dans la parcelle ? Ou choisir un foyer ayant échappé au traitement ?
Les tests en laboratoire visent d'abord à établir le pourcentage de R au sein de la population testée. Puis on cherche à mesurer l'évolution des R d'une année à l'autre afin de repérer une éventuelle dérive par rapport à l'année précédente.
Enfin, rappelons que la connaissance du mécanisme de résistance n'est pas un préalable au monitoring par criblage phénotypique. En revanche, le criblage moléculaire exige de connaître le gène recherché donc le mécanisme de résistance.
Criblage phénotypique
Principes généraux
Les tests dits phénotypiques sont basés sur l'évaluation globale de la sensibilité d'adventices aux herbicides. Il s'agit de faire croître les plantes en conditions contrôlées, soit à partir de plantules d'adventices récoltées dans l'année en cours, soit à partir de graines d'adventices récoltées généralement en fin de saison.
Lorsque les plantes ont atteint un stade donné, elles sont traitées puis cultivées en conditions contrôlées jusqu'à l'expression des symptômes. Ces derniers sont ensuite quantifiés et les analyses statistiques effectuées par comparaison avec des populations sensibles traitées correspondantes.
Tests à partir de plantules récoltées
Pour les tests à partir de plantules, celles-ci sont prélevées au champ selon un protocole standard, en préservant leur système racinaire et en maintenant leur intégrité. Elles sont ensuite acheminées vers un laboratoire pour être rempotées puis testées en conditions contrôlées. Il est essentiel que les plantes soient en bon état physiologique lors du prélèvement et que l'envoi au laboratoire soit rapide, sous peine de mortalité des plantes avant le test. L'intérêt évident de la méthode est qu'il est possible de tester des échantillons rapidement sans passer par leurs semences. Un test sur Lolium rigidum et Alopecurus myosuroides a été developpé par Boutsalis et Syngenta (Boutsalis, 2001).
Cette méthode a ses limites : toutes les espèces d'adventices ne se prêtent pas au déracinement et à la régénération. Elle est difficile à mettre en oeuvre sur le coquelicot (Papaver rhoeas), trop fragile. De façon générale, les monocotylédones se prêtent mieux à ce test que les dicotylédones.
Tests sur graines en boîte de Petri
De nombreux herbicides sont susceptibles d'inhiber la germination des adventices, mais peu de tests ne sont basés que sur la germination. Ce type de test a été développé pour les inhibiteurs de l'ACCase (groupe HRAC A). Il est effectué en boîte de Petri en semant les graines sur un milieu de culture dans lequel l'herbicide est incorporé. Ce test permet l'évaluation rapide d'un grand nombre de plantes, mais leur développement prend plus de temps qu'un test en pot et leur interprétation exige une certaine expérience (Beckie et al., 2000).
Tests en pots à partir de graines
Les tests sur plantules sont largement utilisés pour la recherche de résistances (Beckie, et al., 2000 ; OECD Guideline 227, 2003). Le principe est de prélever des graines d'adventices au champ, en veillant à la représentativité de l'échantillonnage. Ces graines sont mises à germer et les plantules sont ensuite repiquées en pot et cultivées jusqu'au stade deux-trois feuilles avant traitement.
Les herbicides à tester sont utilisés à plusieurs doses, celle homologuée et une à plusieurs surdoses pouvant aller de 2N à 8N, de façon à mettre en évidence les résistances.
Les symptômes sont ensuite évalués à l'aide d'une échelle de notation visuelle standardisée et les poids frais des plantes survivantes mesurés en fin d'expérimentation. C'est le protocole classique pour évaluer les traitements de post-émergence.
Six paramètres à contrôler
La validité de ces tests dépend de différents paramètres qui doivent être parfaitement contrôlés et standardisés, et nécessite une expertise pluridisciplinaire (botanique, horticulture, traitement, phytosanitaire, statistique...). Tout d'abord, elle exige une bonne germination des graines, donc :
- une bonne maturité des graines prélevées ;
- la prise en compte de la dormance (phénomène qui bloque le développement des graines et leur permet de survivre en périodes défavorables) que présentent la plupart des adventices (Benech-Arnold, et al., 2000 ; Fenner, 2000) ;
- la prise en compte du taux de germination naturel, souvent assez faible car généralement compensé dans la nature par une très grande production de graines.
Au laboratoire, la levée de dormance et la germination des adventices peuvent être difficiles. Elles nécessitent des pratiques type scarifications thermiques, mécaniques ou chimiques (Butterfield, 1967). Optimiser la germination des adventices exige une mise au point propre à chaque espèce.
Le second paramètre est la croissance - la plus homogène possible - de plantes en bonne santé. Cela demande de les cultiver en conditions optimales. Il est donc nécessaire de connaître et contrôler les paramètres nutritionnels et conditions environnementales optimales de chaque espèce.
Troisième paramètre, le traitement herbicide doit être équivalent à celui du champ. Le stade de développement des plantes doit être le même que celui sur lequel le produit est utilisé. La qualité de pulvérisation et le volume d'application doivent mimer ceux préconisés pour le produit selon la culture et les adventices visées. Enfin, les doses d'application doivent comporter la dose homologuée de chaque produit. S'y ajoutent les surdoses qui permettront de certifier et d'évaluer le niveau de résistance.
Quatrièmement, l'échelle de notation visuelle doit être adaptée aux symptômes liés au mode d'action testé. Elle doit prendre en compte différents paramètres : blanchiment, chlorose, nécrose, déformation, réduction de croissance, etc. Des inhibiteurs de la synthèse des caroténoïdes (groupe HRAC F), par exemple, provoquent surtout des blanchiments, mais des analogues de l'auxine (groupe HRAC O) causent des déformations. Les évaluations étant pluriannuelles et les notations étant visuelles, elles sont sensibles à l'effet opérateur : il faut de la rigueur.
Cinquième paramètre, les résultats doivent être comparés à ceux obtenus sur une population de référence composée de plantes sensibles. Certains produits sont homologués pour des traitements sur des stades de développement précis, voire des conditions environnementales particulières. En effet, selon la saison d'application des produits (automne ou printemps, par exemple), les températures, la photopériode et le stade de développement des adventices moyens ne sont pas les mêmes. Dans ce cas, il faut modifier les tests pour les adapter avant de les valider et de les standardiser.
Pour qu'un test soit valide, il faut connaître le seuil de sensibilité de base de chaque espèce adventice pour chaque produit à tester. Il faut disposer de populations de référence qui seront évaluées dans les mêmes conditions que les populations tout juste prélevées au champ.
Le sixième paramètre correspond aux conditions particulières de tests. En effet, certains produits exigent des conditions de traitement spécifiques (conditions climatiques ou stade de développement des plantes). Par exemple, nous avons évalué des produits à absorption racinaire actifs sur stades précoces utilisés en automne, donc sous températures fraîches. Il a fallu plusieurs essais pour valider ce test sur des populations de référence.
Criblage moléculaire
Validation nécessaire
La connaissance des mutations de cible conférant la résistance à certains herbicides permet d'envisager la détection moléculaire (ADN) en révélant la présence de la mutation chez un individu, sans forcément réaliser un criblage phénotypique.
Pour adopter cette approche, il faut la valider en la comparant au test herbicide global. À titre d'exemple, voici le travail réalisé par BIOtransfer avec une société agrochimique.
Test phénotypique sur coquelicot
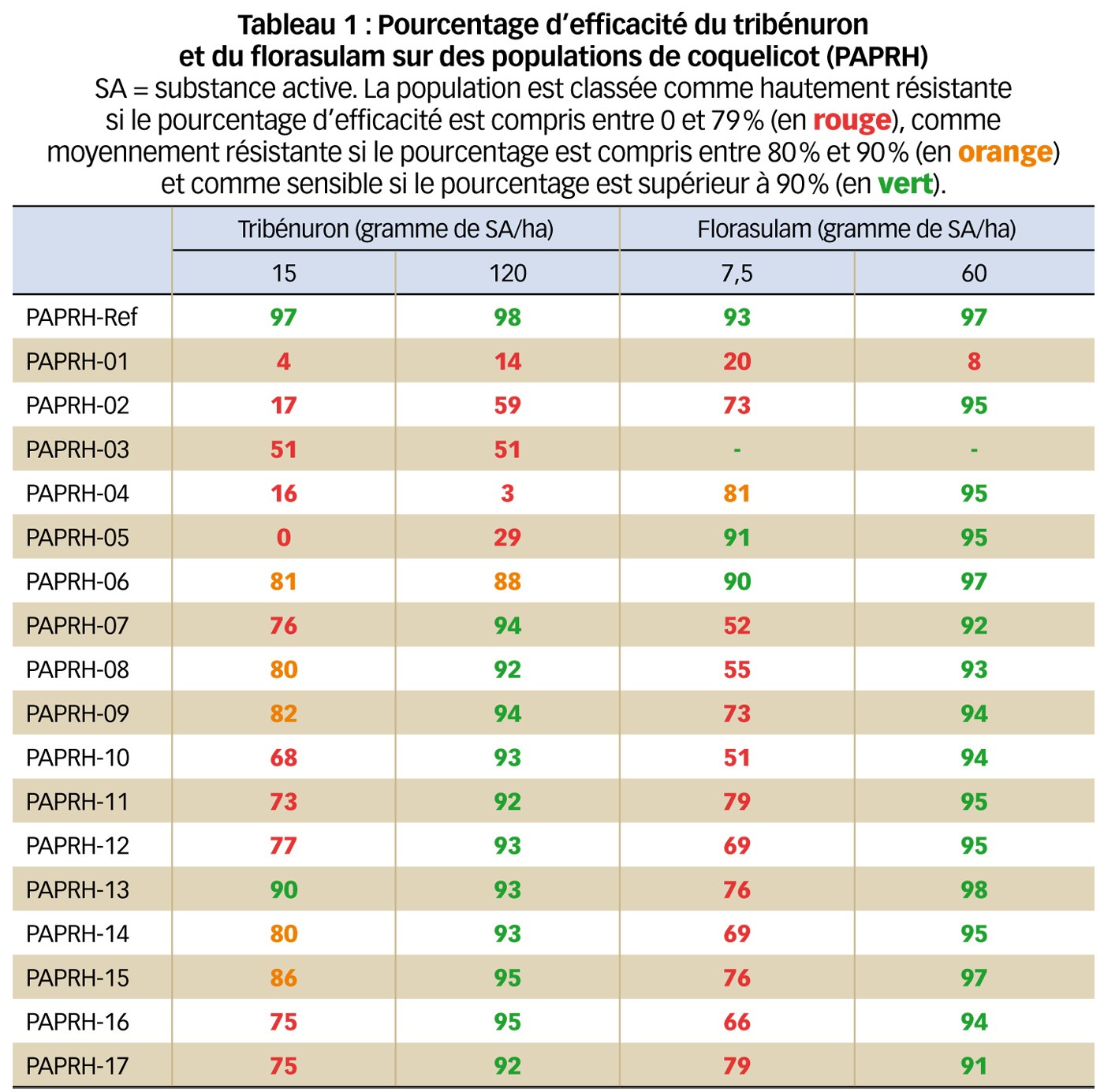
Le Tableau 1 montre les efficacités du tribénuron et du florasulam sur 18 populations de coquelicot dont la référence (PAPRH) testées en 2014 avec deux herbicides inhibiteurs de l'ALS (groupe HRAC B). Ces populations sont semées selon un protocole de germination optimisé. Les plantes sont traitées au stade quatre à six feuilles à l'aide d'un banc de pulvérisation équipé d'une buse agricole qui reproduit les conditions de plein champ. Les herbicides sont évalués à leur dose homologuée et pour certains à huit fois cette dose.
Le pourcentage d'efficacité des traitements est déterminé 28 jours après pulvérisation, d'une part par évaluation visuelle des symptômes selon une échelle de notation précise et, d'autre part, par mesure du poids frais de la partie aérienne des plantes. En fonction du pourcentage d'efficacité calculé, les plantes sont classées en hautement résistante (moins de 80 % d'efficacité), moyennement résistante (de 80 % à 90 %) et sensible (plus de 90 %). Le Tableau 1 montre que, sur ces 17 populations, 16 sont hautement résistantes ou moyennement résistantes au tribénuron et 14 sont hautement résistantes ou moyennement résistantes au florasulam, alors que la population de référence est sensible aux deux produits.
L'analyse moléculaire
Ce monitoring a été complété par une analyse moléculaire de certaines de ces populations de coquelicot auxquelles s'ajoute la population sensible de référence.
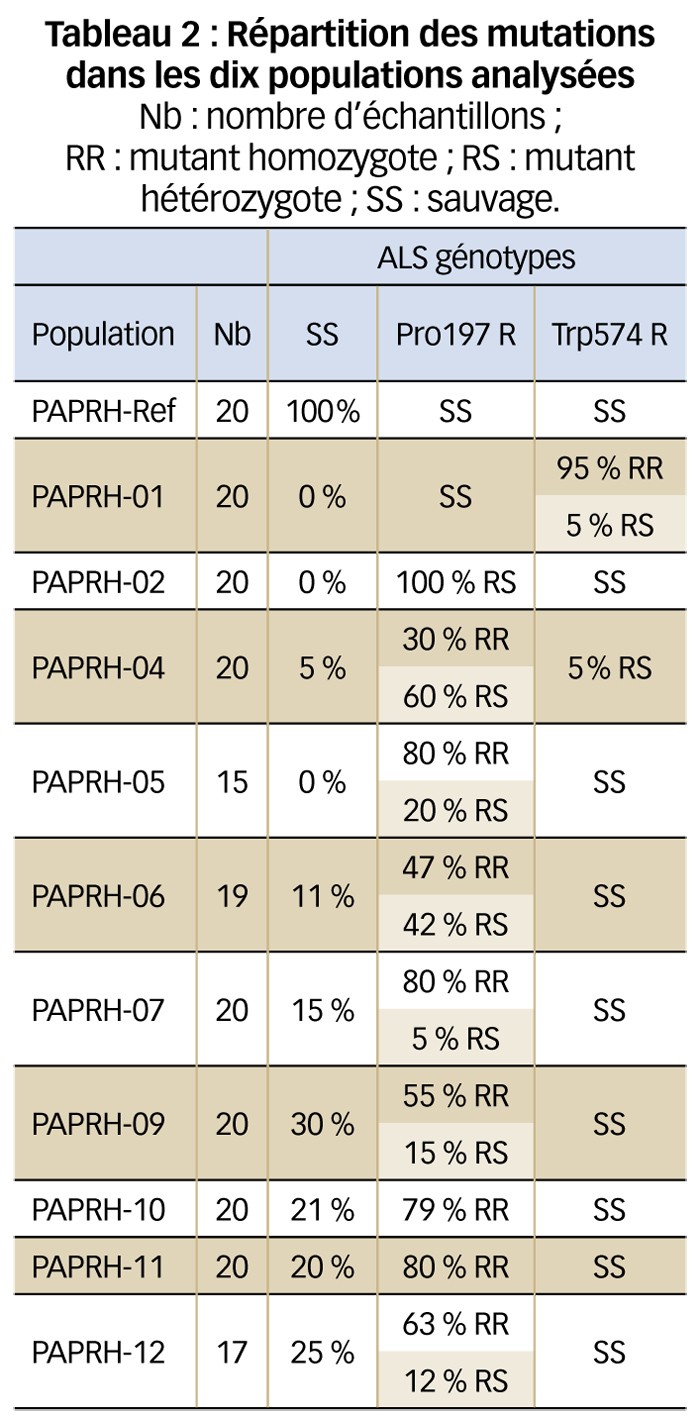
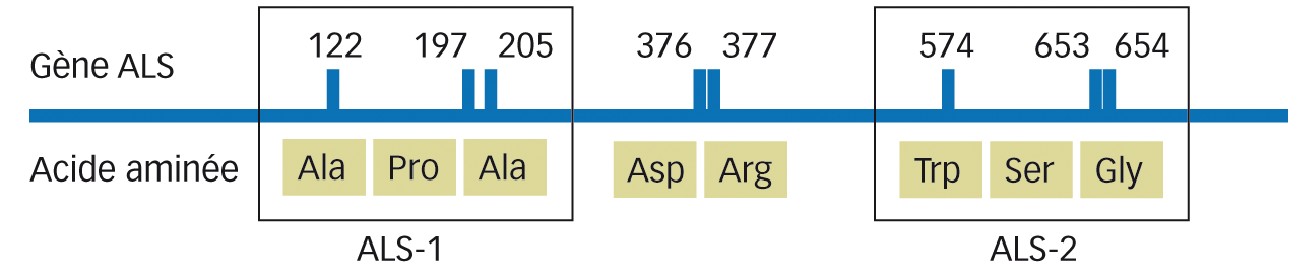
Le but était de rechercher la présence de mutations dans le gène cible (ALS) conférant la résistance à ces herbicides. Dans ce but, un fragment de feuille est prélevé sur douze à vingt plantes de dix de ces populations en fin de monitoring. L'ADN de chaque plante est ensuite extrait et soumis à amplification à l'aide d'amorces spécifiques du gène ALS. Deux fragments d'environ 500 paires de base sont amplifiés de façon à couvrir les deux zones principales de mutation (Figure 1). Les amplicons sont ensuite séquencés et les séquences analysées pour rechercher les principales mutations connues (Tableau 2).
Comparaison : les deux concordent
Globalement, les analyses moléculaires sont en adéquation avec les tests biologiques. La population de référence est composée d'individus non mutés, et les autres populations analysées comportent une forte proportion de mutants homozygotes ou hétérozygotes avec une majorité d'individus mutés en position 197, sauf la population PAPRH-01 mutée en position 574. Aucune autre position ne présente de mutation.
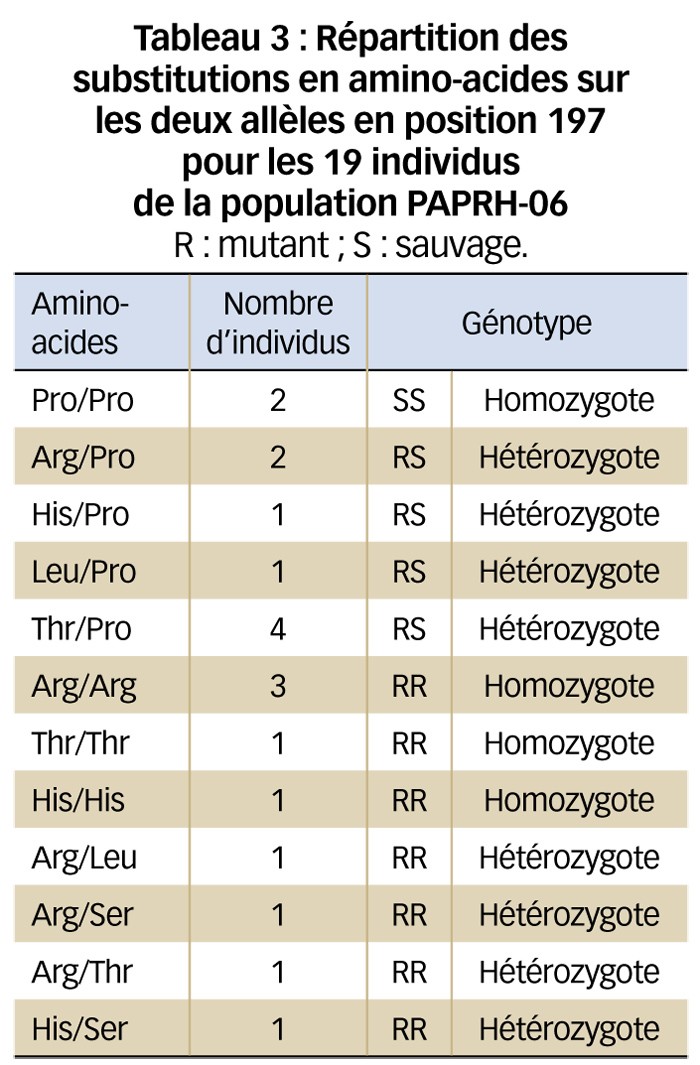
Par ailleurs, la composition des populations est très variable. Certaines, comme la population PAPRH-02, sont composées exclusivement d'individus hétérozygotes Arg/Pro en position 197. D'autres sont très hétérogènes, comme la population PAPRH-06 (Tableau 3). Cette dernière est très intéressante : elle montre la complexité de l'analyse moléculaire pour identifier des individus résistants aux inhibiteurs de l'ALS.
Cette complexité est renforcée par le fait que certaines substitutions confèrent des niveaux de résistance variables en fonction des substances utilisées.
Christophe Délye a ainsi montré que tous les mutants trouvés en position 197 homozygotes ou hétérozygotes étaient résistants ou moyennement résistants au tribenuron alors que seuls les mutants Serine en position 197 semblaient conférer un certain niveau de résistance au florasulam (Delye, 2011). Ces observations sont en adéquation avec les résultats du test de sensibilité herbicide qui montre que la population PAPRH-06 est moyennement résistante au tribenuron et sensible au florasulam. Il est aussi intéressant de noter que la seule population (PAPRH-01) composée à 100 % de mutants en position 574 est hautement résistante aux deux herbicides testés, conformément à la littérature (Tranel et al., 2016).
Perspectives
Criblage phénotypique et méthodes moléculaires coexisteront
Nous avons donné un aperçu des méthodes d'évaluation de la résistance des adventices aux herbicides. Le criblage phénotypique est très largement utilisé car c'est une approche globale ne préjugeant pas d'un mécanisme particulier de résistance. Pour leur part, les méthodes moléculaires actuelles s'appuient sur la détection de mutations de la cible de l'herbicide, ce qui exige la connaissance préalable des mutations de cette cible. Le cas des sulfonylurées (mutations du gène ALS identifiées) est loin d'être généralisé chez les autres familles d'herbicides !
À notre avis, les méthodes globales seront à court et moyen termes encore largement mises en oeuvre. Très récemment, Delye et al. (2016) ont révélé par un criblage phénotypique des résistances aux herbicides auxiniques chez le coquelicot.
Actuellement, des efforts se portent sur la résistance métabolique qui met en jeu des enzymes de détoxication chez l'adventice, donc des gènes codant principalement pour des P450, GST et GT (Beffat et al., 2016).
L'échantillonnage restera essentiel
Quelle que soit la méthode utilisée, l'échantillonnage dans les parcelles étudiées sera toujours une étape clé. De même, il faut disposer de populations de référence sensibles des adventices concernées. Selon notre expérience, il est difficile de bénéficier de telles populations de façon récurrente.
Les coûts des monitorings, supportés en grande part par les firmes agrochimiques qui ont la responsabilité du suivi de leurs molécules, sont importants. Ils requièrent des méthodes standard et fiables pour étudier d'éventuelles résistances. Nous l'avons vu, le criblage phénotypique et la maîtrise des paramètres de la résistance au laboratoire, en conditions contrôlées, répondent à ce cahier des charges.
*BIOtransfer. **Institut des sciences des plantes Paris-Saclay.
REMERCIEMENTS
Nous remercions Du Pont de Nemours pour les échantillons de coquelicot et pour l'autorisation de publier ces résultats.
 Imprimer
Imprimer