En Alsace, le cynips du châtaignier est essentiellement nuisible à l'apiculture en diminuant la ressource en nectar et pollen des arbres touchés. Il a fait l'objet d'une surveillance, en particulier pour évaluer la présence et l'identité de parasitoïdes susceptibles de réguler ses populations.
Le cynips, ravageur majeur
Une progression inexorable
Le cynips du châtaignier, Dryocosmus kuriphilus Yasumatsu (Hymenoptera, Cynipidae), est considéré au niveau mondial comme le principal ravageur du châtaignier (EPPO, 2005).
Le développement des larves de D. kuriphilus provoque la formation de galles caractéristiques sur les nouvelles pousses au printemps (photo 1). Les galles se développent sur les jeunes rameaux, les feuilles et à la base des organes floraux, affectant ainsi la production de pollen, de nectar et de fruits.
Originaire de Chine, le cynips du châtaignier a été involontairement introduit au Japon dans les années 1940 (Yasumatsu, 1951), aux États-Unis dans les années 1970 (Dixon et al., 1989), puis en Europe à partir de 2002 avec sa découverte en Italie (Brussino et al., 2002). En 2005, les premiers signalements ont été rapportés de France dans le département des Alpes-Maritimes (EPPO, 2007). Depuis son arrivée sur le territoire français, sa progression s'est faite inexorablement dans tout le quart sud-est et aujourd'hui sa présence est signalée dans près de 70 % des départements du territoire métropolitain (Chatufaud et al., 2017).
La situation en Alsace
Les premières découvertes de D. kuriphilus en Alsace datent de 2015. Le premier cas pour la région a été observé sur un châtaignier isolé en juin 2015 à Village-Neuf (Haut-Rhin), arbre abattu et détruit quelques semaines plus tard. Durant l'été 2015, deux nouvelles contaminations ont été recensées à Colmar et à Bergheim (Haut-Rhin) dans des vergers mixtes. Au printemps 2016, un nouveau cas a été découvert à Châtenois (Bas-Rhin) sur des arbres d'alignement. Le principal impact en Alsace concerne l'apiculture puisque la castanéiculture y est peu présente.
De ce fait, la Fredon Alsace, la Direction régionale de l'alimentation, de l'agriculture et de la forêt - Service régional de l'alimentation Grand-Est (DRAAF-SRAL Grand-Est), les groupements de défense sanitaire apicoles (GDSA) du Bas-Rhin et du Haut-Rhin et la chambre d'agriculture d'Alsace travaillent de concert à la surveillance de ce ravageur dans les deux départements.
Le travail de surveillance
Prélèvements de galles vertes et sèches
Depuis la découverte du cynips du châtaignier en 2015, la Fredon Alsace étudie le cortège de parasitoïdes associés à ce ravageur, en collaboration avec l'Inra PACA (UMR Institut Sophia Agrobiotech). Pour cela, un prélèvement de galles vertes (c'est-à-dire de galles de l'année) a été effectué en juin 2015 à Village-Neuf. Par la suite, des prélèvements de galles sèches (les galles de l'année précédente) ont été réalisés en janvier 2016 sur les sites de Bergheim et Colmar ainsi qu'en janvier 2017 sur les sites de Bergheim, Colmar et Châtenois.
Recherche de parasitoïdes
Les galles récoltées ont été disposées dans des boîtes d'émergence opaques et hermétiques, munies de tubes transparents, maintenues à température ambiante pour permettre l'émergence des parasitoïdes. Les émergences des parasitoïdes ont été réalisées en vérifiant régulièrement (tous les deux-trois jours) le contenu des tubes fixés sur les boîtes d'émergence puisque les adultes des parasitoïdes sont attirés par la lumière (ils présentent ce que l'on appelle un phototropisme positif). Une fois récupérés, ces insectes sont placés dans de l'alcool puis identifiés morphologiquement.
Résultats
Torymus sinensis bien présent
Ces prélèvements ont permis de mettre en évidence la présence de Torymus sinensis Kamijo (Hymenoptera, Torymidae) (photo 2), un parasitoïde spécifique de D. kuriphilus. Dans le cadre de programmes de lutte biologique fructueux, T. sinensis a été introduit dans les différentes parties du globe ayant connu une invasion de D. kuriphilus (Moriya et al., 1989 et 2003, Cooper et Rieske, 2007, Quacchia et al., 2014, Borowiec et al., 2013).
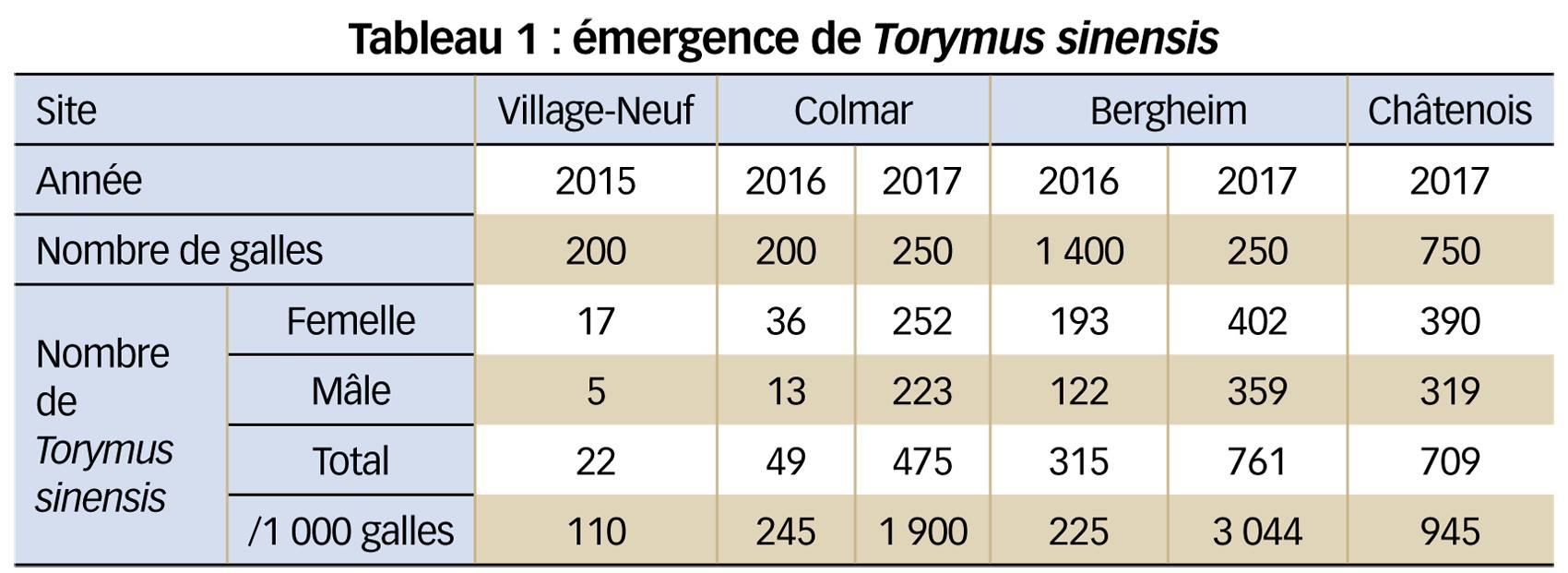
Les résultats de ces émergences sont présentés dans le Tableau 1. Pour faciliter les comparaisons et parce que le nombre de galles récoltées n'a pas été identique lors de chaque prélèvement, le nombre de parasitoïdes récoltés est ici calculé pour 1 000 galles.
Ces résultats montrent une abondance élevée de T. sinensis en Alsace comparé à ce qui a été observé un à deux ans après les premiers lâchers réalisés sur d'autres sites en France (Borowiec et al., 2014). De plus, on note une très forte augmentation des abondances sur les sites de Colmar et de Bergheim (multipliée respectivement par 8 et 13,5) entre 2016 et 2017.
Parasitoïdes indigènes
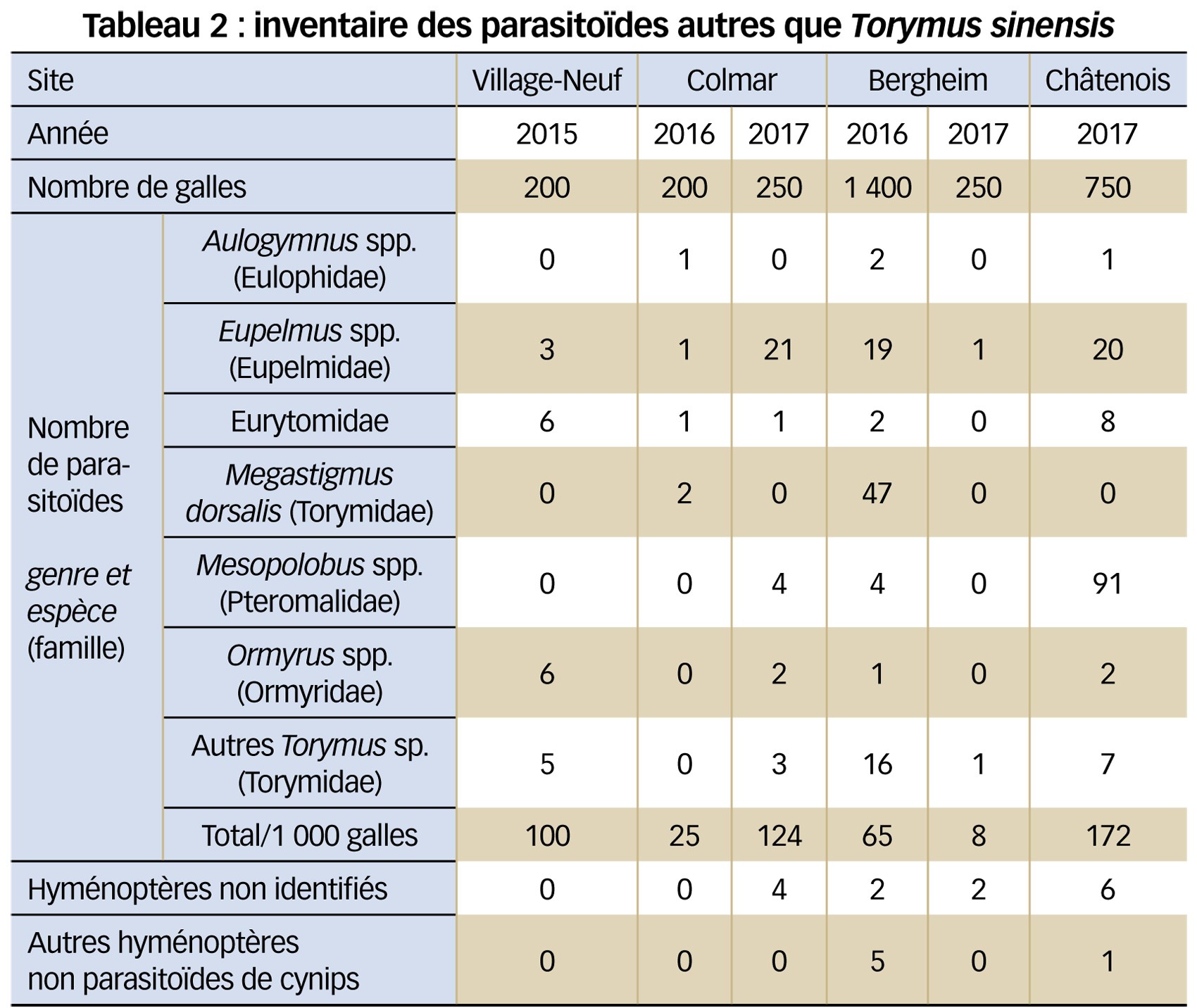
En plus de T. sinensis, ces prélèvements de galles ont permis de dresser un premier bilan concernant les parasitoïdes indigènes recrutés par le cynips du châtaignier en Alsace. Les familles majoritairement présentes dans les échantillons correspondent à celles généralement relevées dans de précédents inventaires faunistiques (Quacchia et al., 2012 ; Borowiec et al., 2015), à savoir des espèces appartenant aux familles des Eulophidae, Eupelmidae, Eurytomidae, Ormyridae, Pteromalidae et Torymidae.
Comme le montre le Tableau 2, l'abondance de ces parasitoïdes indigènes est beaucoup plus faible que celle de T. sinensis. C'est probablement la conséquence de leur plus grande polyphagie.
Les résultats montrent également que l'identification morphologique de ces espèces est très difficile et reste une affaire de spécialistes. Ceci est d'autant plus vrai que l'utilisation d'outils moléculaires (barcoding(1) par exemple) tend à montrer que de nombreux groupes sont confrontés à la présence d'espèces dites cryptiques. Il s'agit là d'espèces indifférenciables sur des critères morphologiques mais présentant des différences au niveau moléculaire. C'est notamment le cas du genre Eupelmus dont les espèces du groupe urozonus ont été révisées récemment, ce qui a abouti à la description de onze nouvelles espèces, dont certaines sont particulièrement abondantes sur D. kuriphilus en France (Al Khatib et al., 2014, Borowiec et al., 2015). Sans une identification précise des espèces, il est évidemment difficile de discuter de leur biologie.
Ainsi, il est possible que certaines d'entre elles soient, en réalité, plutôt associées à T. sinensis (hyperparasitoïdes(2), donc alliées du ravageur contre le parasite primaire qu'est T. sinensis). Néanmoins, ces espèces sont, pour la plupart, communément associées à d'autres espèces de Cynipidae, et notamment ceux présents sur les chênes.
Conclusion
Aucune introduction volontaire de T. sinensis n'est connue à ce jour dans les départements du Bas-Rhin et du Haut-Rhin. Ceci laisse à penser que le parasitoïde s'est dispersé de façon naturelle depuis des sites proches où sa présence est avérée : Suisse ou régions françaises voisines.
Les abondances élevées de T. sinensis montrent une bonne adaptation de ce parasitoïde sur les sites étudiés. Ceci confirme les résultats obtenus dans d'autres contextes géographiques différents en France où T. sinensis présente un succès d'établissement très élevé (Borowiec et al., 2014).
La présence de ce parasitoïde liée à un accroissement important de ses populations permet un optimisme certain quant à la couverture géographique de T. sinensis dans les zones colonisées par D. kuriphilus en Alsace à plus ou moins long terme.
La Fredon Alsace poursuivra ses travaux sur la répartition de D. kuriphilus et de T. sinensis en Alsace, en lien avec l'équipe RDLB de l'UMR ISA qui poursuit ses travaux sur la diversité morphologique et moléculaire des parasitoïdes associés à D. kuriphilus en Europe. Des introductions du parasitoïde pourront par ailleurs être envisagées dans l'éventualité de son absence dans de nouveaux foyers sur le territoire alsacien afin de permettre un contrôle efficace et durable de ce ravageur.
*Fredon Alsace. **Équipe « Recherche et développement en lutte biologique » - UMR « Institut Sophia Agrobiotech » - Inra, CNRS, Université Côte d'Azur. (1) Technique d'identification moléculaire basée sur l'utilisation et le séquençage d'un fragment du gène mitochondrial codant pour une enzyme, la cytochrome oxydase I. (2) Parasitoïde se développant au dépend d'un autre parasitoïde, ce dernier étant alors dit primaire.
 Imprimer
Imprimer