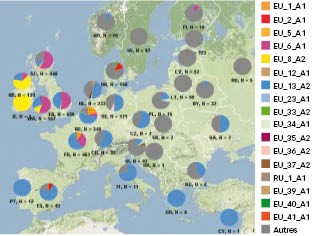
Fig. 1 : Génotypes de P. infestans en Europe de 2013 à 2015 Répartition de ces génotypes dans chaque pays (moyenne des trois années). Source : EuroBlight.net
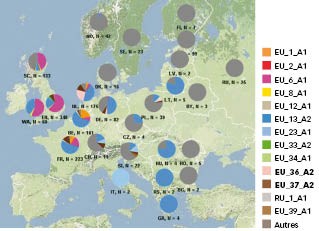
Fig. 2 : Fréquence des génotypes de P. infestans en Europe en 2016 Répartition de ces génotypes dans chaque pays cette année-là. Source : EuroBlight.net
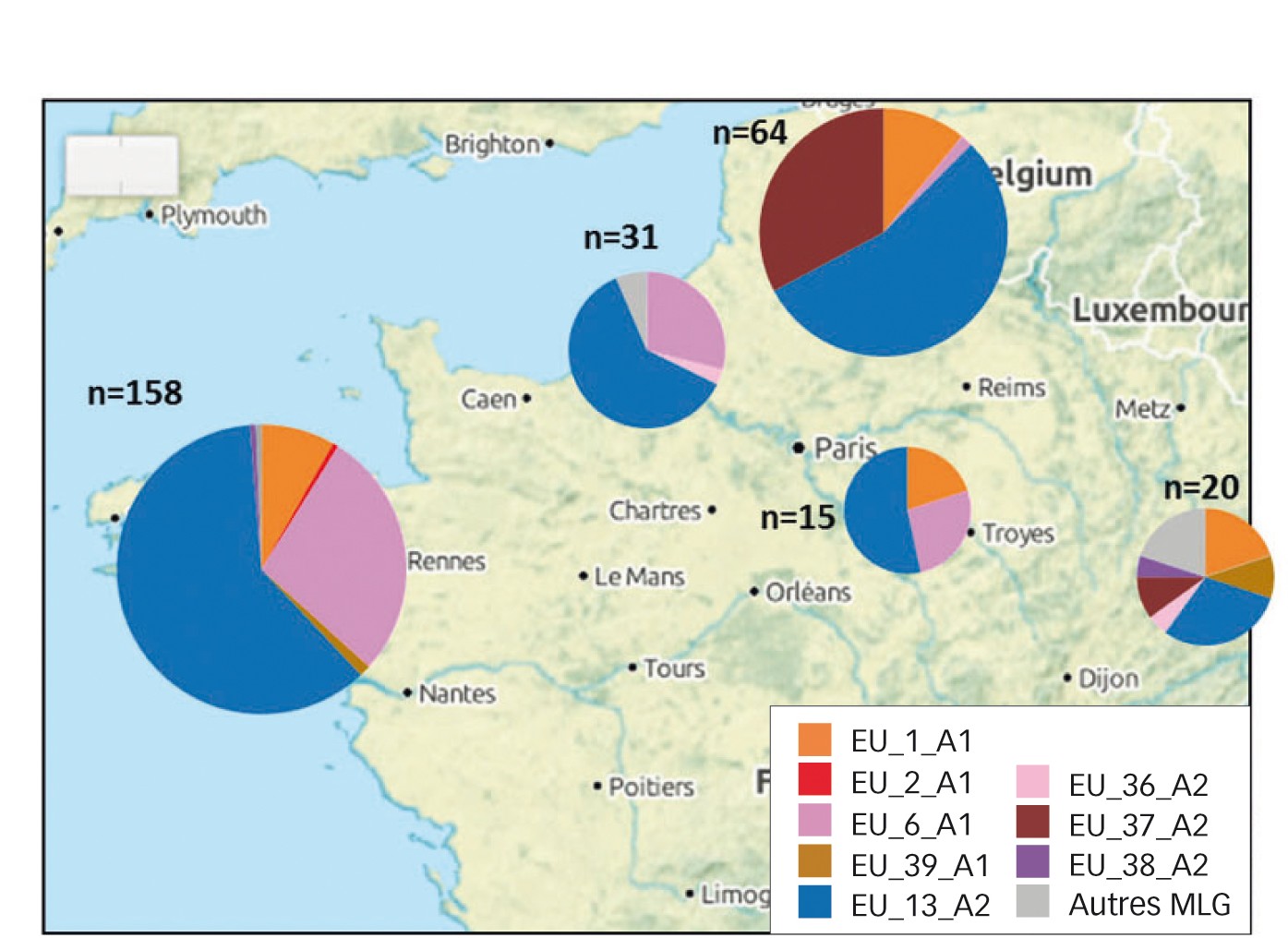
Fig. 3 : Fréquence des génotypes de P. infestans par région de production en France en 2016 Noter la fréquence du génotype EU 37_A2 dans le nord du pays.
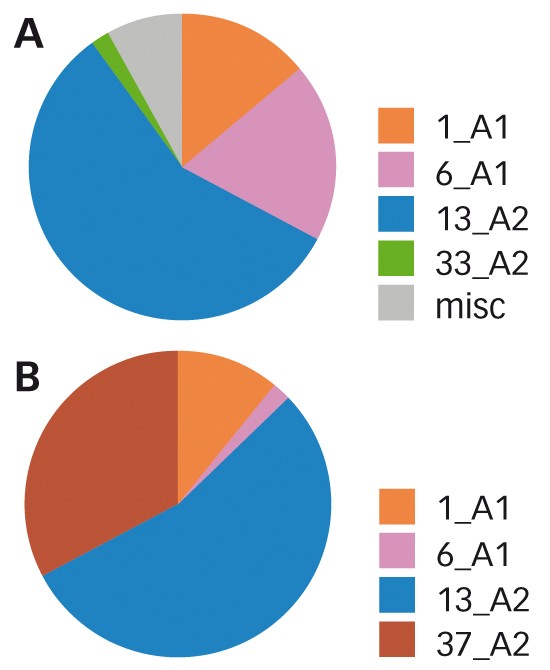
Fig. 4 : Évolution des génotypes de P. infestans dans le temps en Nord-Picardie L'émergence de EU_37_A2 est nette. A. Situation 2013-2015 (regroupement de 171 échantillons analysés). B. Situation en 2016 (64 échantillons analysés sur une année).
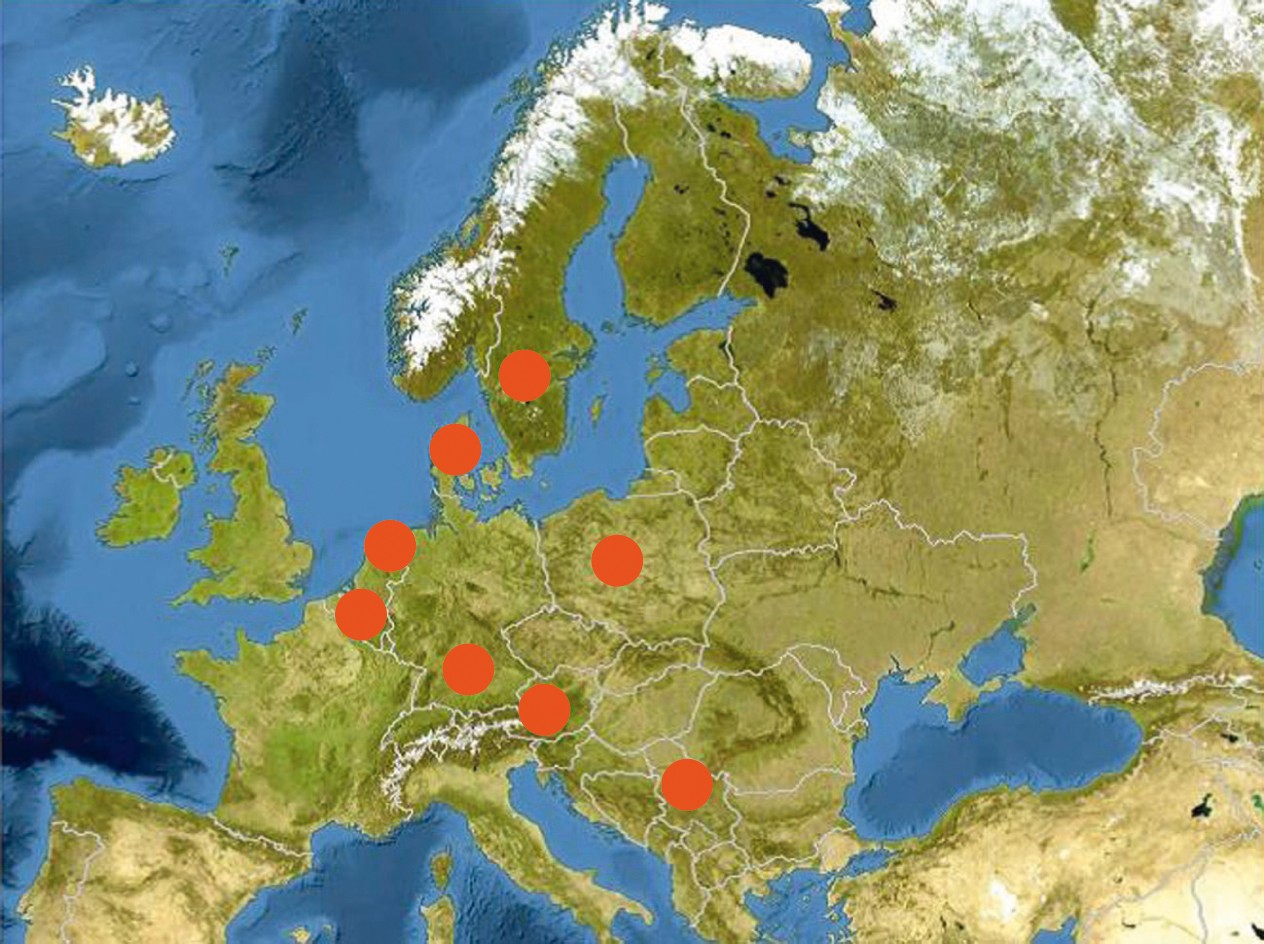
Fig. 5 : Alternaria solani et mutation F129L Régions européennes où a été identifiée cette mutation qui entraîne une résistance aux fongicides QoI (strobilurines notamment). Source : enquête EuroBlight 2016.
L'évolution en Europe des populations de Phytophthora infestans, agent du mildiou, ainsi que d'Alternaria solani et Alternaria alternata, agents de l'alternariose, a été présentée en mai 2017, dans le cadre du workshop EuroBlight.
Populations de P. infestans
Évolution de leur diversité en Europe
Chez P. infestans, de nombreux travaux de suivi montrent une évolution permanente des populations, avec de fréquents changements de leur composition(1).
En Europe de l'Ouest, les populations de P. infestans sont constituées de lignées clonales (génotypes) issues de la reproduction asexuée. Les génotypes dominants restent EU 13_A2 (Blue 13) et EU 6_A1 (Pink 6). Le génotype EU 33_A2 (Green 33) n'est détecté que dans quelques rares cas. À l'inverse, en l'Europe de l'Est et en Scandinavie, les souches dites « others » dominent ; il s'agit de populations très diversifiées, probablement issues de reproduction sexuée due à la germination des oospores (Figure 1).
Ces dernières années, de nouveaux génotypes ont émergé, notamment le génotype EU 37_A2, détecté pour la première fois en 2013 aux Pays-Bas. En 2016 il représente 5,5 % des échantillons testés en Europe, tous concentrés aux Pays-Bas et à proximité : Angleterre, Allemagne, Belgique, nord-ouest de la France (Figure 2). Un autre génotype, EU 36_A2, est apparu en 2014 dans le nord de l'Allemagne. Son nombre de souches a augmenté en 2016, en particulier aux Pays-Bas.
D'autres génotypes minoritaires, comme EU 39_A1, sont mis en évidence au Royaume-Uni ; ce génotype est présent dans de rares cas en Bretagne et en Alsace en 2016.
Focus sur la France jusqu'en 2016
En France, un groupe de travail regroupant l'Inra, les organismes professionnels du plant, Germicopa et Arvalis mène une action d'épidémiosurveillance depuis 2013. Durant cette période, la lignée EU 13_A2 (détectée en France depuis 2005) reste dominante sur l'ensemble du territoire ; la lignée EU 6_A1 (premier cas français détecté en 2004) est très fréquente dans l'Ouest (54 % en 2013, 28 % en 2016), mais diminue chaque année, en particulier dans le Nord (20 % en 2013-2015, mais 2 % en 2016). Une ancienne lignée, EU 1_A1, persiste dans le temps et en toutes régions, à une fréquence de 10 à 20 % selon les régions.
De nouvelles lignées émergent en 2016 (Figure 3 p. 20) : EU_37_A2 notamment dans le Nord (33 %) et l'Est (10 %), et EU_36_A2 dans l'Est (5 %), avec de rares cas dans le Nord. À noter que la population dans la région Est est très différente des autres régions de France avec une plus grande diversité de génotypes (Figure 3 p. 20).
En Belgique (Figure 2), les résultats du suivi sont proches de ceux du nord de la France : lignée EU 13_A2 majoritaire avec 50 % des échantillons, lignée EU 1_A1 représentant 22 % de la population, lignée EU 6_A1 fluctuant de 3 à 10 % (au contraire du nord de la France) ; les génotypes EU 37_A2 et EU 39_A1 y sont aussi détectés.
En France, c'est dans la partie nord (Figure 4 p. 20) que l'on note le plus d'évolution avec une très forte présence de EU 37_A2.
2017 en France : travail en cours
Les premiers résultats des populations françaises collectées en 2017 montrent peu de changement dans l'Ouest où les lignées EU 6_A1 et EU 13_A2 restent majoritaires (respectivement 40 et 45 % de la population). En revanche, dans le Nord, même si la lignée EU 13_A2 reste dominante (50 % de la population analysée actuellement), des changements importants sont observés : la lignée EU 37_A2 semble encore en extension (40 % de la population). En même temps, la lignée EU 6_A1 tend à disparaître.
Il est important de continuer l'épidémiosurveillance du territoire pour suivre l'évolution et la dynamique des nouvelles lignées EU 37_A2 et 36_A2, cette dernière lignée étant majoritaire aux Pays-Bas en 2017.
Il est indispensable de déterminer les caractères biologiques de ces lignées : pouvoir pathogène, capacité à surmonter des gènes de résistance de la plante, sensibilité réduite à des matières actives fongicides... Ces travaux sont actuellement traités dans le projet européen IPMBlight 2.0(2).
Résultats européens 2017 surprenants
Le génotypage des populations d'Europe de l'Ouest met en évidence de grands bouleversements en 2017 (données EuroBlight) :
- en Grande-Bretagne (sur 500 isolats), la lignée 6_A1 est dominante (50 %) et 13_A2 ne représente qu'environ 10 % de la population ; en revanche, les deux nouvelles lignées 37_A2 et 36_A2 semblent s'installer (24 % de 37_A2 et 1 % de 36_A2 dans le Sud-Est) ;
- aux Pays-Bas (sur 95 isolats), les isolats 36_A2 deviennent majoritaires (40 %), puis les isolats 37_A2 (20 %) et 13_A2 (15-20 %) ; aucun isolat 6_A1 n'est trouvé dans cette analyse.
Efficacité des fongicides
Lien entre lignée et résistance au fluazinam : des pistes au laboratoire
Les scientifiques recherchent des liens entre génotype (lignée clonale) et phénotype (agressivité, survie, sensibilité variétale, sensibilité aux fongicides...). En effet, certaines relations ont pu être identifiées par le passé, mais ne sont pas systématiques. Ainsi, la résistance aux phénylamides, connue depuis des années, concerne maintenant principalement les souches du génotype EU 13_A2 (Blue 13).
Des travaux ont été conduits pour déterminer des liens éventuels entre génotypes et résistance au fluazinam. En 2012, Huub Schepers a conduit une étude sur l'efficacité de plusieurs fongicides sur différents génotypes de P. infestans ; il montre une faible efficacité du fluazinam sur des souches de génotype EU 33_A2 (détecté aux Pays-Bas pour la première fois en 2010), prélevées dans des parcelles avec un mauvais contrôle de la maladie. Il suppose alors un lien entre le génotype 33_A2 et une moindre efficacité du fluazinam. Autrement dit, la résistance au fluazinam pourrait résulter dans ce cas d'un événement de mutation sélectionné au sein des lignées 33_A2.
Par contre, la fitness des souches 33_A2 (capacité à se multiplier et à survivre) semble faible : en 2010 et 2011 les souches 33_A2 représentaient 20 % de la population, mais seulement 6 % en 2012. De plus, en 2016, le génotype a presque complètement disparu. Ainsi, cette résistance supposée n'a pas favorisé l'extension de cette lignée.
Fluazinam en plein champ : étude au Danemark
Bent. J. Nielsen, au Danemark, a comparé les résultats d'efficacité du fluazinam dans des essais de plein champ. Il constate des efficacités excellentes en 2004 et en 2005 mais irrégulières, de 2006 à 2011, et même très faibles en 2007, quelle que soit la lignée clonale en présence. Il est démontré que le génotype 33_A2 n'est pas en cause. En fait, c'est la stratégie d'utilisation du fluazinam qui explique cette baisse d'efficacité : nombreux traitements en pleine saison et faibles doses en cas de faible pression.
Les ventes, donc les applications du fluazinam, ont fortement baissé en 2008. Une nouvelle stratégie avec une forte limitation du nombre d'applications de fluazinam solo est alors mise en place avec également une non-application en croissance active et forte pression. L'efficacité du fluazinam revient à un niveau correct. Ceci corrobore le coût associé à cette résistance, décrit plus haut.
Études en Belgique et en France
Des études conduites récemment par l'université de Wageningen montrent que tous les isolats de la nouvelle lignée EU 37_A2 ont une sensibilité réduite au fluazinam. Les échantillons étudiés proviennent des Pays-Bas et d'Allemagne dans des parcelles ayant présentées une faible efficacité du fluazinam ou de stockages avec de nombreux tubercules contaminés.
En France, l'étude conduite par Arvalis-Institut du végétal et Hervé Steva (voir p. 24 à 28) montre également que certaines populations françaises possèdent des souches résistantes au fluazinam. Toutefois un lien direct avec la lignée EU_37_A2 n'a pas été établi en France. Sur 34 populations étudiées (ici, une population représente la totalité des isolats collectés sur une même parcelle), six contiennent des souches résistantes au fluazinam (famille des dinitro-anilines).
Dans cette étude, l'efficacité d'autres matières actives a été analysée : une population présente une moindre sensibilité au diméthomorphe (CAA, carboxylic acyl amides) ; les 34 populations sont sensibles au cyazofamide (QiI, quinones inside inhibitors). Détails p. 24.
Actuellement, plusieurs expérimentateurs notent une moindre efficacité du fluazinam dans les essais au champ. Or ces dernières années, il faut noter une plus grande utilisation (plusieurs traitements dans la même campagne, sur la même parcelle) de cette matière active seule ou associée.
Un suivi de cette résistance est nécessaire, de même qu'une stratégie pour limiter l'augmentation des cas de résistance en limitant le nombre d'applications de fluazinam solo. Cette stratégie, selon les chercheurs néerlandais, devrait permettre de limiter l'extension des souches 37_A2.
Alternaria solani et A. alternata
Gravité de la maladie selon les pays
L'alternariose concerne davantage les pays européens de l'Est et du Nord ; toutefois elle est en augmentation dans les pays de l'Ouest depuis quelques années. Les causes sont multiples : réchauffement climatique, choix de variétés moins sensibles au mildiou mais plus sensibles aux champignons du genre Alternaria, moindre utilisation du mancozèbe, diminution des doses d'azote entraînant une sénescence précoce.
L'enquête EuroBlight a montré la sévérité de l'alternariose dans divers pays d'Europe en 2016, année plutôt très favorable au mildiou. La pression de l'alternariose a été forte en Allemagne mais également aux Pays-Bas et en Belgique.
Si Alternaria solani est considérée comme l'espèce essentiellement responsable de la maladie, Alternaria alternata est également très importante dans les Pays de l'Est.
Études réalisées et en cours
Les travaux de recherche sont axés sur la détermination, la détection précoce de l'espèce contaminante, et également sur l'évolution des résistances aux fongicides. On peut d'ailleurs signaler la mise au point pour la France d'un kit de diagnostic de l'alternariose au champ (Projet Flashdiag ALT), distribué par la société Anova Plus.
Divers fongicides sont homologués en Europe (c'est différent selon les pays ; par exemple le boscalid n'est pas autorisé pour cet usage en France) : mancozèbe, azoxystrobine, azoxystrobine + chlorothalonil, boscalid + pyraclostrobine, difénoconazole, mandipropamide + difénoconazole.
De nombreux suivis sur les résistances aux fongicides sont conduits dans différents pays, notamment en Allemagne par l'équipe de l'université de Munich (Technische Universität München, Center of Food and Life Science, Weihenstephan ; H. Hausladen, B. Adolf, J. Leiminger).
Résistances aux QoI (inhibiteurs externes de la quinone)
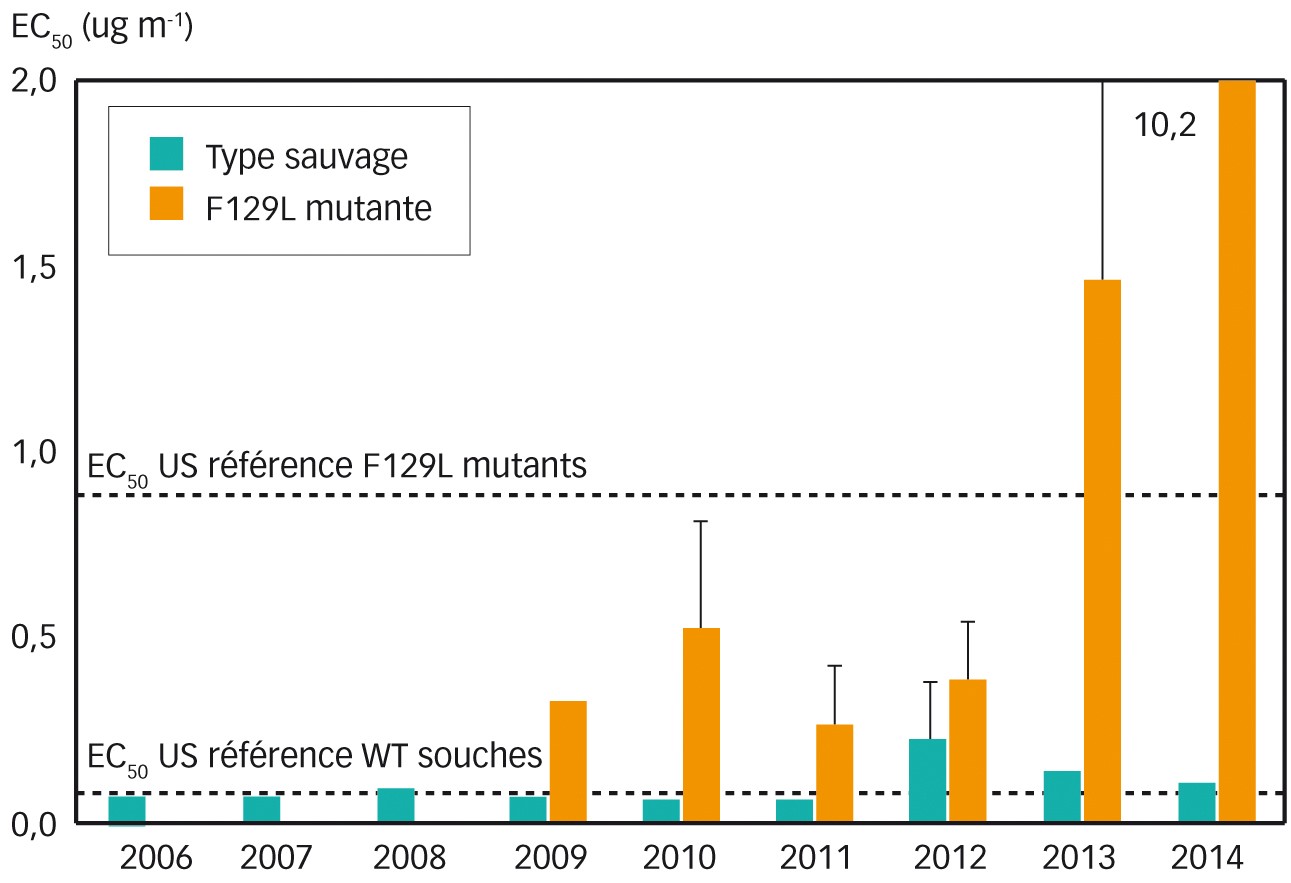
Dans Phytoma n° 670 de janvier 2014 (p. 24-25) et n° 690 de janvier 2016 (p. 28), nous évoquions les résistances aux QoI : la mutation G143A provoquant une résistance d'Alternaria alternata et la mutation F129L entraînant une résistance partielle d'Alternaria solani. Elles sont détectées dans plusieurs pays européens. La mutation F129L est trouvée dans le génotype II, plus rarement dans le génotype I d'A. solani.
En 2006, en Allemagne la présence de la mutation G143A dans Alternaria alternata est trouvée dans 21 % des échantillons. En 2009, elle passe au-delà de 40 %. Elle est de l'ordre de 60 % en 2014.
Dès 2009, la mutation F129L est détectée en Allemagne (5 % des échantillons) ; le nombre augmente régulièrement chaque année puis se stabilise autour de 35 % en 2013 et 2014. Cette résistance s'est dispersée en Europe (Figure 5) et semble limiter l'efficacité des strobilurines au champ.
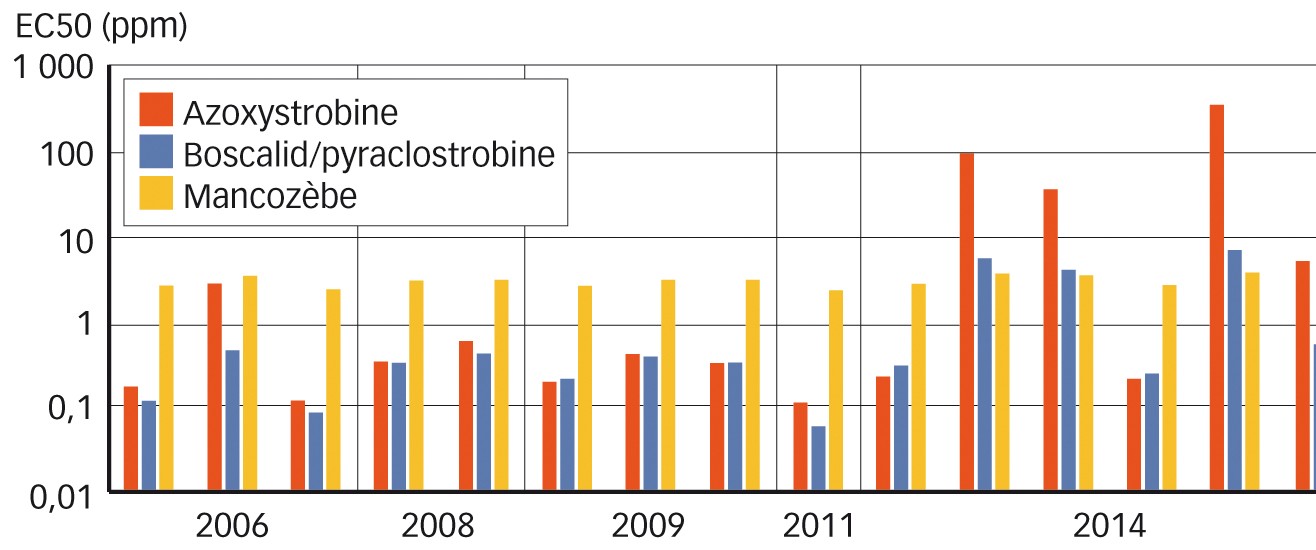
À la demande d'UPL Europe, les chercheurs de l'université de Wageningen ont conduit plusieurs études sur l'efficacité de fongicides, dont le mancozèbe, sur divers génotypes d'Alternaria solani. L'une d'elles, menée au laboratoire en 2015, compare les efficacités, sur quinze souches prélevées de 2006 à 2014 :
- de l'azoxystrobine (0,01 ; 0,1 ; 1 ; 10 ppm) ;
- de l'association boscalid + pyraclostrobine (0,01 ; 0,1 ; 1 ; 10 ppm) ;
- du mancozèbe (0,1 ; 1 ; 10 ; 100 ; 1 000 ppm).
Les résultats (Figure 6) montrent que la EC 50 (dose pour bloquer la germination de 50 % des spores) est stable pour le mancozèbe. En revanche, elle varie et a tendance à augmenter d'année en année pour la pyraclostrobine et l'association boscalid + pyraclostrobine. Cela montre que les souches évoluent et que l'efficacité de ces deux derniers fongicides baisse.
Pour la résistance à l'azoxystrobine, non seulement le nombre de sites où elle est trouvée s'accroît chaque année, mais une augmentation du niveau de résistance est aussi observée (Figure 7).
Double résistance aux QoI et SDHI
Le boscalid de la famille des SDHI (succinate deshydrogenase inhibitor) a été homologué contre l'alternariose en Allemagne dans le mélange azoxystrobine + boscalid en 2008. Dès 2012, des isolats résistants d'Alternaria alternata et A. solani ont été détectés. La résistance est maintenant présente dans plusieurs régions d'Allemagne et dans les pays voisins comme en Belgique. Des essais en serre conduits par Nicole Metz et au champ montrent une baisse d'efficacité de l'ordre de 25 %.
En Belgique il a été démontré que certaines souches présentent une double résistance aux QoI et SDHI. En revanche, aucune étude européenne ne montre une résistance au mancozèbe et au difénoconazole.
Conclusion
Le constat
La diversité des génotypes de Phytophthora infestans peut faciliter la sélection de résistance aux fongicides et le contournement de résistances variétales. La baisse d'efficacité du fluazinam (résistance en pratique) a été constatée en Europe en 2007-2010 et à nouveau plus récemment en France. Dans certains cas, elle est liée à l'émergence de nouveaux génotypes ; dans d'autres cas, à une multiplication de traitements avec la même matière active.
Stratégies strictes
Au vu de ces résultats, l'apparition de nouvelles lignées clonales chez Phytophthora infestans et des cas de résistance pour ce dernier et chez les Alternaria, il faut mettre en place des stratégies anti résistance :
- traiter uniquement lorsque nécessaire, au bon moment en utilisant les outils d'aide à la décision ;
- faire le bon choix des modes d'action des fongicides en fonction de la croissance de la plante et de la pression de maladie ;
- c'est essentiel, alterner les modes d'action et éviter la répétition de traitements avec la même matière active tout au long de la saison et sur un vaste territoire.
Sur A. solani et A. alternata, il existe de nombreux cas de résistance et pour plusieurs fongicides. Dans plusieurs situations, il s'agit de résistances partielles mais qui entraînent des baisses d'efficacité. Pour éviter la généralisation des résistances, il est indispensable de mettre en place des stratégies strictes : traitement dès le début de l'épidémie (pas sur maladie bien développée), alterner les matières actives, utiliser des matières actives multisites.
*Comité de rédaction de Phytoma. **Inra - Centre de Bretagne-Normandie - UMR IGEPP - Le Rheu.
 Imprimer
Imprimer