Champ de maïs totalement envahi par Striga : on distingue difficilement les plants de maïs en voie de desséchement. Les plants de Striga se sont développés en parasitant directement ceux de maïs. Photo et vignettes haute de page : Toothpick Project
Une méthode originale
Agent pathogène et acides aminés
Les échanges sur le parasite Striga avaient pour objectif de donner à chaque chercheur les moyens de développer la nouvelle méthode de lutte biologique dans son propre pays. Outre les exposés en salle, les principales techniques à mettre en oeuvre ont été montrées au laboratoire et en serre.
L'originalité de cette méthode consiste à utiliser, d'une part, un agent pathogène spécifique de la plante parasite pour la détruire, agent nommé Fusarium oxysporum f.sp. strigae et, d'autre part, des acides aminés toxiques pour la plante parasite. Cette originalité justifie, à nos yeux, de faire connaître cette approche.
Contexte
100 millions d'hectares infestés
Le genre Striga compte une quarantaine d'espèces dont onze parasites des plantes cultivées. Parmi ces dernières, S. hermonthica est celle qui provoque les dégâts les plus importants. Elle parasite en effet de nombreuses plantes cultivées telles que le maïs, le sorgho, le millet et le niébé (Vigna unguiculata), cultures vivrières essentielles dans de nombreux pays africains.
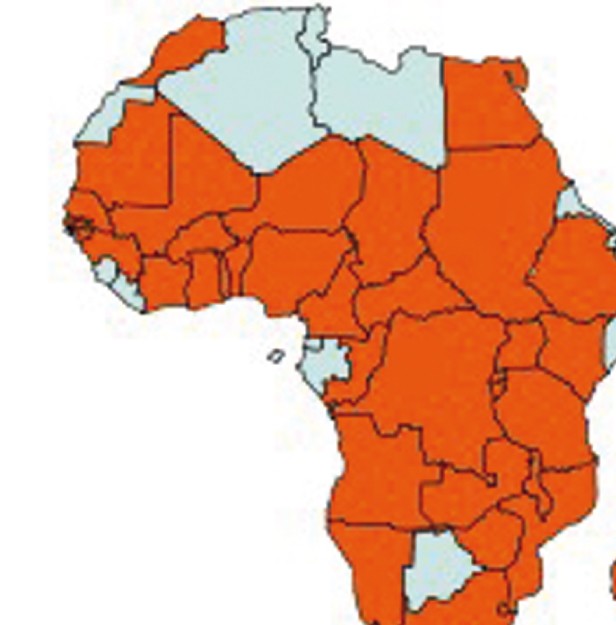
On estime à plus de 100 millions d'hectares les zones infectées et ce sont plus de 300 millions de personnes qui subissent les pertes engendrées par cette plante. Les pertes de rendement sont de l'ordre de 50 %, mais elles sont extrêmement variables selon le niveau d'infestation du sol, la culture considérée et les conditions environnementales. Le parasite Striga représente le principal agent limitant la production d'aliments en Afrique. Il est présent sur quasiment tout le continent (voir Figure 1).
Biologie de Striga sp : développement aux dépens des racines de l'hôte
Striga produit de très nombreuses graines qui restent dormantes dans le sol jusqu'au moment où les conditions pédo-climatiques (température et humidité) les conditionnent à la germination. Mais la germination des graines préconditionnées nécessite la présence d'une racine d'une plante-hôte.
Ce sont en effet les exsudats racinaires de la plante-hôte qui induisent la germination de la plante parasite. Très rapidement, l'extrémité de la radicule de Striga se transforme en haustorium, qui va assurer l'adhésion puis la pénétration de la racine de Striga dans la racine de la plante où elle va créer une connexion avec les vaisseaux.
Dès lors, Striga va se développer aux dépens de son hôte, puisant l'eau et les éléments nutritifs dans les vaisseaux de cet hôte. La plante parasite se développe rapidement, fleurit et produit de très nombreuses graines. Celles-ci tombent ensuite au sol où elles entrent en dormance et peuvent se conserver pendant de nombreuses années. Le stock semencier devient vite très important.
Lutte biologique anti-Striga : identification d'un candidat
Méthode inspirée de la lutte contre les cultures illicites
Diverses méthodes de lutte ont été proposées, mais elles sont inefficaces ou beaucoup trop onéreuses pour le paysan africain. En pratique, c'est le désherbage manuel qui est le plus fréquemment employé ; il est principalement effectué par les femmes qui y consacrent énormément de temps.
C'est dans ce contexte particulier que la lutte biologique est envisagée en utilisant un agent pathogène spécifique de Striga. D. Sands, spécialiste des bio-herbicides, a travaillé sur la lutte contre des cultures illicites (coca, pavot, cannabis). Cette lutte fait appel à la fois à des acides aminés toxiques pour les plantes et à des agents pathogènes spécifiques de ces cultures. C'est cette double approche qui a été suivie pour proposer une méthode de lutte contre Striga.
identification d'un potentiel bio-herbicide
Fusarium oxysporum f.sp. strigae est un pathogène qui attaque Striga et provoque le dépérissement des plantes. À partir de plantes dépérissantes observées dans les cultures, il a été possible d'isoler des souches de Fusarium oxysporum et de démontrer leur virulence sur Striga.
La spécificité parasitaire étroite qui caractérise les formes spéciales de F. oxysporum permet d'envisager d'utiliser l'agent pathogène F.o. f.sp. strigae pour détruire la plante parasite sans affecter la plante-hôte. Ayant vérifié la validité de ce concept, il fallait, d'une part, améliorer l'efficacité de la méthode en augmentant l'agressivité des souches pathogènes de Striga et, d'autre part, mettre au point un système de production, distribution et application du bio-herbicide, aussi simple et peu onéreux que possible.
Sélection de souches hyper-productrices d'acides aminés
Identifier au laboratoire les acides aminés intéressants
Pour améliorer l'agressivité des souches sauvages de F.o. f.sp. strigae, il est proposé d'utiliser des variants hyperproducteurs de certains acides aminés. La stratégie originale proposée consiste à identifier des acides aminés qui, apportés en concentration suffisante dans la rhizosphère des plantes, vont perturber le fonctionnement des enzymes de biosynthèse des acides aminés appartenant à la même voie métabolique.
Ceci se traduit concrètement par un effet toxique pour la plante (voir Encadré 2).
Il convient donc, d'une part, d'identifier des acides aminés à effets néfastes contre Striga mais sans effet pour la plante cultivée et, d'autre part, de sélectionner des mutants de F. oxysporum hyper-producteurs des acides aminés ainsi identifiés.
Pour détecter les effets (bénéfiques ou néfastes) des acides aminés sur les plantes, un protocole est disponible. Il consiste à placer les graines dans un papier-filtre imbibé d'un analogue de chaque acide aminé sélectionné et à observer la vitesse de germination et la croissance des plantules. Si un analogue d'acide aminé entrant dans la voie de biosynthèse des protéines rend celles-ci non fonctionnelles, il en résulte des effets délétères sur le développement de la plante.
Tester les acides aminés dans un sol
Ce premier screening effectué in vitro, il faut vérifier les effets observés en répétant l'expérience dans un sol. En effet, les acides aminés peuvent être adsorbés sur les argiles ou la matière organique du sol et/ou rapidement métabolisés par les micro-organismes. Les effets observés in vitro ne le sont donc pas nécessairement in situ.
Sélectionner des souches naturelles hyperproductrices
La production de variants de F.o. f.sp. strigae hyper-producteurs d'un acide aminé précédemment choisi pour sa toxicité vis-à-vis de Striga se fait sans recours à une molécule mutagène. Il suffit d'étaler des conidies de Fusarium à la surface d'une boîte de Petri au centre de laquelle est placé, dans une cavité, un analogue d'acide aminé. Seuls les mutants hyper-producteurs de cet aminé vont former de petites colonies à la surface de la gélose, car même en présence de l'analogue, ils produisent suffisamment d'acide aminé pour assurer la production de protéines fonctionnelles.
Il faudra les repiquer et vérifier leur caractère hyper-producteur d'acide aminé. L'opération peut être répétée plusieurs fois pour sélectionner des variants de plus en plus hyper-producteurs de l'acide aminé.
Production et distribution de l'inoculum pathogène
Le projet « cure-dent »
Dans un premier temps, pour conduire une campagne d'expérimentation au champ, au Kenya, sur maïs, trois variants d'une souche de F.o. f.sp. strigae, hyperproducteurs de tyrosine, leucine et/ou methionine ont été sélectionnés et proposés aux agriculteurs sous le nom de Foxy T14.
L'objectif étant de mettre cette méthode de lutte à disposition des petits paysans africains, il est exclu de produire cet inoculum industriellement dans des fermenteurs de grande capacité puis de le formuler de telle sorte qu'il soit distribué comme cela se fait en Europe pour les produits de biocontrôle à base de micro-organismes.
Un schéma original de production et distribution de l'inoculum est proposé sous l'appellation « The Toothpick Project » ou « projet cure-dent »(1). L'idée consiste à utiliser un cure-dent pour distribuer aux agriculteurs l'inoculum « primaire » produit au laboratoire, la production de l'inoculum « final » étant réalisée directement par l'utilisateur final, c'est-à-dire le petit paysan.
Processus de culture des souches
Les souches de F.o. strigae sélectionnées sont cultivées, au laboratoire, en boîte de Petri sur un milieu de culture gélosé classique, type PDA. Lorsque le développement est suffisant, une cinquantaine de cure-dents en bois, précédemment stérilisés, sont déposés à la surface de la culture fongique.
Après trois à quatre jours, ils sont colonisés par le Fusarium. Ils sont alors retirés de la boîte de Petri et mis à sécher lentement en conditions aseptiques. Puis ils sont introduits individuellement dans des « pailles », normalement utilisées pour la boisson, qui sont scellées à leurs extrémités.
Cet inoculum est alors facilement transporté et distribué aux paysans qui produiront eux-mêmes l'inoculum « final ». Ce champignon du genre Fusarium est facile à cultiver sur des grains de riz ou de millet préalablement cuits.
Essai au Kenya
Lors d'une première campagne d'expérimentation à grande échelle au Kenya, F.o. strigae a été cultivé sur des grains de riz cuit placés dans des boîtes en matière plastique, désinfectée à l'éthanol. Trois cure-dents colonisés par trois variants différents de F.o. strigae sont introduits dans le riz et servent à l'inoculation de ce dernier. Après trois jours à température ambiante avec brassages réguliers, le riz est suffisamment colonisé. La méthode permet d'apporter au sol dans le trou de plantation un inoculum en phase de croissance et multiplication assurant une efficacité maximale.
Application de l'inoculum et évaluation de la méthode
Des résultats très positifs
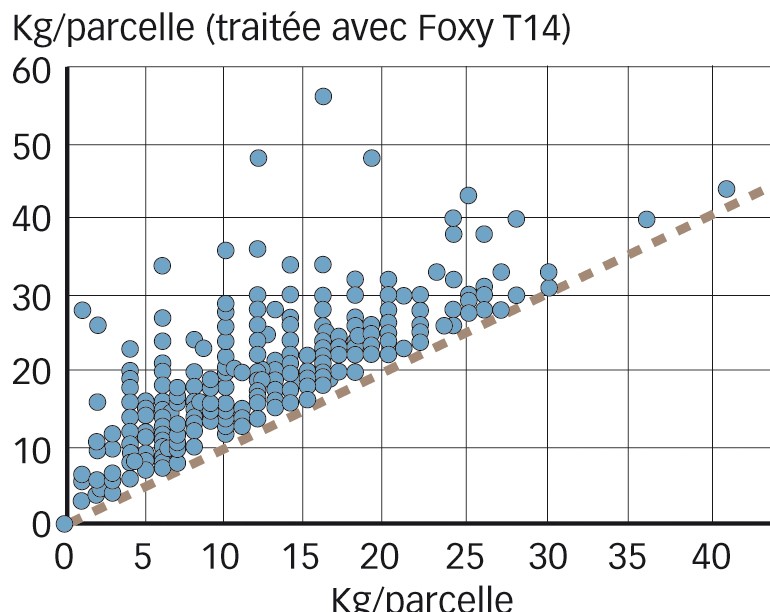
La première application à grande échelle a concerné 500 fermes. Le maïs étant semé manuellement, 2 g de riz inoculé ont été apportés dans chaque trou de plantation. Les notations ont porté sur l'émergence et le développement de Striga, sur la croissance et le rendement du maïs lors des deux périodes de culture réalisées pendant la longue et la courte saison des pluies. Le résultat est très intéressant : la quasi-totalité des paysans (99,6 %) ont enregistré, dans la parcelle traitée par F.o. strigae, un rendement équivalent ou meilleur que dans la parcelle témoin (conduite identique, à l'exception de l'apport de Fusarium) (Figure 2).
Le rendement enregistré pendant la saison des pluies de mars à juin a été supérieur de 56,5 % dans les parcelles traitées et 30 % des paysans ont doublé leur rendement par rapport au témoin. Pendant la seconde période de culture, climatiquement moins favorable, les rendements sont plus faibles, mais 42 % plus élevés dans les parcelles traitées par rapport aux parcelles témoin.
L'émergence de Striga a été réduite de 80 % sur la première saison de culture du maïs et de 92 % sur la seconde période de culture. Cette première application de Foxy T14 a donc permis de valider cette méthode de lutte à l'échelle de 500 fermes au Kenya.
Sécurité : pas de toxine détectée
Vu les manipulations nécessitées par cette méthode et effectuées manuellement par les paysans, essentiellement des femmes, il est important de s'assurer que les souches de F.o. strigae sélectionnées ne produisent pas de toxine. Aucune trace des cinq toxines les plus communément produites par Fusarium n'a été détectée. Il s'agit de : deoxynivalenol, 3-acetyldeoxynivalenol, 15-acetyldeoxynivalenol, nivalenol et zearalenone. De même, aucune trace de fumonisine n'a été détectée.
Perspectives
Adapter la méthode à d'autres pays et d'autres cultures
Il convient maintenant d'assurer le développement de cette méthode de lutte dans différents pays africains dans lesquels sévit Striga et élargir cette lutte à d'autres cultures que le maïs. En effet, comme nous l'avons précisé, il convient d'identifier des acides aminés toxiques pour Striga mais qui n'affectent pas la plante-hôte.
Or Striga affecte de nombreuses cultures vivrières autres que le maïs (sorgho, millet, niébé, pois chiche, arachide, etc.) Il convient donc d'éprouver l'effet des acides aminés sur toutes ces espèces végétales, puis de sélectionner des variants de F.o. f.sp. strigae hyper-agressifs car hyper-producteurs des acides aminés sélectionnés.
D'autre part, pour des raisons réglementaires mais aussi scientifiques (adaptation des souches de F.o. f.sp. strigae aux conditions pédo-climatiques locales), il est indispensable de sélectionner des souches de F.o. f.sp. strigae isolées des différents pays dans lesquels la lutte sera appliquée.
Créer un réseau de chercheurs
Ainsi s'ouvre un vaste champ de recherche/développement dans chacun des pays susceptibles de développer cette lutte biologique contre Striga.
Un des principaux objectifs de cette session de formation à l'université de l'État du Montana (Montana State University) était de fournir les bases indispensables à la mise en route de cet ambitieux programme dans différents pays africains et de créer un réseau de chercheurs prêts à collaborer au développement de cette méthode de lutte.
Perspectives en Europe
L'orobanche et le trèfle rouge
Il faut savoir que des essais de lutte biologique contre l'orobanche ont déjà eu lieu en Europe. Un article récent rend compte des résultats d'une expérimentation réalisée au champ, à Dijon. Après avoir sélectionné les acides aminés potentiellement toxiques pour l'orobanche, l'essai visait à utiliser ces acides aminés pour diminuer l'incidence de l'orobanche en culture de trèfle rouge (Fernández-Aparicio, 2017).
Longtemps négligée en Europe et particulièrement en France, la lutte biologique contre les adventices mérite d'être prise en considération si l'on souhaite réellement diminuer l'utilisation des pesticides de synthèse et en particulier des herbicides.
Faciliter l'usage du biocontrôle
Cet exemple africain appelle à réfléchir sur l'approche européenne du biocontrôle. En Europe, cette approche passe nécessairement par une autorisation contraignante d'autorisation de mise sur le marché qui conduit à une production centralisée des agents de lutte.
N'y aurait-il pas, en regard de cette approche industrielle, de la place pour une production décentralisée d'agents de lutte directement au niveau des exploitations qui vont les mettre en oeuvre ? Il n'est pas question d'autoriser tout et n'importe quoi, mais de faciliter l'usage de produits de biocontrôle qui auraient satisfait des exigences minimales d'innocuité pour l'homme et l'environnement.
1 - Des auteurs et leurs spécialités
Claude Alabouvette, qui a beaucoup étudié F. oxysporum, a eu le plaisir d'être invité à participer à cette session de formation pour partager ses connaissances sur cette espèce.
Cindy Morris, chercheur à l'unité pathologie végétale de l'Inra, à Avignon, est spécialiste en écologie microbienne. Elle collabore avec David Sands dans la mise au point de la lutte contre Striga.
RÉSUMÉ
2 - Comment les acides aminés peuvent-ils être toxiques pour les plantes ?
Les plantes sont autotrophes, c'est-à-dire qu'elles fabriquent toutes les molécules organiques dont elles ont besoin pour leur développement à partir du carbone inorganique. En revanche, si elles peuvent puiser certaines molécules organiques directement dans l'environnement, elles répriment les voies de synthèse de ces molécules.
C'est en particulier le cas pour la synthèse des acides aminés qui partagent certaines voies de biosynthèse. Ainsi la présence dans la rhizosphère de lysine peut entraîner pour la plante une carence en thréonine et/ou en méthionine.
En effet, ces acides aminés partagent les mêmes voies de synthèse et la présence de lysine inhibe une enzyme clé dans la synthèse de lysine, mais aussi de thréonine et de méthionine.
De la même façon, la synthèse de leucine, d'isoleucine et de valine est interconnectée. Il en est de même pour celle de la phénylalanine, de la tyrosine et du tryptophane. La présence dans l'environnement d'un de ces acides aminés peut entraîner la répression de la synthèse d'autres acides aminés partageant la même voie métabolique et déterminer des carences pour la plante.
Compte tenu de l'importance des acides aminés pour la synthèse des protéines structurelles, ces carences peuvent être létales pour la plante.
POUR EN SAVOIR PLUS
CONTACT : c.ala@free.fr
LIEN UTILE : www.toothpickproject.org
BIBLIOGRAPHIE : - Nzioki H. S., Oyosi F., Morris C. E., Kaya E., Pilgeram A. L., Baker C. S., Sands D. C., 2016, Striga biocontrol on a toothpick: A readily deployable and inexpensive method for smallholder farmers, Frontiers in Plant Science, 7:1121. doi: 10.3389/fpls.2016.01121.
- Fernández-Aparicio M., Bernard A., Falchetto L., Marget P., Chauvel B., Steinberg C., Morris C. E., Gibot-Leclerc S., Boari A., Vurro M., Bohan D. A., Sands D.C. and Reboud X., 2017, Investigation of amino acids as herbicides for control of orobanche minor parasitism in red clover, Frontiers in Plant Science, 8:842. doi: 10.3389/fpls.2017.00842.
 Imprimer
Imprimer