Le contrôle des bioagresseurs par une gestion climatique adaptée (chauffage, brumisation et aération, spectre lumineux...) représente une stratégie prometteuse pour diminuer l'utilisation des produits phytopharmaceutiques en cultures ornementales et maraîchères sous serre. En effet, le développement et la répartition des agents biotiques, qu'ils soient bénéfiques ou nuisibles, dépendent directement d'un ensemble de variables climatiques (température, humidité, lumière...). La connaissance fine des conditions de vie de chaque organisme est un préalable indispensable à la mise en oeuvre d'une telle stratégie.
Corréler température, humidité et apparition des foyers
Modélisation et création d'alarmes « climatiques »
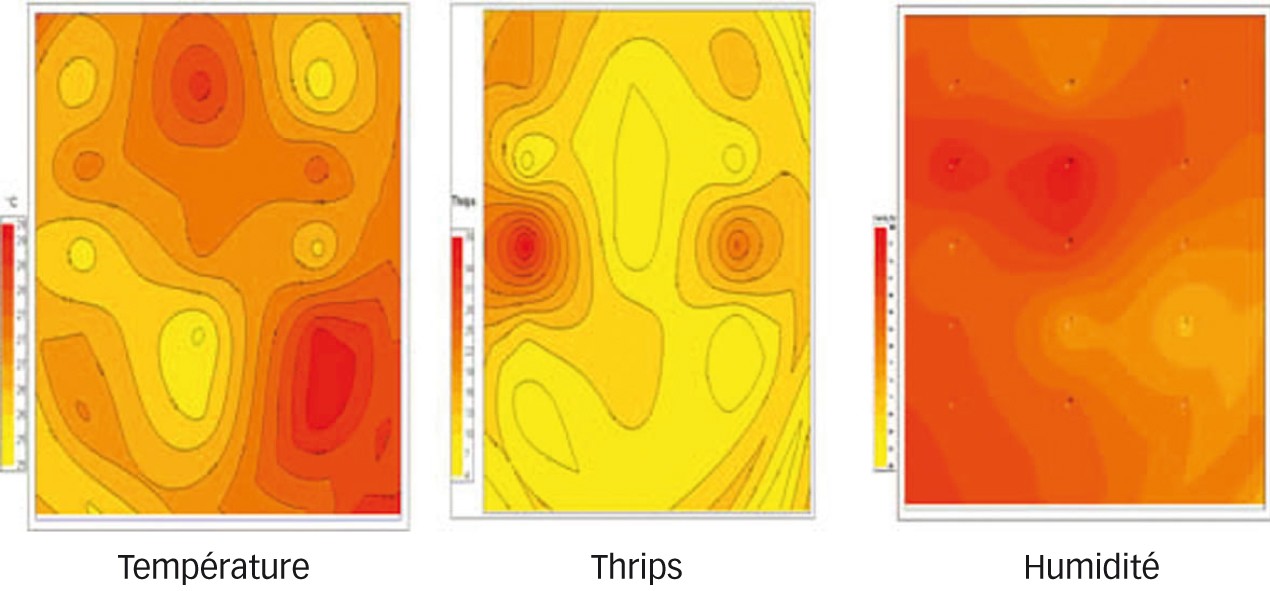
Les outils de modélisation, notamment à l'aide de logiciels de mécanique des fluides (Computational Fluid Dynamics, CFD), permettent de caractériser le microclimat à l'intérieur des serres et particulièrement au niveau de la couche limite des feuilles. Le croisement de ces données climatiques avec celles issues de l'échantillonnage spatial d'un bioagresseur ou d'un auxiliaire permet de définir les conditions climatiques favorables à son installation (Figure 1) (Fatnassi et al., 2012 ; Fatnassi et al., 2015). Par exemple, en étudiant la dynamique de colonisation du couvert végétal par les acariens auxiliaires, Neoseiulus cucumeris et Amblyseius swirskii utilisés pour lutter contre le thrips, en fonction du climat, nous avons pu définir les paramètres physiques locaux permettant d'accroître leur efficacité ; l'humidité semble jouer un rôle prépondérant (Fatnassi et al., 2015).
À partir des connaissances acquises (thrips, acariens auxiliaires), de nouvelles études ont été menées, toujours à l'aide de la modélisation spatio-temporelle (CFD) (Fatnassi et al., 2018), afin de créer des alertes « bioagresseur » ou « condensation », en se basant respectivement sur la détection d'un climat favorable au développement du ravageur ou l'évolution de la condensation (détection précoce, distribution dans la serre, durée), de façon à mettre en oeuvre en temps voulu un moyen de lutte ou à déclencher la déshumidification.
Spectre lumineux et pression parasitaire
Modifier le spectre lumineux sous abri
En production sous abri, la qualité et la quantité de lumière transmise jouent un rôle important sur le développement de la culture. Différentes solutions permettent d'ajuster ces paramètres. Des pigments intégrés dans les films polyéthylène leur confèrent des caractéristiques spécifiques de transmission lumineuse. Les producteurs peuvent également appliquer des produits de blanchiment en pulvérisation sur leurs abris plastique ou verre (Reduheat, TransPAR...). Dans les serres, des écrans installés au-dessus de la culture permettent d'adapter la luminosité. Enfin, certaines cultures peuvent bénéficier d'un éclairage artificiel spécifique (LED ou autre type d'éclairage). Au-delà de ce rôle sur le développement végétal, l'adaptation du spectre lumineux semble être un levier prometteur pour lutter contre certains bioagresseurs.
Filtres lumineux et effet du rouge lointain
La qualité de la lumière sous abri peut jouer un rôle important dans la régulation des pressions parasitaires. La couverture d'un abri altère plus ou moins le spectre lumineux, ce qui influence l'architecture et la nutrition de la plante, ainsi que le comportement des insectes (ravageurs, auxiliaires) et la pression parasitaire de pathogènes. Les expérimentations menées par l'institut technique de l'horticulture Astredhor à partir de 2005 sur les filtres lumineux ont révélé occasionnellement des écarts importants entre les populations (thrips et aleurodes) observées sous couvertures classiques et sous filtres lumineux. Ces filtres sont utilisés en cultures ornementales et de jeunes plants potagers afin de mieux maîtriser la croissance et le développement des plantes. Ainsi, certains filtrent la lumière rouge lointaine (RL) et diminuent « le syndrome de l'évitement de l'ombre » chez les plantes : avec moins de RL transmis dans les structures, les plantes restent plus compactes et nécessitent moins de régulateurs de croissance chimiques (Stapel et al., 2011).
Pour des conditions de température ambiante et d'hygrométrie similaires entre les structures étudiées, une diminution des populations ravageurs volants (thrips et aleurodes) sur pièges chromatiques gluants a été observée sous des filtres lumineux RL : bâche Solatrol, pigments de blanchiment Reduheat et TransPar (Stepp, 2006 ; Stepp, 2007). Les cultures sous filtres RL présentent également moins de dégâts dus aux ravageurs (piqûres, déformations...).
Rouge lointain : mécanismes en oeuvre
Chez les plants de concombre, tabac, tomate et Arabidopsis, une baisse de résistance contre insectes ravageurs est observée après inactivation du photorécepteur phytochrome B par surexposition à la lumière rouge lointain ou par mutation (McGuire and Agrawal, 2005 ; Izaguirre et al., 2006 ; Moreno et al., 2009). Dans ces cas, la nutrition des végétaux est plus élevée, le développement des populations de ravageurs est donc plus conséquent et les dégâts occasionnés dans les cultures sont plus importants. Le syndrome de l'évitement de l'ombre chez les plantes induit par la lumière RL semble diminuer la résistance contre les bioagresseurs : la plante mobilise ses ressources pour combattre le stress lié au manque de luminosité plutôt que celui lié à l'attaque du bioagresseur (De Wit et al., 2013).
Par ailleurs, l'augmentation du rapport R/RL constitue également une voie intéressante pour lutter contre des pathogènes tels que le botrytis (Cerrudo et al., 2012) : un rapport R/RL élevé favorise l'activation du phytochrome B et stimule le système de défenses des plantes via des voies métaboliques d'induction salicylique et jasmonique (Ballaré et al., 2012).
Couvertures UVA/UVB, bioagresseurs et auxiliaires
De nombreuses publications mettent en évidence des effets des UVA et UVB sur les populations de ravageurs. La pression des populations d'aleurodes, de thrips, d'acariens, de certaines mineuses et de pucerons s'avère en général moins importante sous couverture UVA et UVB bloquante, probablement par le fait que les cultures sont plus difficilement repérables (Antignus, 1998 ; Kumar et Poehling, 2006 ; Doukas et Payne, 2007a ; Doukas et Payne, 2007b). En revanche, les cultures exposées aux UVB sous les couvertures UV transparentes peuvent, via les photorécepteurs UVR8, synthétiser des composés jasmoniques et phénoliques anti-herbivores qui diminuent la qualité nutritionnelle des feuilles et qui induisent des signaux d'alerte destinés à attirer les ennemis naturels (Rousseaux et al., 2004 ; Diaz et Fereres, 2007 ; Balaré et al., 2012 ; Escobar-Bravo, 2017). Les effets positifs des UVA et UVB contre certains pathogènes sont également mis en évidence (Reuveni et Ravivm, 1997 ; Kwon et Hong, 1999) mais d'autres études observent des effets négatifs sous couverture UV transparente, notamment une sporulation plus importante de Botrytis cinerea (Reuveni et al., 1989). L'absence d'UVA/UVB semble, dans certains cas, diminuer temporairement l'efficience des pollinisateurs et auxiliaires de biocontrôle dans la culture (Tableau 1) mais, dans ce dernier cas, le sujet est encore peu étudié. Par ailleurs, si les insectes bénéfiques profitent de la présence d'UV dans les cultures, les ravageurs en profitent également...
Éclairage artificiel
L'éclairage LED permet d'apporter un spectre lumineux sur mesure en complément à la culture pour lutter contre certains pathogènes (Tableau 2). Les résultats d'efficacité phytosanitaire sont souvent obtenus dans des conditions contrôlées de laboratoire. Les évaluations en production sous serre méritent d'être réalisées. Une somme de lumière (DLI, Daily Light Intégral, exprimée en mol de photons/m2/jour) assez faible suffit à diminuer la pression parasitaire. L'intensité lumineuse ou la durée d'éclairage ne sont donc pas très importantes dans ces stratégies de phytoprotection.
RÉSUMÉ
CONTEXTE - Sous serre, la gestion climatique constitue un levier possible de réduction des produits phytosanitaires. Modifier l'environnement dans lequel évoluent auxiliaires et ravageurs a un impact sur leurs processus vitaux (reproduction, développement, survie, répartition). Utiliser ce levier nécessite toutefois de bien connaître le biotope de chaque organisme.
MOTS-CLÉS - Gestion climatique, régulation des bioagresseurs, température, humidité, spectre lumineux, LED.
POUR EN SAVOIR PLUS
CONTACTS : bruno.paris@inra.fr
severine.doise@inra.fr
oscar.stapel@astredhor.fr
BIBLIOGRAPHIE : - Antignus Y., M. Lapidot, D. Hadar, Y. Messika, S. Cohen, 1998, Ultraviolet-Absorbing Screens Serve as Optical Barriers to Protect Crops from Virus and Insect Pests. J. Econ. Entomol. 91:1401-1405.
- Ballaré C. L., C. A. Mazza, A. T. Austin and R. Pierik, 2012, Canopy Light and Plant Health. Plant Physiol. 160:145-155.
- Cerrudo I., M. M. Keller, M. D. Cargnel, P. V. Demkura, M. de Wit, M. S. Patitucci, R. Pierik, C. M. J. Pieterse and C. L. Ballaré, 2012, Low Red/Far-Red Ratios Reduce Arabidopsis Resistance to Botrytis cinerea and Jasmonate Responses via a COI1-JAZ10-Dependent, Salicylic Acid-Independent Mechanism, Plant Physiol. 158:2042-2052.
- De Wit M., S. H. Spoel, G. F. Sanchez-Perez, C. M. M. Gommers, C. M. J. Pieterse, L. A. C. J. Voesenek, and R. Pierik, 2013, Perception of low red:far-red ratio compromises both salicylic acid- et jasmonic acid-dependent pathogen defenses in Arabidopsis. The Plant Journal 75:90-103.
- Diaz B. and A. Fereres, 2007, Ultraviolet-Blocking Materials as a Physical Barrier to Control Insect Pests and Plant Pathogens in Protected Crops, Pest Technology, 1(2) : 85-95.
- Doukas D. and C. C. Payne, 2007a, The use of ultraviolet-blocking films in insect pest management in the UK; effects on naturally occurring arthropod pest and natural enemy populations in a protected cucumber crop. Ann Appl Biol 151:221-231.
- Doukas D. and C.C. Payne, 2007b, Effects of UV-Blocking Films on the Dispersal Behavior of Encarsia formosa (Hymenoptera: Aphelinidae). J. Econ. Entomol. 100:110-116.
- Escobar-Bravo R., P. G. L. Klinkhamer and K.A. Leiss, 2017, Interactive Effects of UVB Light with Abiotic Factors on Plant Growth and Chemistry and Their Consequences for Defense against Arthropod Herbivores. Frontiers in Plant Science, 8 Art.278.
- Fatnassi H., Pizzol J., Boulard T., Poncet C., S. Voisin, M. Zigler, 2012, Dependence of Thrips Infestation on Spatial Climate Distribution in a Rose Greenhouse Crop. Acta Hort. (ISHS) 927:261-266
- Fatnassi H., Pizzol J., Senoussi R., A. Biondi, N. Desneux, C. Poncet, Boulard T., (2015), Within-Crop Air Temperature and Humidity Outcomes on Spatio-temporal Distribution of the key Rose Pest Frankliniella occidentalis, PLoS ONE 10(5): e0126655. doi: 10.1371/journal.pone.0126655.
- Fatnassi H., Boulard T., Suay R., Paris B. and Poncet C. (2018), Computational fluid dynamics-based decision-support tool for early warning against pests and diseases in greenhouse crops. Acta Hortic. 1227, 85-92 DOI: 10.17660/ActaHortic.2018.1227.10 https://doi.org/10.17660/ActaHortic.2018.1227.10
- Izaguirre M. M., C.A. Mazza, M. Biondini, I. T. Baldwin and C. L. Ballaré, 2006, Remote sensing of future competitors: Impacts on plant defenses PNAS 103:7170-7174.
- Kumar P and H.M. Poehling, 2006, UV-blocking Plastic Films and Nets Influence Vectors and Virus. Environ. Entomol. 35:1069-1082.
- Kwon M. and J. Hong, 1999, Ultraviolet wave length effective in the sporulation of Didymella bryoniae, a gummy stem blight fungus in cucurbids and the disease control effect by the use of ultraviolet light absorbing vinyl film. Plant Disease and Agriculture 5:20-26. Rousseaux M. C. R. Julkunen-Tiitto, P. S. Searles, A. L. Scopel and P. J. Aphalo, C. L. Ballaré, 2004, Solar UV-B radiation affects leaf quality and insect herbivory in the southern beech tree Nothofagus Antarctica. Oecologia, 138: 505-512.
- McGuire R. and A. A. Agrawal, 2005, Trade-offs between the shade-avoidance response and plant resistance to herbivores? Tests with mutant Cucumis sativus. Functional Ecology 19:1025-1031.
- Moreno J. E., Y. Tao, J. Chory, and C. L. Ballare, 2009, Ecological modulation of plant defense via phytochrome control of jasmonate sensitivity. PNAS 106:4935-4940.
- Reuveni and Ravivm 1997, Control of Downy Mildew in Greenhouse-Grown Cucumbers Using Blue Photoselective Polyethylene Sheets, Plant Disease 81:999-1004.
- Reuveni R., M. Ravivm and R. Bar., 1989, Sporulation of Botrytis cinerea as affected by photoselective polyethylene sheets and filters, Ann. Appl. Biol.115:417-424.
- Stapel O, E. Maugin, S. Trihan and A. Ferre, 2011, Light Filter Use in Ornamental Plant Production to Control Plant Growth and to Improve Plant Quality, Acta Hort. 907: 205-211.
- STEPP, 2006, Influence de la bâche Solatrol et du produit ReduHeat sur la pression des ravageurs en chrysanthème, Rapport technique ST06PP09 ASTREDHOR. 7 p.
- STEPP, 2007, Influence de la bâche Solatrol sur la pression des ravageurs, Rapport technique ST07PP301. 8 p.
 Imprimer
Imprimer