1. Levée de capselle bourse-à-pasteur Capsella bursa-pastoris. 2. Diversité de tailles et de formes des semences adventices.

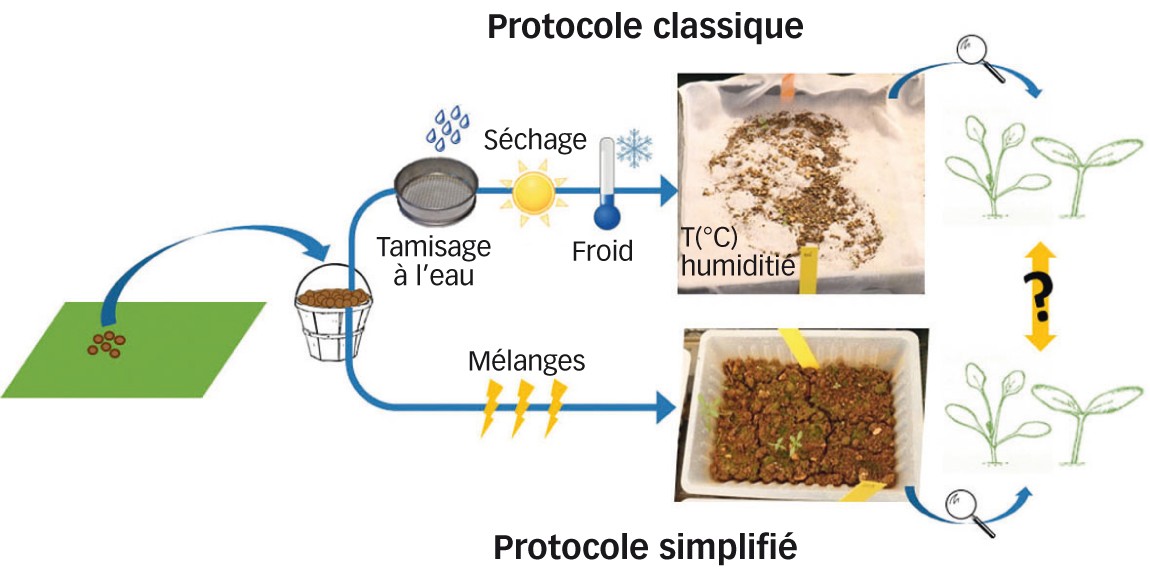
Dispositif expérimental. En haut : protocole classique. En bas : protocole simplifié. Photo : I. Mahé - Inrae
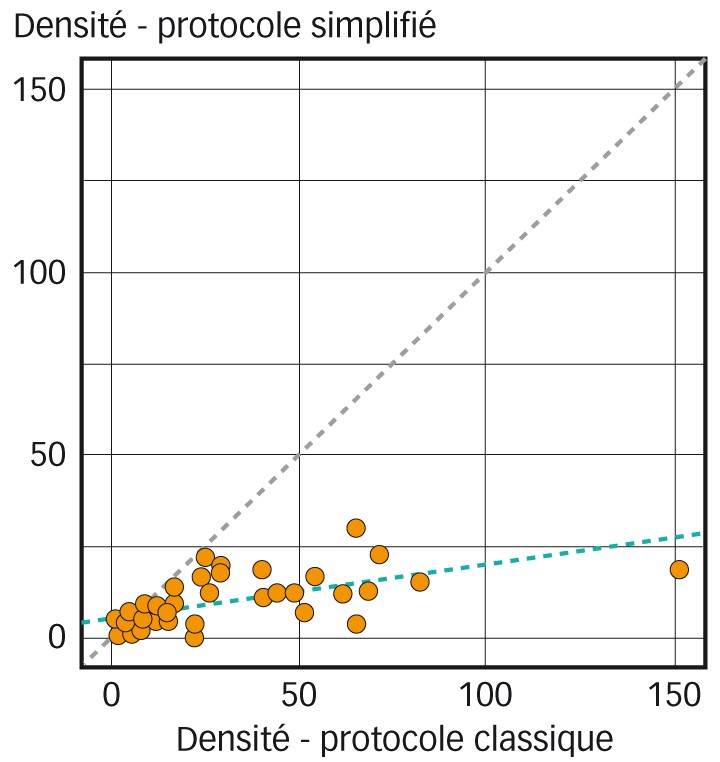
Fig. 3 : Densité des semences du stock semencier par parcelle (exprimée en nombre de semences/400 g de terre) en fonction du protocole
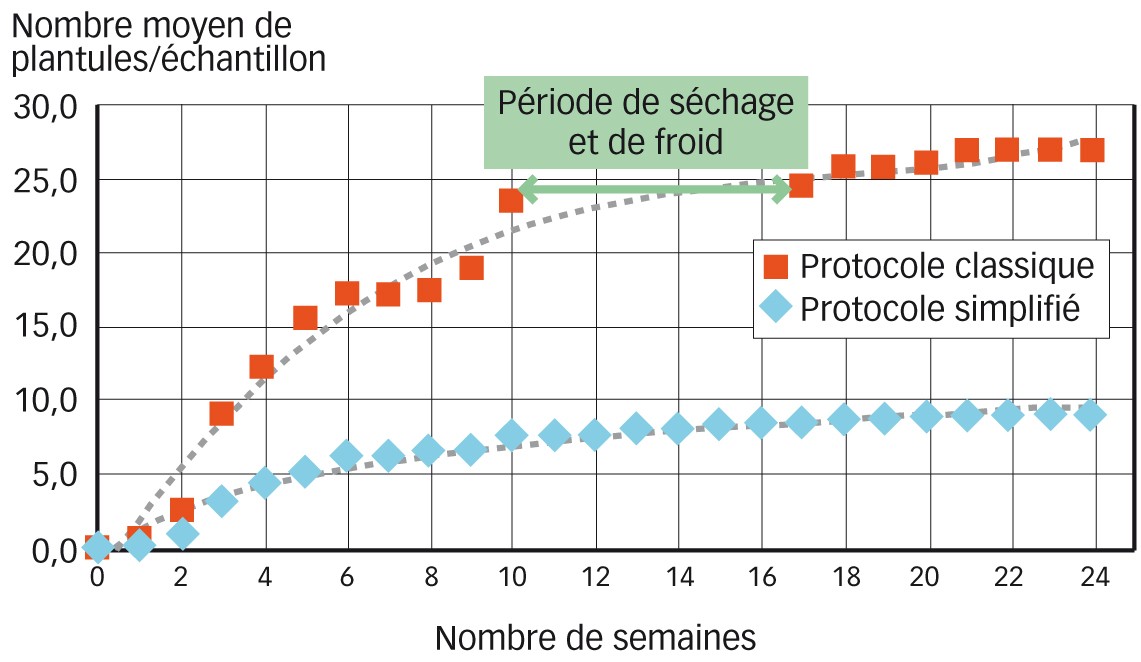
Fig. 4 : Évolution du nombre de plantules identifiées par échantillon en fonction du protocole En pointillés : courbes de tendance.

Une méthodologie classique d'estimation du stock semencier par germination d'échantillons de terre qui n'a pas beaucoup évolué au cours du temps. 4. Brenchley W.E., Warington, K., 1930. Source : Brenchley, W. E., Warington, K., The Weed Seed Population of Arable Soil: I. Numerical Estimation of Viable Seeds and Observations on Their Natural Dormancy. J Ecol., 1930, 18(2), 235-272. 5. Expérimentation décrite dans cet article. Photo 5. A. Matejicek - Inrae
Le stock semencier d'une parcelle agricole représente théoriquement la flore potentielle qui pourra émerger dans les années futures. Les semences accumulées dans la zone travaillée du sol témoignent de l'histoire de la parcelle en termes de pratiques, mais également de structures paysagères, actuelles ou passées. L'estimation du stock semencier se fait classiquement par le biais de protocoles longs et lourds à mettre en place, réservant ainsi leur application aux instituts de recherche, car difficilement adaptables à un public plus large comme les agriculteurs par exemple. Est-il possible de réaliser une estimation suffisante du stock semencier avec un protocole simplifié, directement applicable par les agriculteurs ?
L'étude du stock semencier
Quel est l'intérêt ?
Actuellement, les herbicides sont un des leviers majeurs de gestion de la flore adventice. Ils constituent, du fait de leur efficacité, une certaine sécurité pour les agriculteurs, et en particulier une solution de rattrapage en cas de forte densité de plantes adventices. Les préoccupations écologiques croissantes laissent supposer une forte réduction de l'usage des herbicides dans les années futures, plaçant de ce fait la prophylaxie au coeur des stratégies de gestion de la flore adventice. Dans ce contexte, anticiper la présence d'espèces adventices dans une parcelle paraît indispensable pour adapter au mieux les pratiques de désherbage. L'abondance et la diversité des espèces peuvent être estimées en s'intéressant au stock semencier, c'est-à-dire à l'ensemble des semences présentes dans le sol, susceptibles de former la flore levée. On considère généralement que pour une année donnée, la flore levée ne représente qu'une faible proportion du stock semencier, de 9 à 28 % suivant l'espèce et les conditions climatiques(1), les autres semences restant dans le sol en état de dormance.
Les protocoles d'estimation
On distingue deux grandes approches pour estimer le stock semencier :
- un protocole par germination d'échantillons de terre suivi d'une identification et d'un comptage des plantules levées (photo 1) ;
- un protocole par extraction des semences du sol suivi d'une identification (photo 2) et d'un comptage des semences sous loupe binoculaire. L'extraction des semences peut être effectuée via différentes techniques, mécaniques (à l'aide de tamis par exemple) ou chimiques en se servant de solutions permettant de séparer la matière organique de la matière minérale.
Les difficultés de l'étude du stock semencier
Les méthodologies à suivre pour estimer le stock semencier sont variées mais toutes sont longues et relativement lourdes à mettre en place. Ces inconvénients existent tout au long des étapes de l'estimation.
La première difficulté concerne l'effort d'échantillonnage. Les semences adventices sont réparties de manière agrégée dans la parcelle. De ce fait, pour être représentatif de l'ensemble de la parcelle et ainsi capter le maximum d'espèces, le nombre de carottes de terre prélevées doit être suffisamment important. Les travaux réalisés sur ce sujet estiment qu'une centaine de prélèvements seraient nécessaires pour détecter des espèces à faible densité (valeurs estimées dans des zones de prélèvements d'environ 300 m² à l'intérieur de parcelles agricoles)(2).
Une seconde difficulté rencontrée est liée aux équipements particuliers souvent requis pour estimer le stock semencier. Dans le cas des protocoles par extraction des semences, du matériel (tamis ou machines par exemple) ou bien des solutions chimiques sont nécessaires pour séparer la terre des semences, puis une loupe binoculaire est indispensable à leur identification. Dans le cas des protocoles par germination, de l'espace en serre est nécessaire pour avoir des conditions de température et de lumière contrôlées.
Enfin, une dernière difficulté est liée au temps de travail. Les étapes de prélèvement des échantillons puis leur préparation et l'identification des semences ou des plantules sont très chronophages, d'autant plus que le nombre d'échantillons est élevé. Dans le cas du protocole par germination, il y a aussi un délai important à prévoir entre le début de l'expérimentation et l'obtention des résultats, puisque les levées peuvent s'étaler sur plusieurs mois, voire plusieurs années(3).
L'étude du stock semencier semble donc difficilement accessible à un public non scientifique, bien que théoriquement indispensable pour caractériser les communautés floristiques de parcelles.
Un protocole simplifié pour estimer le stock semencier
Comparaison de deux protocoles d'estimation
L'étude a pour objectif de tester la possibilité pour un agriculteur de réaliser, sans matériel particulier, une évaluation du stock de semences de ses parcelles. Ce protocole a été comparé à un protocole classique, historiquement utilisé à l'Inra de Dijon (Figures 1 et 2, photo 3).
Le stock semencier d'adventices a été estimé à partir d'échantillons de terre prélevés sur trente-cinq parcelles en semis direct sous couvert situées en Bourgogne-Franche-Comté. Dans chaque parcelle, vingt carottes de terre de 10 cm de profondeur ont été prélevées de manière aléatoire en mars 2019 et regroupées par parcelle. Les prélèvements ont été réalisés dans une zone de 2 000 m² considérée par l'agriculteur comme représentative des problèmes malherbologiques de sa parcelle. Le nombre de carottes a été réduit par rapport aux préconisations pour pouvoir traiter un plus grand nombre d'échantillons. Pour chaque protocole et pour chaque parcelle, un sous-échantillon de 400 g de terre a été utilisé pour l'étude. Pour treize parcelles, deux échantillons par protocole ont pu être réalisés. Ainsi l'étude est basée sur 48 échantillons de chacun des protocoles.
Protocole classique
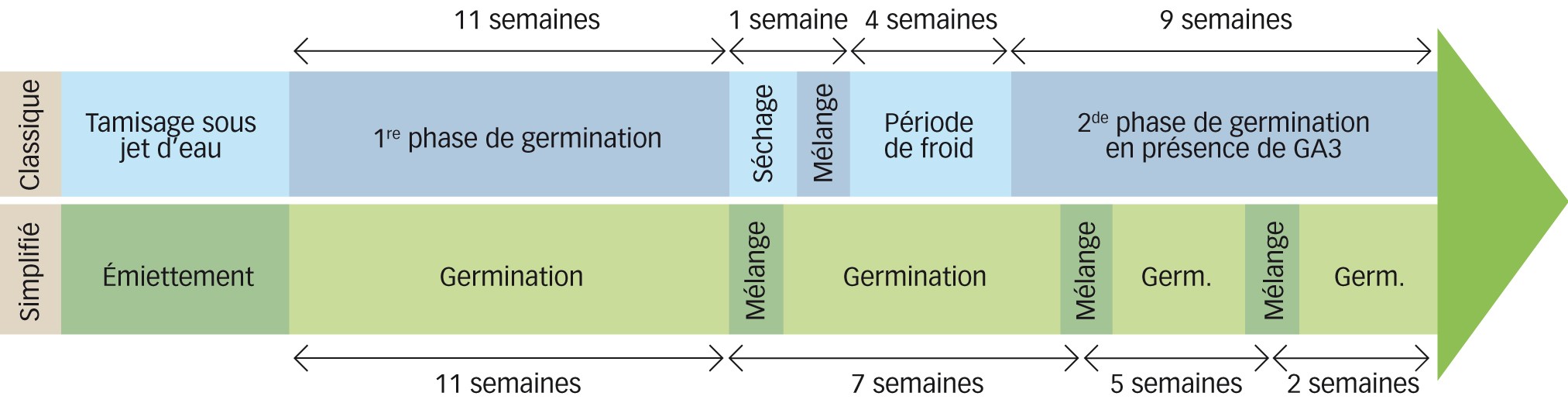
Le protocole classique consiste en une mise en germination après concentration des échantillons de terre par tamisage à l'eau. Chaque échantillon a été lavé sous jet d'eau à travers différents tamis (mailles de 5 mm et 0,2 mm) pour ne conserver que les éléments susceptibles de contenir des semences adventices. Les résidus situés entre les deux tamis ont ensuite été étalés en couche fine (moins que 0,5 mm) en serre. Les plantules ont été régulièrement identifiées, comptées et retirées. Les plantules qui n'ont pu être déterminées à un stade précoce ont été replantées en pots pour une identification ultérieure. Cette première période de germination a duré onze semaines jusqu'à l'arrêt de nouvelles émergences. Les échantillons ont ensuite été soumis à différentes stimulations afin de maximiser les levées (séchage à l'air libre pendant une semaine puis stockage en chambre froide pendant quatre semaines). Les échantillons ont enfin été placés en présence d'une solution d'acide gibbérellique (GA3) qui stimule la levée de dormance des semences, pour une seconde phase de germination de neuf semaines.
Protocole simplifié pour agriculteur
Les échantillons ont été émiettés à la main et directement placés dans des barquettes à frites (environ 2 cm d'épaisseur de terre). Ils ont été placés dans une serre non chauffée et sans lumière artificielle, là encore dans l'objectif de rendre le protocole le plus simple possible. Les échantillons ont été arrosés plusieurs fois par semaine mais au maximum une fois par jour à l'aide d'un arrosoir. À trois reprises, la terre des échantillons a été mélangée, d'une part afin de casser la croûte qui s'était formée et aussi pour favoriser de nouvelles germinations. La période de germination s'est étalée sur vingt-cinq semaines. Les plantules ont été régulièrement identifiées, comptées et retirées.
L'identification des plantules a été réalisée de manière identique dans les deux protocoles. L'identification de certaines plantules n'a été réalisée qu'au genre, lorsque les critères observés ne permettaient pas une identification plus précise. Pour plus de simplicité dans la suite de l'article, le terme « diversité spécifique » sera utilisé, même si certains taxons ne sont déterminés qu'au niveau du genre et peuvent recouvrir deux ou trois espèces.
Résultats de la comparaison entre les deux protocoles
Levées et diversité spécifique
L'expérimentation a permis de faire lever en moyenne dix-huit plantules par échantillon et au total soixante-dix espèces ont été identifiées sur l'ensemble des parcelles. Il est à noter qu'il existe une variabilité très forte, à la fois en termes de densité de plantules et de diversité spécifique entre les parcelles.
Une densité du stock semencier inférieure avec le protocole simplifié
Pour 96 % des parcelles, le protocole classique a permis de faire émerger un plus grand nombre de plantules que le protocole simplifié (les quatre pourcents restants correspondent à des parcelles avec une densité de plantules très faible avec les deux protocoles). Néanmoins il existe une corrélation entre les densités trouvées avec les deux protocoles, ainsi, en moyenne, 2,8 fois plus de plantules ont été dénombrées avec le protocole classique (Figure 3 page suivante).
Une détection des espèces différente
Au total, soixante-dix espèces (ou groupes d'espèces) ont été identifiées, mais 37 % d'entre elles n'ont été mises en évidence que par un seul protocole (tableau). Cependant, pour la majorité de ces espèces spécifiques à un protocole, seulement quelques individus ont été observés sur l'ensemble des échantillons (moins de trois plantules sur les quarante-huit échantillons étudiés). Ainsi l'observation de ces espèces par un seul des deux protocoles s'explique probablement par leur très faible abondance et non par un quelconque effet du protocole.
Néanmoins, de manière globale, le protocole classique a permis de détecter un plus grand nombre d'espèces par parcelle par rapport au protocole simplifié (en moyenne 5,4 espèces par parcelle contre 3,7).
Certaines espèces ont été très largement sous-représentées par le protocole simplifié, c'est le cas notamment pour Lythrum hyssopifolia (deux plantules contre 81 pour le protocole classique sur l'ensemble des échantillons), Juncus bufonius (quarante-neuf plantules contre 383) et Matricaria spp. (vingt-sept plantules contre 152). Le protocole simplifié paraît donc beaucoup moins efficace pour permettre la levée de certaines espèces.
Un des facteurs qui peut expliquer ces différences de résultats est la taille et/ou la masse des semences. Il apparaît que les petites semences (Juncus bufonius et Matricaria spp. notamment) sont moins représentées par le protocole simplifié. Ce résultat n'est pas surprenant sachant que l'épaisseur des échantillons du protocole simplifié était beaucoup plus importante que celle du protocole classique (2 cm contre 0,5 cm environ), certaines petites semences se trouvant au fond de la barquette n'ont certainement pas réussi à germer, malgré les différentes étapes de mélange. De plus, les échantillons du protocole simplifié avaient tendance à se compacter, ce qui a sûrement freiné la levée des semences de petite taille.
Une relation d'estimation entre les deux protocoles difficile à mettre en évidence
Pour certaines parcelles, une relation a été observée entre les densités des différentes espèces. C'est-à-dire que les espèces prédominantes dans la parcelle avec un protocole le sont aussi avec l'autre protocole. Cependant, cette relation n'est pas vérifiée pour toutes les parcelles. Le principal frein à l'établissement d'un tel lien entre les deux protocoles est lié aux faibles densités de chaque espèce observées dans chacune des parcelles. En effet, la moitié des espèces identifiées sont représentées par seulement deux individus par échantillon pour le protocole classique et un individu par échantillon pour le protocole simplifié. De plus, pour beaucoup de parcelles, peu d'espèces sont communes entre les deux protocoles. Ainsi, la faible densité de plantules par échantillon, certainement liée au volume de terre étudié insuffisant, ne permet pas de conclure plus précisément sur une relation entre les deux protocoles.
Dynamique temporelle des levées
La levée des plantules est un processus long et, même si certains individus lèvent rapidement après le début de la phase de germination, il faut attendre plusieurs semaines pour avoir un nombre de levées important. Pour les deux protocoles, les trois quarts du nombre maximal de plantules sont atteints aux environs de la 9e ou 10e semaine de germination (Figure 4). Pendant ces semaines, les échantillons nécessitent un suivi régulier, d'arrosage notamment et aussi d'identification des levées. Sur ce dernier point se pose le problème des connaissances botaniques spécifiques qui sont nécessaires pour pouvoir reconnaître les plantules à un stade précoce.
Apports des étapes de stimulation pour le protocole classique
Les semences adventices ont été soumises à plusieurs stimulations dans le cas du protocole classique (période de séchage, de froid et ajout d'une solution d'acide gibbérellique). Cependant, ces stimulations n'expliquent pas les différences de densités de plantules observées entre les deux protocoles. En effet, la densité de plantules estimée avec le protocole simplifié est significativement inférieure à celle estimée durant la première phase de germination du protocole classique.
Les étapes de stimulation n'ont permis de faire émerger que quelques plantules supplémentaires (médiane d'une plantule par échantillon et moyenne de 3,6) par rapport à la première phase de germination. L'apport de la stimulation varie fortement en fonction des parcelles, mais ne représente que 5 % du nombre total de plantules pour la moitié des échantillons. Très peu de nouvelles espèces, non identifiées avec la première phase de germination, ont été observées à la suite de ces stimulations (sept nouvelles espèces représentées chacune par moins de cinq plantules sur l'ensemble des 48 échantillons). Pour la moitié des échantillons, aucune nouvelle espèce n'a été observée lors de la seconde phase de germination.
Discussion et conclusion
Pour conclure, malgré l'intérêt du stock semencier comme indicateur des communautés adventices passées et futures de la parcelle, son étude ne semble pas être une méthode facilement accessible, même avec un protocole simplifié, tel que celui testé dans cette expérimentation.
Le nombre de levées est significativement inférieur avec le protocole simplifié et, de ce fait, le nombre d'espèces identifiées par parcelle est lui aussi plus faible. Néanmoins, les parcelles sont globalement classées dans le même ordre de densité totale d'adventices avec les deux protocoles, c'est-à-dire que les parcelles les plus infestées ou les moins infestées sont les mêmes avec le protocole simplifié ou avec le protocole classique.
Une partie des différences observées est liée au volume de terre de chaque échantillon (400 g) qui s'est révélé être certainement insuffisant, car conduisant à des densités de plantules relativement faibles. De ce fait, de nombreuses espèces n'étaient représentées que par un seul individu dans les échantillons, ce qui ne permet pas dans ce cas de mettre en avant un effet du protocole sur la détection des espèces. On peut donc conclure qu'estimer le stock semencier d'une parcelle à partir d'un échantillon de 400 g de terre n'est pas suffisant pour avoir une estimation correcte.
Concernant la détection des espèces, il semblerait que le protocole simplifié sous-estime la densité des espèces à petites semences. Bien que les échantillons de terre aient été étalés en couche relativement fine et qu'à trois reprises les échantillons aient été mélangés, certaines semences ne sont pas parvenues à lever. Dans des futures études de stock semencier inspirées de ce protocole simplifié, il paraît nécessaire d'étaler la terre encore plus finement, avec l'inconvénient néanmoins que la terre se dessèche plus vite.
De nouvelles perspectives d'estimation du stock semencier à l'aide d'outils d'analyse moléculaire pourraient être envisagées pour pallier ces difficultés méthodologiques (compétences botaniques d'identification, délais entre la collecte des échantillons et l'obtention des résultats, temps de travail, etc.). Ces difficultés existent également avec les protocoles par extraction puis identification des semences et il est d'ailleurs étonnant qu'aucun dispositif d'identification automatisé des semences adventices n'ait été développé et démocratisé malgré les progrès dans le domaine de l'analyse d'images. Du point de vue de la biologie moléculaire, les premiers essais sont en cours de réalisation avec les difficultés d'ordre technique nombreuses. Mais, là encore, se pose la problématique de l'échantillonnage et de la quantité de terre à prélever pour avoir une estimation fiable et représentative de la diversité biologique de la parcelle.
(1) Dessaint F., Chadoeuf R., Barralis G., Nine Years' Soil Seed Bank and Weed Vegetation Relationships in an Arable Field Without Weed Control, J Appl Ecol., 1997, 34(1):123.(2) Dessaint F., Barralis G., Caixinhas M.L., Mayor J.P., Recasens J., Zanin G., Precision of soil seedbank sampling: how many soil cores? Weed Res. 1996;36(2):143-151.(3) Roberts H.A., Studies on the weeds of vegetable crops: I. Initial effects of cropping on the weed seeds in the soil, J Ecol. 1958;46(3):759-768.
RÉSUMÉ
CONTEXTE - L'étude du stock semencier est utilisée par les agronomes comme un indicateur de la densité et de la diversité des communautés floristiques des parcelles. Les protocoles utilisés semblent toutefois complexes et peu transposables à d'autres publics.
ÉTUDE - Un protocole « simplifié » d'estimation du stock semencier a été comparé à un protocole classiquement utilisé.
RÉSULTATS - La densité et la diversité spécifique du stock semencier estimées avec le protocole simplifié sont inférieures à celles estimées avec le protocole classique. Néanmoins pour les deux protocoles, 400 g de terre par échantillon se sont avérés insuffisants pour caractériser de façon correcte le stock semencier.
MOTS-CLÉS - Méthodologie, flore potentielle, semis direct sous couvert, adventices.
POUR EN SAVOIR PLUS
CONTACT : bruno.chauvel@inra.fr
BIBLIOGRAPHIE : voir notes. Pour plus de renseignements, notamment sur le détail des protocoles, contactez les auteurs.
 Imprimer
Imprimer