2. À gauche, feuille de variété de haricot sensible avec symptômes de brunissement typique de l'anthracnose. À droite, variété résistante sans symptôme. La résistance est due à une variation allélique sur un seul gène.
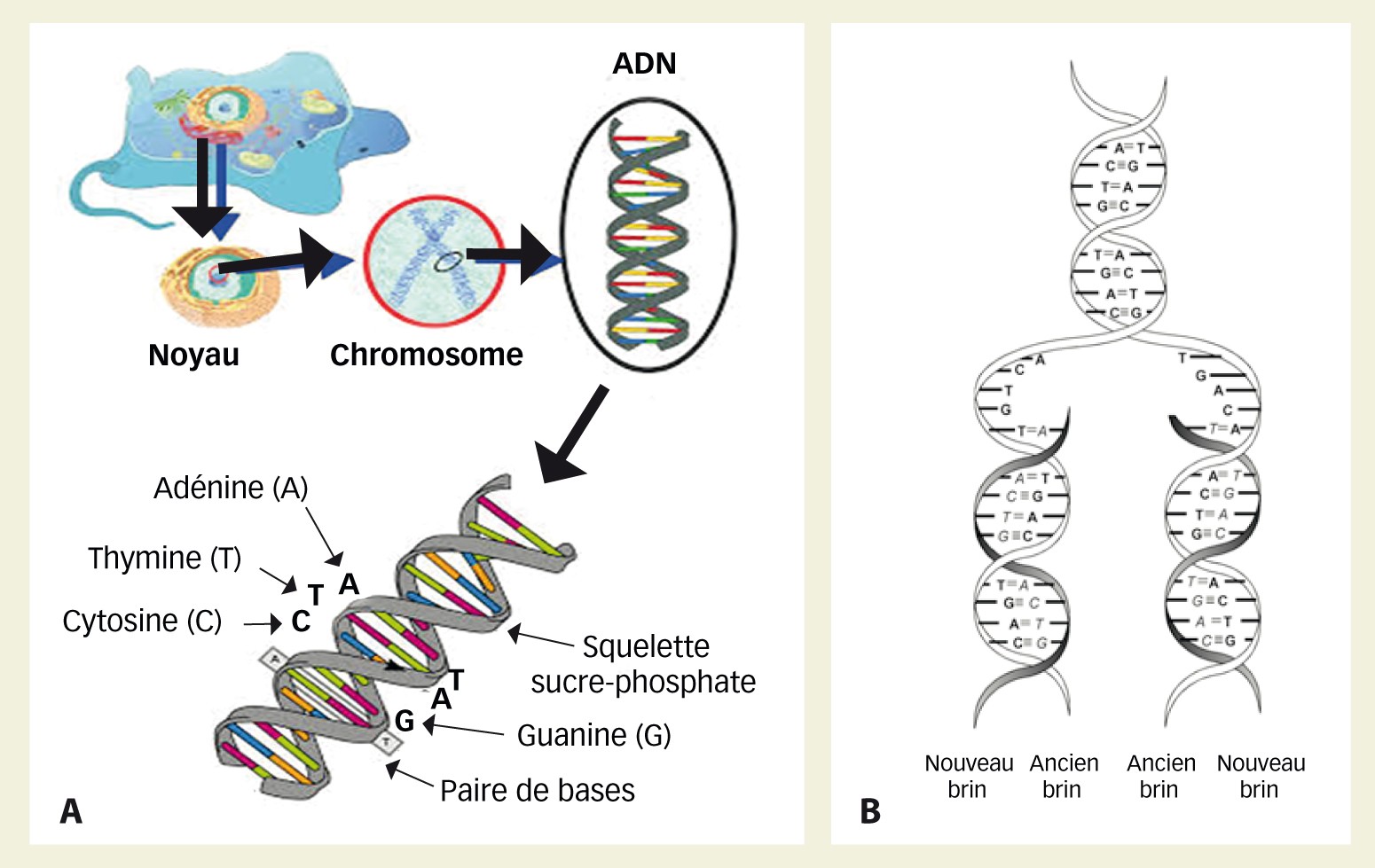
Fig. 1 : Description des termes ADN et chromosome A. Dans une cellule vivante, le patrimoine se présente sous forme de paires de bases complémentaires (A-T et G-C) concaténées, ce qui donne un chromosome. L'ensemble de l'ADN contenu dans tous les chromosomes constitue le génome. Celui-ci est inclus dans le noyau de la cellule. B. La multiplication des chromosomes se fait de manière semi-conservative.
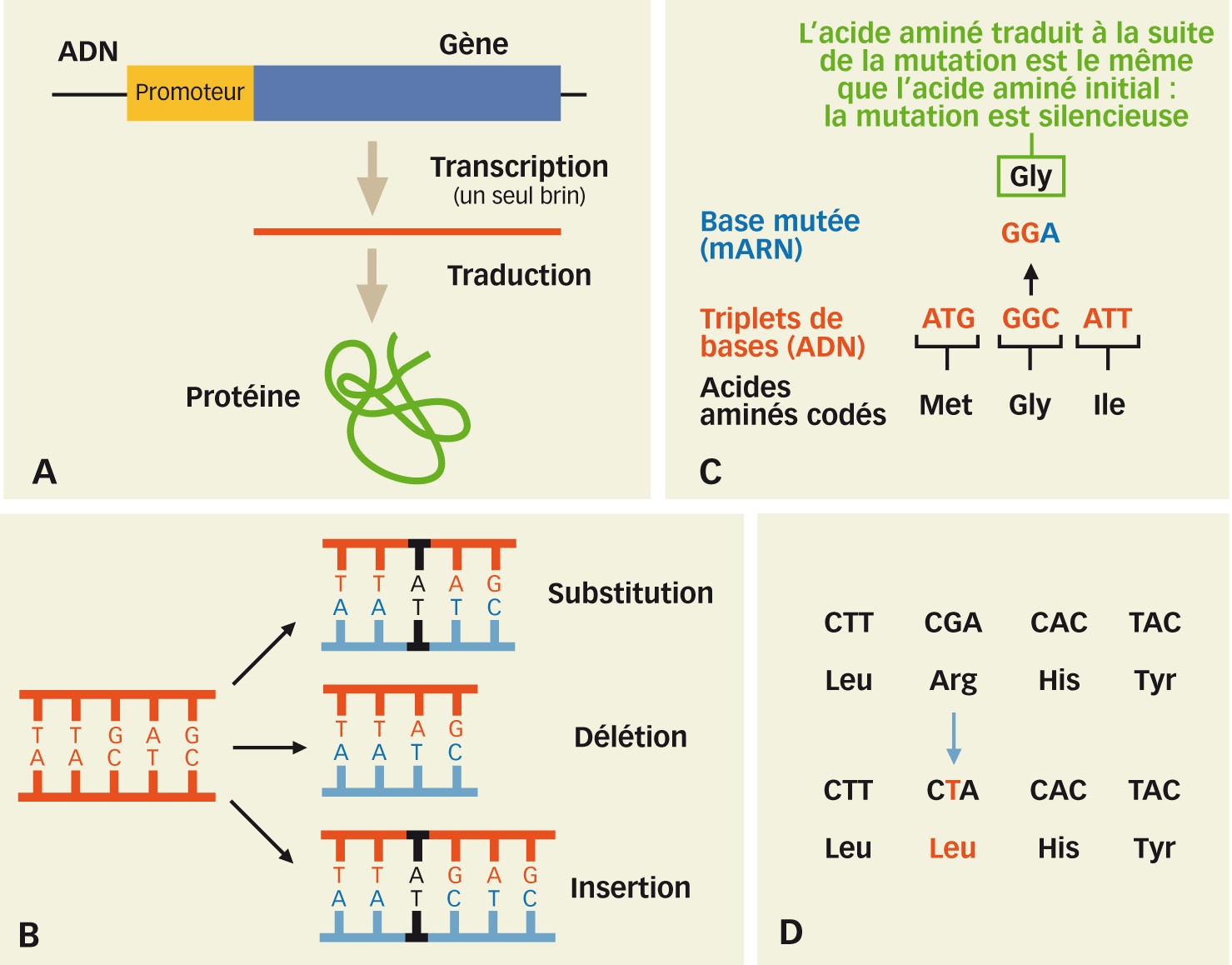
Fig. 2 : Étapes du gène à la protéine, différents types de mutations et effet des mutations silencieuse et non-sens A. Les étapes du gène à la protéine : ADN dans le noyau, puis ARNm sortant du noyau et protéine constituée d'acides aminés. B. Trois formes de mutations. Ces types de mutations sont générées dans la nature comme par édition génomique ou mutagenèse chimique/physique. C. Exemple de mutation silencieuse, la modification de base C vers A n'entraîne pas de modification d'acide aminé. D. Exemple de mutation faux-sens, la modification G vers T entraîne un changement d'acide aminé.
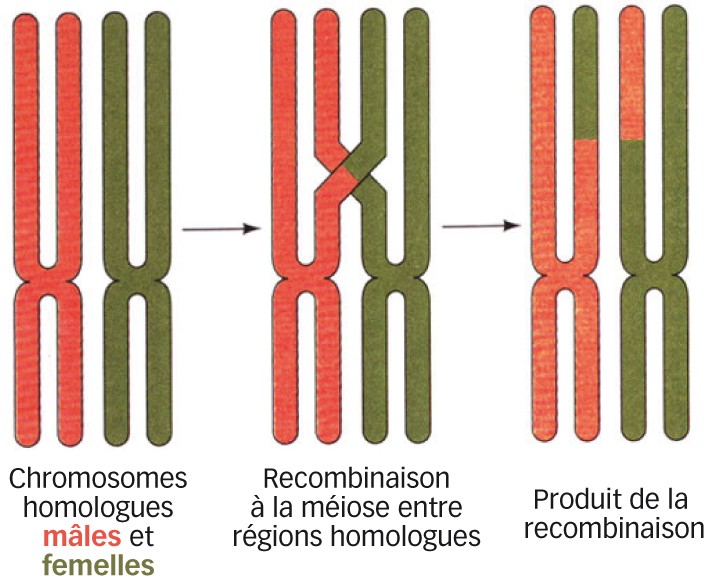
Fig. 3 : Recombinaison homologue Des régions homologues de chromosomes parentaux s'apparient et échangent leurs morceaux de chromosomes qui seront ainsi remaniés dans la descendance.
L'automne dernier, Emmanuelle Charpentier et Jennifer Doudna se voyaient octroyer le prix Nobel de chimie 2020 pour leurs travaux sur l'édition du génome, à l'aide d'une nouvelle technologie intitulée Crispr-Cas9. Ces approches technologiques ont été rapidement popularisées puisque la publication originale de Jennifer Doudna-Emmanuelle Charpentier date de 2012 et que l'expression « édition à l'aide de Crispr-Cas9 » est passée dans les médias grand public dans l'année qui a suivi. Les concepts de la génétique sont ainsi passés rapidement dans le grand public, voire dans le langage de tous les jours (« c'est notre ADN »), souvent sans que les termes lexicaux aient été bien et rigoureusement définis, de telle manière que des glissements de définition, compréhension et interprétation sont rapides.
Tout commence par les gènes
Édition de gène, ADN et génome
L'édition de gènes ou réécriture du génome consiste, à l'aide d'un outil enzymatique approprié, à générer des mutations ciblées dans le génome d'un individu. Il s'agit d'une technologie générique applicable à tous les organismes vivants dont le patrimoine génétique est constitué d'ADN.
L'ADN ou acide désoxyribonucléique est constitué d'un enchaînement de bases puriques ou pyrimidiques. Cet enchaînement, organisé en un nombre plus ou moins important de chromosomes selon les espèces vivantes, constitue le patrimoine génétique de l'individu (Figure 1).
Le génome est l'ensemble de l'information génétique, donc l'enchaînement de bases, présent dans chaque cellule d'un individu. Génome et patrimoine génétique d'un individu peuvent être considérés comme synonymes.
Du gène à la protéine
Un gène est un constituant du génome. Plus précisément, il s'agit de régions génomiques délimitées le long des chromosomes définissant une information qui doit être lue. Cette lecture, grâce à une machinerie enzymatique dédiée, génère un ARN ou acide ribonucléique constitué des mêmes bases que l'ADN à l'exception près que la thymine y est remplacée par l'uracile. Il existe différents types d'ARN, parmi lesquels les ARNm ou ARN messagers. Il s'agit de molécules lues à partir d'un gène qui ont la capacité à se déplacer dans la cellule et à être elles-mêmes lues afin d'assembler des chaînes d'acides aminés, donc des protéines (Figure 2A). La correspondance entre nucléotides et acides aminés se fait par le biais de triplets de nucléotides, appelés codons. Il existe un code de lecture des codons en acides aminés : c'est le code génétique. Ces protéines sont impliquées dans un grand nombre de fonctions physiologiques de la cellule et plus largement de l'organisme. De manière simpliste : ces fonctions sont souvent impliquées dans des caractères visibles et mesurables comme la couleur des yeux, la taille d'un individu, la résistance à un parasite...
Allèles et variabilité au sein d'une espèce
L'ADN se réplique de manière semi-conservative (Figure 1B). Lors de cette réplication, la machinerie enzymatique dédiée commet des erreurs qui peuvent être ou non réparées par une autre machinerie enzymatique dont c'est la fonction. Le taux d'erreurs restant est estimé à 10-6 par cycle de division cellulaire. Ceci signifie que des modifications ou mutations (Figure 2B) dans l'enchaînement des bases s'accumulent à chaque passage de la machinerie de réplication. Ces modifications peuvent apparaître dans des régions du génome non essentielles et n'avoir dans l'immédiat aucun effet notable. Elles peuvent générer des modifications majeures, notamment létales, auquel cas il y aura létalité de la cellule, voire de l'individu si la mutation se propage au sein des cellules somatiques et des organes, ou encore de la génération suivante si la modification est générée dans des cellules mères de cellules sexuelles. Mais souvent la modification génère un changement de lecture de codon, donc un nouvel acide aminé (Figures 2C et D) et la protéine qui en résultera sera très proche de la protéine initiale, avec peut-être des propriétés légèrement différentes. Les deux formes d'un même gène avec ce type d'altération seront appelées « allèles ». Chaque gène peut se présenter sous forme de multiples allèles lorsqu'on compare le même gène entre individus d'une même espèce. C'est ce qu'on appelle la variabilité ou variation allélique.
Génotype et phénotype et lien génotype/phénotype
Les individus ayant le même génotype sont des individus qui possèdent le même génome, donc les mêmes allèles, normalement pour l'ensemble des gènes ; mais le terme peut être formulé pour les mêmes allèles de certains gènes dans le génome. Des groupes d'individus d'une même espèce qui possèdent des combinaisons d'allèles différents entre eux seront dits appartenir à des génotypes différents.
Le phénotype est la représentation mesurable du génotype. Prenons un caractère mesurable visuellement comme la présence d'une écorce lisse (chez le hêtre). Le phénotype visuel de cette écorce est le résultat de la lecture de différents gènes. Les gènes lus présentent différents allèles. Des combinaisons d'allèles différents ne génèreront pas nécessairement des écorces de types différents, ce qui signifie qu'un même phénotype peut résulter de la lecture d'allèles différents donc de génotypes différents. En revanche, des phénotypes différents résulteront (si l'on efface l'impact de l'environnement vis-à-vis de la lecture des gènes) de la lecture de génotypes différents. On dit que le phénotype est le produit du génotype par l'effet de l'environnement : P = GxE.
La modification du génome : de la mutation à la mutagenèse
Mutation : un événement naturel
La mutation est une modification dans l'enchaînement des bases du génome par rapport à un génome parent. Les allèles sont les représentations génétiques des mutations. Les mutations se produisent en permanence dans la nature, soit lors des erreurs de réplication (substitution d'une base par une autre), soit induites par des stress environnementaux particuliers, comme des radiations ultra-violettes, des rayonnements radioactifs, la présence de molécules mutagènes... Les mutations se sont accumulées au cours de l'évolution et se sont transmises, pour certaines à travers les générations car présentant, a priori, un avantage sélectif pour les individus les portant.
Les différents types de mutations
Il existe différents types de mutations (Figure 2B) en lien avec leur impact sur le génome. Nous considèrerons ici seulement quatre types de mutations, la substitution de base, l'insertion, la délétion et la recombinaison. Il en existe d'autres, mais l'objectif n'est pas d'être exhaustif.
La substitution : une base, par exemple une guanine (G) va être répliquée non pas en adénine (A) qui est normalement sa base complémentaire, mais en cytosine (C) dont la base complémentaire est la thymine (T), donc cela entraînera une substitution G vers T. Si cette substitution se produit dans un codon et que le nouveau codon n'est plus en charge du même acide aminé, alors la mutation entraînera l'édification d'un nouvel allèle protéique dont les propriétés pourront être différentes. Au niveau phénotypique, cette mutation pourra entraîner un changement de résistance à une maladie de plante, une modification dans l'accumulation de pigment dans les pétales...
L'insertion-délétion : il existe dans les génomes des éléments génétiques mobiles, appelés transposons, qui peuvent être excisés d'un endroit (délétion), pour être réinsérés ailleurs dans le génome (insertion). Si les régions du génome où se produisent ces événements sont des régions lues, dites codantes, ces mécanismes d'insertion-délétion peuvent générer des mutations, et donc de nouveaux allèles ayant des effets phénotypiques mesurables.
La recombinaison (Figure 3) : dans le génome, il existe de manière dispersée, des enchaînements de base identiques. Ces enchaînements peuvent se situer sur le même chromosome ou sur des chromosomes différents. Au moment de divers processus du cycle cellulaire (temps de révolution entre deux divisions cellulaires successives), ces régions peuvent être amenées à être rapprochées dans l'espace et à s'accoler de manière « illégitime ». Un processus dit de « recombinaison » permet à ces éléments de s'apparier et de s'échanger de l'information génétique. Ceci peut également générer des mutations et donc de nouveaux allèles. On distingue la recombinaison homologue(1) (par exemple, lors de la méiose, entre brins homologues d'ADN de deux chromosomes apparentés des deux parents) et la recombinaison hétérologue (par exemple entre séquences similaires de chromosomes différents au sein d'un même parent).
La mutagenèse ou comment provoquer des mutations
La mutagenèse est l'action permettant de provoquer des mutations dans le génome, sans considérer particulièrement tel ou tel type de mutation (substitution, insertion...) et sans présager que ces mutations auront pour conséquence un phénotype. Le fait de provoquer une mutation, quelle qu'elle soit, est de la mutagenèse.
Mutagenèse aléatoire : il s'agit d'un procédé de génération de mutations au hasard dans le génome. L'ADN est sensible aux ultra-violets, aux radiations nucléaires de type gamma, neutrons rapides..., mais aussi à certaines molécules chimiques comme l'EMS (éthyl-méthyl-sulfonate), l'ENU (N-nitroso-éthyl-urée) ou encore la colchicine. Ces produits génèrent des modifications de l'ADN de manière aléatoire tout au long de l'enchaînement des bases. Il s'agit le plus souvent de substitutions (EMS, ENU, UV, rayons gamma), mais aussi de délétions (neutrons rapides) et de duplication de génome (colchicine).
Mutagenèse ciblée : qui dit mutagenèse aléatoire, dit genèse de mutations un peu partout dans le génome, de manière non maîtrisée. Le tri et la sélection des mutations intéressantes n'en deviennent que plus complexes. L'idée d'obtenir l'introduction d'une mutation à un endroit précis pour obtenir directement le phénotype souhaité sans avoir à trier des nombres exorbitants d'individus issus de la mutagenèse est un objectif recherché. La recombinaison homologue permet de remplacer une information génétique à un site spécifique du génome.
Grâce à la connaissance des mécanismes moléculaires des mutations « site-spécifique » dans le génome, que ce soit par le biais de la recombinaison homologue ou par des mécanismes d'insertion-remplacement de site spécifique comme cela existe chez les bactéries (Talen, Crisp-Cas9, voir plus loin), il est devenu envisageable puis réel de remplacer à une position donnée une base par une autre (substitution ciblée), d'insérer une information génétique nouvelle (insertion site-spécifique) ou de générer une délétion (délétion site-spécifique). Plusieurs outils ont été progressivement développés depuis les années 2000, le plus performant actuellement étant le système Crispr-Cas9, qui a valu le prix Nobel 2020 de chimie à E. Charpentier et J. Doudna, avec des améliorations constantes, notamment pour travailler directement sur des variétés élites(2), via la culture in vitro d'haploïdes-doublés.
Mutation et variation phénotypique
Toutes les mutations ne génèrent pas de phénotype nouveau. Toutefois, l'idée de la mutagenèse est bien de générer des mutations aléatoires ou ciblées dont certaines présenteront des phénotypes recherchés. La mutagenèse aléatoire va générer des quantités de mutations qu'il faudra trier par des cribles phénotypiques. La mutagenèse ciblée cible de manière spécifique tout ou partie de ce gène, sur la base de la connaissance des gènes impliqués dans un phénotype donné, afin d'avoir peu d'individus à cribler.
Variation allélique in natura/in vitro
Chaque mutation dans le génome génère un allèle chez l'individu et chez les descendants qui la maintiendront. C'est le fondement même de la diversité génétique et donc de la biodiversité. Ces mutations peuvent être apparues au cours des millions d'années d'évolution de la vie in natura, ou être générées de manière aléatoire ou ciblée, in vitro en laboratoire, au champ... Du point de vue chimique, qu'elles soient issues in natura ou in vitro, cela ne présente aucune différence. Il est ainsi tout à fait faisable, et cela a été réalisé de nombreuses fois, de reproduire in vitro des mutations existant in natura. Les allèles ne présentent alors pas de différence qu'ils aient été générés in natura ou reproduits intentionnellement in vitro au même endroit génomique chez une variété ou une espèce. La mutagenèse site-spécifique pour un gène donné peut, artificiellement, générer un grand nombre d'allèles non présents dans la nature car ils n'y avaient pas été sélectionnés. Ces allèles peuvent être contre-sélectionnés et préservés par le sélectionneur et les producteurs s'ils apportent des caractères phénotypiques particulièrement intéressants pour certaines activités (qualités de conservation, propriétés de floraison simultanée sur tous les rameaux sur tomate...).
Des outils de la biotechnologie cellulaire
Définition
L'Organisation de coopération et de développement économiques (OCDE) définit la biotechnologie comme « l'application de la science et de la technologie à des organismes vivants, de même qu'à ses composantes, produits et modélisations, pour modifier des matériaux vivants ou non-vivants aux fins de la production de connaissances, de biens et de services ». Dans ce cadre, les biotechnologies cellulaires concernent les biotechnologies appliquées au niveaux des cellules végétales et leur capacité de régénération. Ces technologies permettent d'utiliser des cellules uniques pour y intégrer de l'information génétique ou y appliquer la mutagenèse et évitent d'obtenir des plantes regénérées qui soient des chimères, à savoir des mélanges d'organes avec des cellules à génome modifié et non modifié.
Cultures cellulaires, totipotence, callogenèse
Totipotence : La totipotence est la propriété qu'ont les cellules végétales à se diviser et relancer un programme de développement embryo-génétique pour aboutir à la construction d'une nouvelle plante en tous points égale à la plante dont est issue la cellule initiale utilisée. L'utilisation des balances d'hormones auxine (2,4-D) et cytokinines permet de jouer sur l'état de différenciation cellulaire.
Cultures cellulaires : en prenant des morceaux d'organes/tissus de plante, en les broyant légèrement pour séparer des cellules les unes des autres, il est possible - pour un grand nombre d'espèces - de maintenir ces cellules isolées et en multiplication dans un milieu de culture liquide, possédant les équilibres hormonaux (auxines/cytokinines) appropriés (égaux et élevés pour les cultures cellulaires indifférenciées) afin de les maintenir à un état indifférencié.
Protoplastes : Les cellules maintenues en cultures cellulaires sont entourées d'une espèce couche de cellulose, de pectine et mucilage empêchant toute molécule et notamment l'ADN d'y pénétrer. Il existe des cocktails enzymatiques (cellulases, pectinases...) qui permettent de débobiner ces macromolécules et ainsi d'exposer la membrane plasmique, beaucoup plus perméable, à l'entrée de molécules extérieures. Les cellules débarrassées de leur paroi pecto-cellulosique sont appelées des protoplastes. C'est la protoplastisation ; un processus réversible.
Callogenèse : Sur des milieux solides contenant de l'agar-agar, les cellules s'agrègent, notamment grâce aux macromolécules comprises dans les parois pour former des agrégats cellulaires appelés cals, qui peuvent se maintenir, tout comme les cultures cellulaires, très longtemps, en prenant soin de les diviser régulièrement et de les transférer sur un nouveau milieu solide ou liquide. Ces structures indifférenciées sont maintenues sur des milieux très riches en auxines (2,4-D) et cytokinines.
Embryogenèse (somatique, zygotique)
Somatique : il est possible de regénérer des plantes à partir de protoplastes, de cellules isolées, de cals en modifiant la balance hormonale, notamment en éliminant les cytokinines. Cela va induire la formation d'embryons à partir de certaines cellules, en nombre plus ou moins élevés selon les espèces, les génotypes, les conditions environnementales... Puis en supprimant le 2,4-D, les embryons vont initier un développement normal et aboutir, dans la grande majorité des cas, à des plantes génotypiquement et phénotypiquement identiques à la plante initiale dont les cultures cellulaires, cals, protoplastes étaient issus.
Zygotique : le zygote correspond à l'embryon de la graine et donc l'embryogenèse zygotique fait appel au développement de ce type d'embryon issu de la reproduction sexuée.
Homozygote : l'homozygotie est l'état des allèles au niveau du génome d'une cellule. Si les deux allèles d'un gène provenant des chromosomes des deux parents sont identiques, on dira que le locus génétique correspondant est à l'état homozygote entre les deux chromosomes issus des deux parents.
Hétérozygote : dans ce cas les deux allèles sont différents, et donc le locus sera à l'état hétérozygote. Le locus génétique sera ici considéré comme l'équivalent du gène, décrit plus haut.
Ploïdie
Une cellule germinale comporte un lot de chromosome parental, son génome est dit haploïde (n chromosomes). Dans les cellules somatiques issues de la fécondation des cellules germinales, les génomes sont diploïdes (2n chromosomes, « n » issus du père et « n' » issus de la mère). Le père et la mère possédant de nombreux allèles différents, le descendant diploïde sera nécessairement hétérozygote dans une bonne part des gènes de son génome. Chez les plantes, sont rencontrées beaucoup d'anomalies chromosomiques produites in natura ou provoquées in vitro, avec des niveaux de duplication chromosomique plus ou moins importants (4n chez la pomme de terre, jusqu'à 16n chez la fraise cultivée), ou des associations interspécifiques de jeux chromosomiques (6n issus de 3 × 2n d'espèces différentes chez le blé tendre, 4n issus de 2 × 2n d'espèces différentes chez le colza...).
Haplo-diploïdisation
Les microspores mâles et macrospores femelles sont des cellules haploïdes, souvent avec des parois peu épaissies et donc facilement accessibles à l'entrée de molécules dont des molécules d'ADN, d'ARN... Comme les cellules somatiques, ces cellules germinales sont totipotentes et donc capables d'aboutir à la régénération de nouvelles plantes. L'avantage d'utiliser des cellules haploïdes est que celles-ci n'ayant qu'une copie du génome (haploïde) sont nécessairement « homozygotes » à chaque locus. Une fois la transformation génétique réalisée (voir ci-dessous), il suffit de doubler le stock chromosomique par un traitement à la colchicine (qui bloque la séparation cellulaire à la mitose) pour obtenir une plante diploïde homozygote.
Les outils de la biotechnologie moléculaire
Définition
Les biotechnologies moléculaires représentent les technologies réalisées in vitro au laboratoire, consistant à préparer de l'information génétique à introduire dans des cellules-cibles. C'est le fondement de la définition des plantes génétiquement modifiées (PGM ou OGM végétaux). Il s'agit d'introduire de nouveaux caractères, de nouvelles propriétés phénotypiques dans les plantes-cibles.
Transformation génétique ou transgenèse
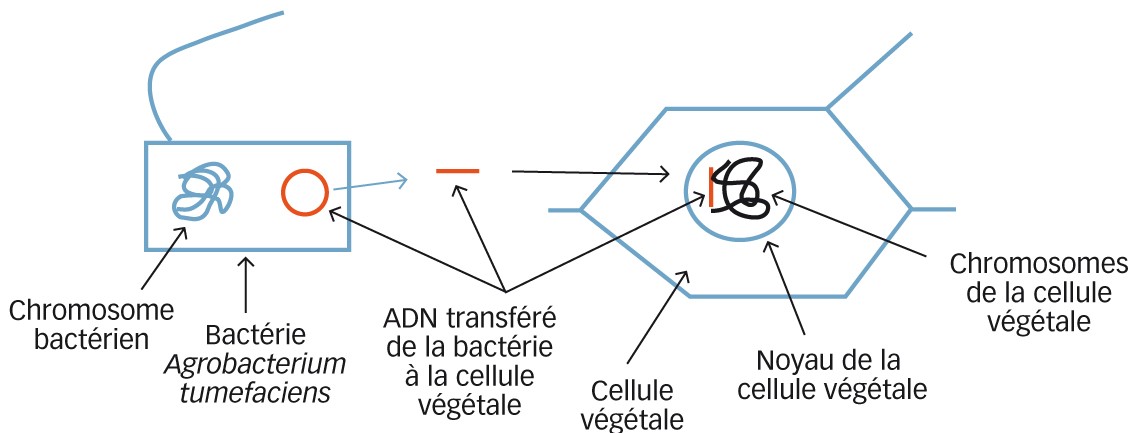
La transgenèse (Figure 4) consiste à introduire un morceau d'ADN d'origine exogène que l'on veut faire exprimer dans le génome d'une plante-cible. Ce phénomène existe naturellement dans le cas de certains organismes pathogènes dont la bactérie responsable de la galle du collet chez de nombreuses espèces végétales. Cette bactérie, Agrobacterium tumefaciens, a la capacité de transférer une partie de son ADN appelé ADN de transfert (ADNt) à une plante-hôte, afin de lui faire produire des opines, dont se nourrit la bactérie. Les chercheurs ont tiré profit de cette observation pour introduire des informations génétiques choisies (résistance aux herbicides, protéine Bt - protéine cristal de Bacillus thuringiensis pour la résistance aux insectes...) chez la plante-cible (plantes génétiquement modifiées PGM, ou OGM végétaux). L'utilisation d'Agrobacterium tumefaciens a été remplacée, dans certains cas, par d'autres techniques pour transférer l'ADN à faire exprimer dans la plante-hôte (biolistique, transfert sous vide dans les pièces florales...)(3).
Édition et réécriture du génome
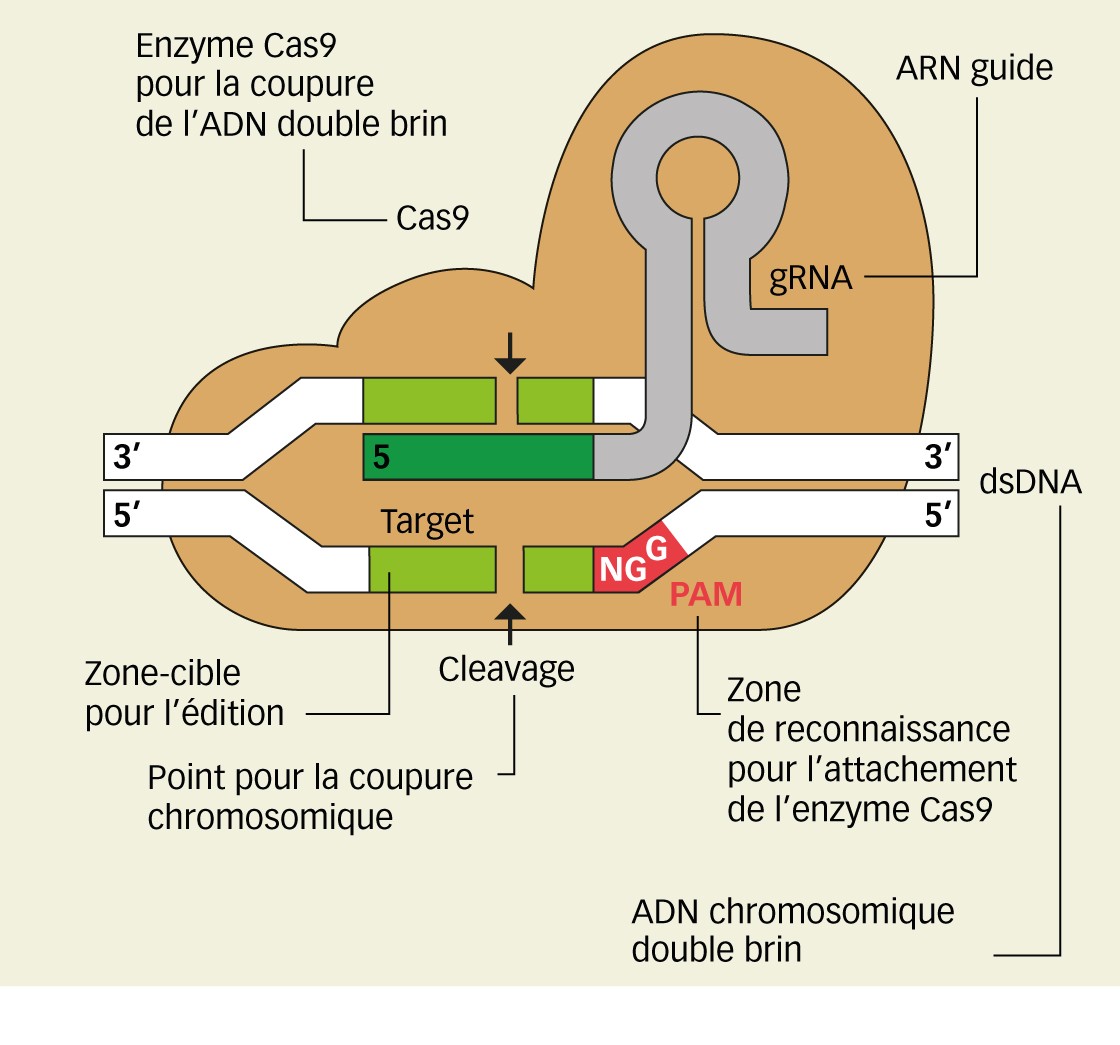
La transformation génétique, ou transgenèse décrite ci-dessus, a été beaucoup décriée, notamment parce que l'ADNt bactérien est transféré de manière aléatoire dans le génome de la plante-hôte, sans certitude qu'il puisse y être bien exprimé... Cette méthode nécessitait, au départ, l'usage de gènes de sélection - souvent des gènes de résistance à des antibiotiques, pas très adaptés à être déployés au champ(4)... Et de ce fait, d'autres approches ont été recherchées. L'approche qui remporte le plus de suffrages actuellement est l'édition génomique (Figure 6, encadré ci-dessus). Cette méthode est un mélange entre la transformation génétique et la recombinaison homologue. Là encore, l'homme s'est inspiré de la nature et en particulier des capacités « immunitaires » qu'ont certaines bactéries pour éliminer leurs virus (phages). Elles mémorisent une primo-infection par le phage, créent une copie conforme d'une région de l'ADN du phage qu'elles intègrent dans leur génome. Lorsqu'elles seront à nouveau attaquées par ce phage, elles produiront cette copie sous forme d'ARN complémentaire, associé à une épingle d'ARN palindromique (très résistante aux attaques par les nucléases). Cet ensemble, appelé ARN guide, couplé avec une nucléase, reconnaît le génome infestant en créant un duplexe similaire à ce qu'il se passe lors de la recombinaison homologue ; la nucléase découpe l'ensemble, dont le génome du phage qui sera ainsi rendu inopérant. L'homme s'est inspiré de ce mécanisme pour construire des couples ARN guide-nucléase efficaces et adaptés, permettant de remplacer une base à un endroit déterminé (substitution ciblée), de créer une insertion ou une délétion également à un endroit ciblé... La transformation génétique nécessite souvent le passage par les biotechnologies cellulaires, décrites ci-dessus, pour faire entrer le matériel génétique nécessaire à la transformation(5).
Applications et controverses
Les termes définis précédemment permettent d'aborder la question de la définition des plantes génétiquement modifiées, dans leur réalité « philosophique ». Chaque espèce, par exemple Lycopersicon esculentum (tomate), est constituée d'un très grand nombre de variétés. Chaque variété, ayant des caractères particuliers par rapport aux autres, possède donc des allèles différents, dont l'origine remonte à des mutations acquises et maintenues au cours de l'évolution puis sélectionnées pour aboutir à cette variété élite que l'on appellera « A ». Ce type de variété n'est pas OGM. Il est maintenant possible de créer exactement la même variété, à partir d'une autre variété qu'on appellera « B », en la copiant par édition génomique, à partir de la connaissance des différences entre les génomes des variétés « A » et « B ». Appelons cette nouvelle variété « A' » car elle est, en tous points, identique à la variété « A ». Cette variété « A' », parce qu'elle a été produite par édition génomique, dans la législation européenne actuelle (voir article de Catherine Regnault-Roger p. 41), sera considérée comme OGM selon l'arrêté CJUE-2018. Elle ne diffère en rien de la variété « A » mais sa production a nécessité une étape de transformation génétique pour introduire l'outil d'édition génomique (actuellement Crispr-Cas9). Ainsi, ce n'est pas la fin (le génome final et les caractères phénotypiques associés) qui est à la base de la réglementation européenne et donc française sur les OGM, mais le moyen (obtenu naturellement vs. obtenu par le biais du laboratoire), contrairement à la législation américaine (FDA : Food and Drug Administration) et ailleurs dans le monde, notamment Amérique latine, Chine...
(1) Rossignol JL., Berger R., Deutsch J., Fellous M., Lamour-Isnard Cl., Ozier-Kalogerpoulos O., Picard M., de Vienne D., 2004. Génétique, gènes et génomes, Dunod Éditeur, 232 p.
RÉSUMÉ
CONTEXTE - Les termes mutagenèse ou Crispr-Cas9 sont couramment employés au sein de débats sur les nouvelles techniques d'amélioration des plantes (aussi appelées « New Plant Breeding Techniques »). Entre la sémantique réglementaire et l'évolution des techniques d'édition génomique, il devient difficile de s'y retrouver.
LEXIQUE - Le présent article rappelle différentes définitions communément admises en génétique. Il souligne le rôle des mutations dans la biodiversité végétale et détaille les différentes technologies mises en oeuvre par l'homme pour créer de nouvelles variétés.
MOTS-CLÉS - Amélioration variétale, sélection végétale, édition génomique, mutagenèse, biotechnologies.
L'histoire de l'édition génomique
L'édition de gènes puise son histoire dans la découverte des systèmes d'immunité bactérienne contre leurs virus (phages) avec la découverte des enzymes de restriction dans les années 1970. Toutefois, ces enzymes coupent trop de fois le génome pour imaginer les exploiter. C'est avec la découverte des méganucléases, nécessitant la reconnaissance d'un grand nombre de bases consécutives, donc coupant peu de fois, que l'histoire a été relancée dans les années 1990. Mais afin de pouvoir éditer le génome de manière précise, il fallait cibler une séquence unique du génome, la couper au bon endroit et y introduire, par recombinaison homologue, la nouvelle séquence à introduire que ce soit pour substitution faux-sens, insertion, délétion (Figures 2B, C, D). Les méganucléases se sont avérées complexes à utiliser et ont vite été abandonnées au profit d'enzymes avec des motifs répétés capables de reconnaître des enchaînements de séquences d'ADN : ZNF (protéines à doigts de zinc), puis Talen (« Transcription activator-like effector nucleases » ou nucléases effectrices de type activateur de transcription). Toutefois coupler enzyme, séquence-cible et séquence à introduire s'est également avéré complexe. Les récipiendaires du prix Nobel 2020 se sont associées pour développer l'outilCrispr-Cas9 (Crispr : courtes répétitions palindromiques groupées et régulièrement espacées, Cas9 : protéine n° 9 associée au système Crispr). La force de cet outil (Figure 5) est qu'il est constitué d'une seule pièce. L'enzyme Cas9 ne coupe l'ADN que si elle y est attachée via son ARN guide (ensemble Crispr). Cela évite beaucoup d'erreurs, même s'il faut toujours vérifier par re-séquençage que l'édition s'est bien réalisée au bon endroit.
POUR EN SAVOIR PLUS
CONTACT : michel.dron@universite-paris-saclay.fr
 Imprimer
Imprimer