Espèce(s) du genre Bryum, particulièrement bien représenté dans les parcelles cultivées. Photo : N. Hénon

1 - Les mousses : un peu de botanique et de biologie Photo : N. Hénon - Figure : https://tinyurl.com/juf3dmmf
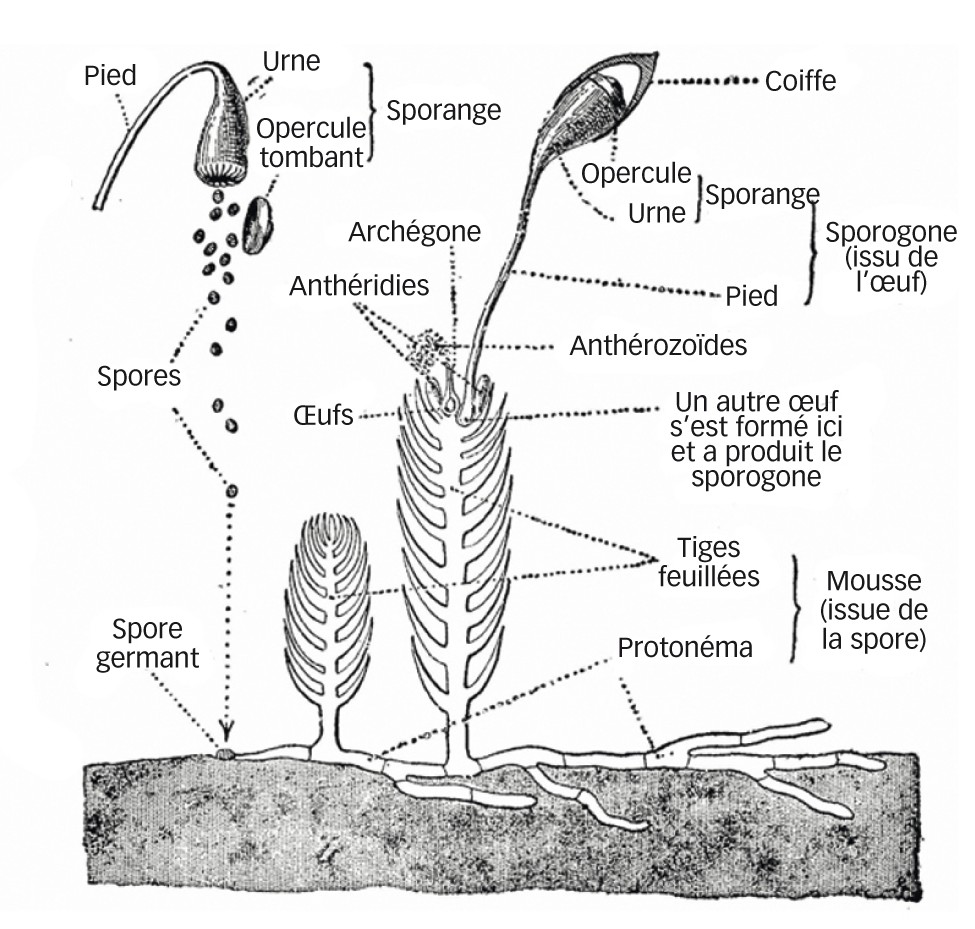
Les mousses, ou bryophytes au sens large, rassemblent trois groupes monophylétiques : les bryophytes au sens strict, les marchantiophytes (aussi appelées hépatiques), thalloïdes ou foliacées, et les anthocérot(ophyt)es. En France, les bryophytes au sens large représentent 980 espèces de bryophytes (andréacées, sphaignes et mousses), 315 marchantiophytes et six anthocérotes (Hugonnot et al., 2017, Hugonnot et Leica Chavoutier, 2021). D'ordinaire vivaces, ces végétaux comptent également des espèces annuelles, comme Tortula acaulon (photo : apex d'une tige de T. acaulon), terricole très fréquente. Ces organismes chlorophylliens sont qualifiés d'haplodiplophasiques : leur cycle de développement comprend une phase haploïde, le gamétophyte, et une phase diploïde, le sporophyte, d'importance subégale (figure ci-dessus, d'après Bonnier, 1907). Outre la reproduction sexuée, les bryophytes effectuent aussi souvent de la multiplication végétative, comme la fragmentation, qui leur permet de coloniser rapidement des espaces disponibles (Vadam, 2009).
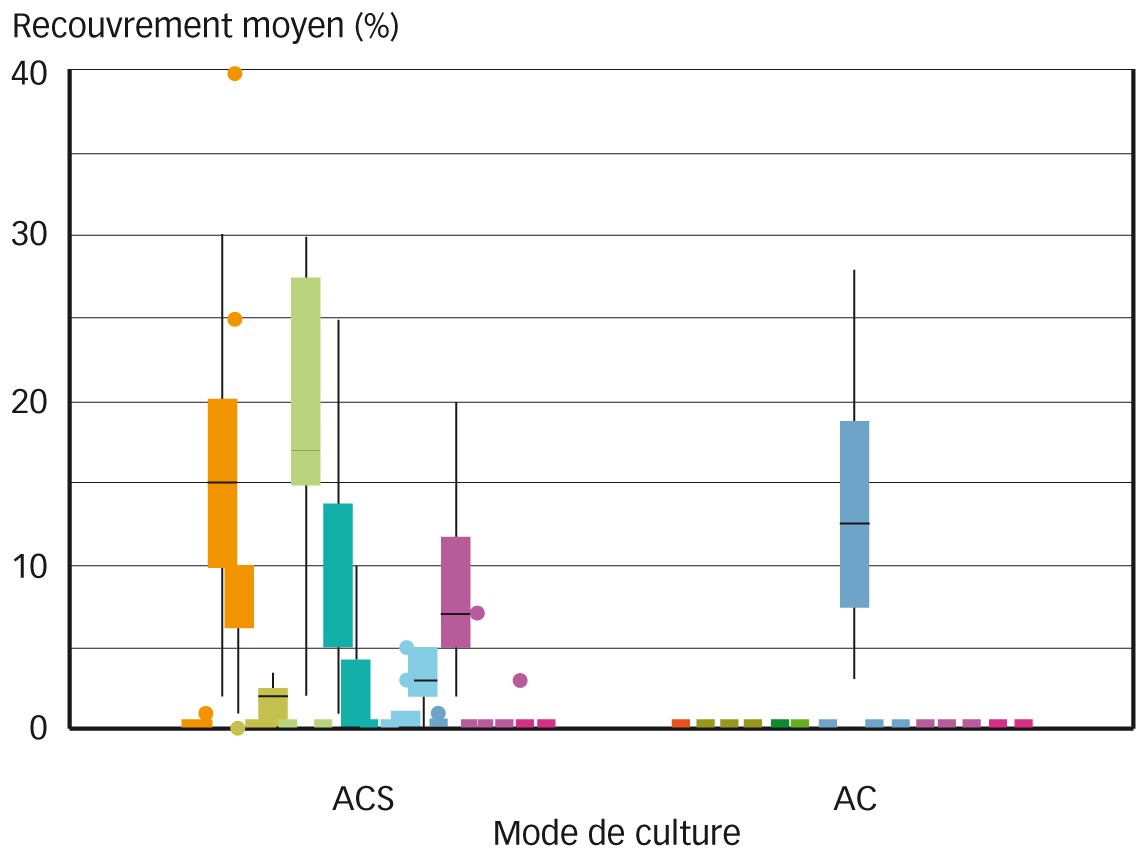
Fig. 1 : Recouvrements moyens bryophytiques, mesurés grâce à dix quadrats successivement disposés sur une diagonale dans 37 parcelles différemment conduites, dans le cadre d'une étude réalisée cette année à l'Inrae sur la diversité des bryophytes dans les cultures céréalières (publication en cours de préparation) ACS : agriculture de conservation des sols. AC : agriculture conventionnelle.
L'intérêt actuel porté sur les bryophytes à l'UMR Agroécologie (Inrae) est lié à une série de relevés de flore réalisés sur des parcelles menées en agriculture de conservation des sols (ACS), système agricole qui vise notamment à améliorer l'état édaphique des parcelles cultivées. Un axe central de ce mode de culture est la limitation au strict inéluctable du travail du sol. Or, dans les parcelles ainsi conduites, certains agriculteurs ont observé un développement parfois conséquent de mousses. Cet article a donc pour objectif de mieux connaître cette composante de l'agroécosystème, de comprendre comment elle fonctionne, d'identifier les interactions potentielles avec la culture et de décrire les modes de gestion les plus utilisés et adaptés pour la gérer dans les milieux anthropisés.
De bonnes colonisatrices
Contrairement aux végétaux dits supérieurs, les mousses, ou bryophytes au sens large, n'ont pas de véritables racines et vaisseaux conducteurs. Seuls des rhizoïdes, ayant davantage une fonction d'ancrage, sont présents. Ces plantes pionnières et de petite taille ont une capacité spectaculaire de reviviscence (on les qualifie pour cela de poïkilohydriques) et ont colonisé presque tous les biotopes. Certaines sont capables de se régénérer à partir de simples fragments, ce qui peut expliquer la propagation d'une partie de ces espèces dans des champs cultivés après le passage de certains outils (Porley, 2008). Elles sont cependant, du fait de leur histoire évolutive, très majoritairement exigeantes de conditions humides car l'eau reste indispensable à la fécondation des gamètes. Malgré cette contrainte, elles se sont tout de même répandues à travers tout le globe (Porley, 2008 ; Hugonnot et al., 2017), certaines espèces se développant uniquement en des habitats très particuliers, là où d'autres seront aptes à croître dans une large gamme d'environnements.
Les bryophytes en milieu urbain et dans les Jevi
En milieu urbain et Jevi(1), les populations de bryophytes se développant sur les murs sont à la fois accusées de dégradation de leur support, ce qui entraîne des pratiques de destruction, et font dans le même temps l'objet d'études écologiques par la diversité des espèces que l'on y trouve. Selon une étude de l'Anses (2019), plus de 20 % de la population « désherbe » systématiquement les mousses présentes dans leur espace extérieur. Pour les pelouses urbaines, le sulfate de fer reste « l'antimousse » le plus utilisé du fait de sa facilité d'emploi. Des solutions de biocontrôle, comme l'acide pélargonique et l'acide caprylique, sont vendues actuellement comme solutions de gestion des mousses(2) en Jevi. Dans le même temps, la diversité bryophytique urbaine fait l'objet de différentes études. Plus de soixante espèces de bryophytes ont, par exemple, été observées à Sheffield, en Grande-Bretagne (Smith et al., 2010) et 129 dans la ville de Genève (Hinden et Price, 2012), ce qui confère aux milieux urbains un rôle important dans la conservation de ces cryptogames.
Dans les golfs (greens, fairways) concernés par la compétition, comme d'autres terrains sportifs, les bryophytes ne sont pas les bienvenues, du fait de l'exigence liée à la nature des différents milieux nécessaires à l'exercice de la pratique sportive. Depuis plus de 70 ans, de nombreux travaux, essentiellement anglo-saxons, ont été consacrés à la gestion des bryophytes dans cet environnement. Diverses conduites (hauteur de tonte, fertilisation des couverts de graminées) et méthodes chimiques ont été utilisées pour limiter leur croissance. Parmi les espèces visées, Bryum argenteum(3), du fait de la modification de la surface du green, est une des espèces qui a concentré le plus de recherches (Raudenbush et al., 2015). Une approche multifactorielle combinant méthodes de tonte et fertilisation adaptée en complément de traitements chimiques permet de limiter le développement de cette bryophyte jugée très problématique dans ce contexte précis.
Les mousses dans les agrosystèmes
Un développement préférentiel en automne
En horticulture, le contrôle du développement des mousses (bryophytes et hépatiques) dans les pots et conteneurs de culture fait l'objet d'une attention particulière (interception de l'eau ; aspect visuel) allant jusqu'à l'autorisation d'une substance active ciblée - la quinoclamine (Kleinhans et Grolleau, 2010 - Phytoma n° 631) qui a été retirée en 2019 (voir Encadré 2 p. 45).
Dans les parcelles cultivées, un cortège spécifique déterminé est particulièrement bien représenté, notamment des pottiacées, des bryacées, des mielichhoferiacées et des ricciacées (Andriuaityte et Jukoniene, 2013). Par ailleurs, plusieurs communautés, pouvant être assimilées à des alliances bryosociologiques, ont été identifiées comme spécifiques des zones cultivées, comme le Phascion cuspidati qui caractérise les sols acides, ou le Brachythecienion velutini sur sols argilolimoneux (Preston et al., 2010 ; Bardat et Hauguel, 2002). Le petit groupe des anthocérotophytes, très rares dans les autres habitats, affectionne particulièrement les parcelles cultivées (Burgisser et Cailliau, 2012).
La majorité de ces espèces retrouvées dans les cultures ont des cycles de reproduction courts et se multiplient diligemment, ce qui témoigne d'une adaptation certaine aux perturbations mécaniques régulières que subit la parcelle. Les deux modes de reproduction, sexuée (par développement du sporophyte) ou asexuée (via différents types de propagules), sont assez équitablement figurés dans les compositions spécifiques de ces agrosystèmes (Porley, 2008). Le cycle de reproduction de ces bryophytes s'effectue essentiellement en automne : c'est en effet durant les mois de septembre, octobre et novembre que les nombres de plantes à l'état sporophytique les plus significativement hauts ont été observés. À l'inverse, en été, saison à hydrométrie et pluviométrie plus faibles, ces plantes ont tendance à s'éclipser totalement, ce qui place bien ce cycle biologique aux antipodes de celui des angiospermes adventices des cultures (Jukoniene et al., 2012).
Une strate en extension mais peu documentée
Dans les champs cultivés, d'une manière générale, les bryophytes se retrouvent en plus grande quantité, à la fois en abondance et en diversité, vers les bordures, dans la tournière et l'interface des parcelles (Porley, 2008). Ceci s'explique simplement par le fait que la pression des pratiques de travail du sol est moins forte dans ces zones, et que la compétition pour la lumière avec la culture est plus faible. Ce phénomène est encore plus proéminent pour les hépatiques qui se circonscrivent ordinairement sur l'interface des parcelles (Bisang et al., 2009). À plus grande échelle, les bryophytes sont les plus nombreuses durant l'automne, dans les parcelles jouxtant des surfaces boisées, ou à l'état de chaume ou de jachère clairsemée (Burgisser et Cailliau, 2012).
Cependant, avec le développement du non-travail du sol, certains agriculteurs convertis à l'ACS ont observé une extension de la bryoflore (photo 3), qui, auparavant, paraissait anodine dans les parcelles cultivées. L'arrêt des pratiques de perturbations des horizons superficiels semblerait en effet avoir parfois favorisé le développement des mousses. Historiquement, ces organismes ont aussitôt été l'objet d'une défiance de la part des agriculteurs, ne serait-ce que parce que cohabitant avec les espèces végétales semées. Certains herbicides chimiques de synthèse se sont révélés efficaces pour limiter la croissance de la bryoflore. Des antimousses minéraux ont également été employés au début du XXe siècle dans ce même but (tableau).
Aucune résistance aux herbicides n'est actuellement connue chez les bryophytes. Le problème est que la strate muscinée, dans l'agroécosystème, ne bénéficie que d'assez peu de documentations. Les réponses des communautés de bryophytes sous l'effet des différentes pratiques culturales, la composition de cette strate en termes de biodiversités taxonomique et fonctionnelle, son fonctionnement en conditions anthropisées et même sa prise en considération (en tant que flore adventice ou non par exemple) sont encore très floues à l'heure actuelle.
Dans les milieux prairiaux
Dans les milieux prairiaux, la présence de bryophytes indique souvent une plus faible densité du couvert de graminées et la présence d'espaces libres dans lesquels différentes espèces muscinales peuvent se développer. En complément des pratiques mécaniques de démoussage (herse étrille), un apport de fertilisation (azote, chaulage) accompagné de ressemis pour regarnir la prairie et d'une limitation du surpâturage peut permettre de limiter le développement de la bryoflore (Pierre et al., 2013).
En grandes cultures
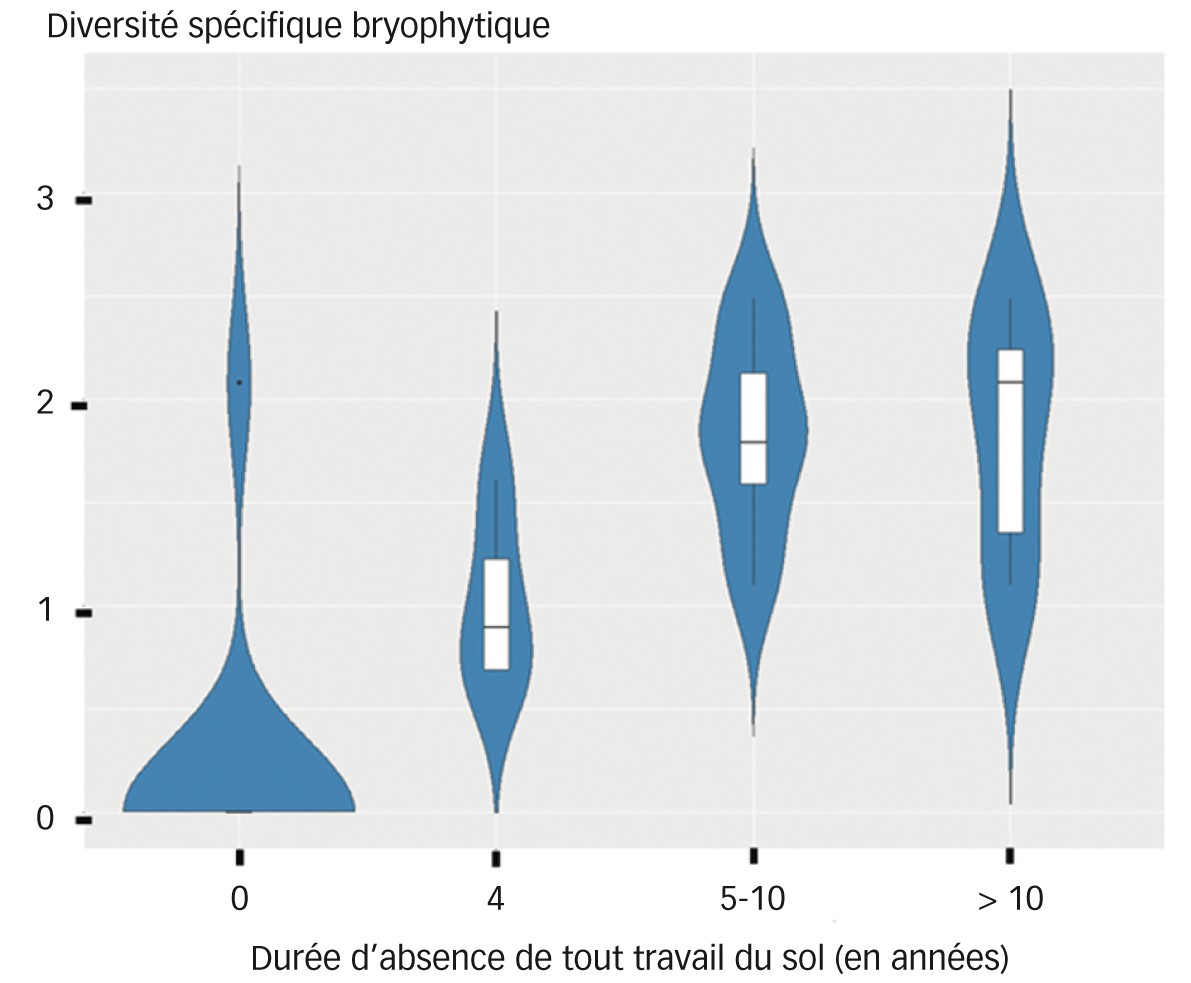
Dans le cadre d'un travail actuel réalisé sur la comparaison entre parcelles cultivées menées en ACS ou avec un travail du sol conventionnel, la diversité de différentes communautés biologiques dont la bryoflore a été étudiée. Dans les 51 parcelles de grandes cultures échantillonnées, les relevés réalisés en mars et avril 2021 dénotent l'absence de bryophytes dans près de l'intégralité de celles conduites en agriculture conventionnelle alors qu'elles sont présentes dans une grande partie de celles menées en ACS (26 parcelles sur 36, Figure 1) malgré une intensité de désherbage chimique souvent décrite comme plus importante.
Cette présence muscinale constatée dans les parcelles en ACS n'est pas systématique. Par conséquent, le simple exercice du travail du sol n'est pas le seul facteur rentrant en jeu dans la colonisation des parcelles par les bryophytes. Cependant, à l'heure actuelle, aucune corrélation avec un autre facteur écologique (pédologie, flore vasculaire, etc.) n'a pu être établie avec les données de cette première étude. En revanche, il semble bien y avoir un lien entre la diversité spécifique bryophytique et la durée d'absence de travail du sol sur la parcelle (Figure 2). En effet, plus celle-ci est allongée, plus la diversité est importante, ceci pouvant s'expliquer par l'installation progressive d'espèces à cycle de développement plus long.
De façon générale, les bryophytes ne peuvent pas achever complètement leur cycle de développement lorsque des travaux de déchaumage précoce sont effectués sur la parcelle, les spores n'ayant pas le temps de germer (Bisang, 1996). Or, ces espèces n'ont pas la possibilité de se propager, via leurs diaspores, dans d'autres zones ou habitats plus appropriés (Jukoniene et al., 2012). Par ailleurs, en plus de la perturbation des horizons de surface, l'humidité du sol semble exercer une forte sélection sur les espèces capables de vivre dans un milieu donné (Parisod et Streiff, 2002). De même, l'obligation environnementale qu'ont les agriculteurs, dans les zones vulnérables, de couvrir les sols pendant la période d'interculture avec des plantes dites de couverture peut limiter le développement des populations de bryophytes. Des travaux réalisés en Suisse (Bisang, 1996) ont montré que le groupe des anthocérotes est apparemment très sensible à la concurrence et aux interventions culturales ; ces végétaux ne se développent en effet que dans des parcelles semées d'espèces à compétitivité modérée et ne supportent qu'un retournement occasionnel du sol.
Jukoniene et al. (2012) ont également démontré que les pratiques culturales peuvent affecter aussi la diversité spécifique des bryophytes qui augmente avec le temps écoulé depuis le dernier labour. On observe alors une diminution de la densité des espèces adaptées aux perturbations annuelles régulières du sol et une augmentation de celle des vivaces. En fonction de la durée de leur cycle de vie (annuel ou pluriannuel), les bryophytes ne sont pas présentes dans les mêmes milieux : les espèces annuelles sont plus abondantes dans les parcelles à l'état de chaume tandis que les taxons pérennes se retrouvent davantage dans les jachères. Dans ces deux habitats confondus, une proportion assez importante d'espèces intermédiaires, c'est-à-dire à cycle de vie pluriannuel mais court, peut également être observée. Ainsi, le travail du sol freine le développement des espèces bryophytiques, comme il le fait pour les végétaux vasculaires.
Relation avec les autres organismes de l'agrosystème
Des bénéfices écologiques, une concurrence à étudier
Malgré la petite taille, la faible surface foliaire et l'absence de vraies racines chez ces organismes, la présence de bryophytes ne peut pas être complètement neutre. Ces végétaux sont en effet d'excellents conservateurs du sol contre l'érosion, notamment en hiver. Ils jouent aussi un rôle crucial dans le recyclage des nutriments, la fixation d'azote et la disponibilité en eau pour les cultures en stockant l'eau lors des précipitations et en la restituant ultérieurement. À l'inverse, leur présence peut également être perçue comme concurrençant les autres composantes de l'agrosystème. Toutefois, la recherche bibliographique n'a pas permis de trouver de cas d'étude réalisée dans les milieux cultivés de type grandes cultures, à l'exception de travaux dans les prairies.
Compétition avec les végétaux vasculaires
D'un point de vue théorique, la compétition des bryophytes pourrait s'exercer par une préemption de l'espace disponible ou par une meilleure captation de la lumière ou des éléments minéraux. Il n'y a cependant que peu ou pas de données allant dans le sens d'une compétition pour les ressources trophiques. La limitation de la croissance des plantes voisines pourrait s'expliquer davantage par un effet allélopathique (Fitter, 2003).
Plusieurs autres études explorent différentes hypothèses quant à la compétition des bryophytes avec la flore vasculaire. Zamfir (2000) a observé une réduction de la germination d'espèces prairiales qui serait liée soit à l'épaisseur du tapis de bryophytes, soit à la modification du milieu due à la présence de celui-ci (humidité au niveau du sol), soit à la possible émission de substances allélopathiques. Huber et Kollmann (2020) conjecturent une interaction entre l'épaisseur de la couche de mousse et la taille des semences des plantes vasculaires : les semences de gros calibre posées à la surface du tapis muscinal présentent un taux de germination plus faible que celles à dimensions plus modérées. Michel et al., (2011) démontrent une réduction de germination d'espèces arbustives en milieu contrôlé du fait de phénomènes allélopathiques qui sont moins visibles au champ. Ces derniers ont en effet été confirmés en milieu contrôlé par Tsubota et al. (2006), mais jamais véritablement prouvés en milieu naturel.
Interactions avec les communautés animales
Des animaux comme les limaces peuvent être des vecteurs importants de propagation des bryophytes. Elles permettent leur dispersion mais réduisent également la compétition pour la lumière en consommant les plantes vasculaires (Boch et al., 2015). Ce phénomène peut aussi être mis en évidence avec le surpâturage qui limite la compétition des graminées et crée des espaces colonisables par les bryophytes annuelles.
Certains animaux peuvent en outre utiliser des fragments de bryophytes pour construire et aménager leur nid ou leur terrier, ce qui permet là aussi leur dissémination. Par ailleurs, ces végétaux, parfois au menu de certains insectes, comme les staphylins, coléoptères prédateurs généralistes, peuvent servir d'hôtes à la microfaune, et notamment aux micro-arthropodes, qui participent eux aussi à la reproduction des bryophytes en favorisant le rapprochement des gamètes. La réserve hydrique temporaire créée par les mousses est également propice au développement de petits organismes comme les thécamoebiens, les collemboles et les oribates, potentiels auxiliaires des cultures et acteurs intensifs de la vie du sol.
Symbiose et parasitisme
Des endomycorhizes à arbuscules ont pu être observées avec des rhizoïdes de bryophytes (Cottet et al., 2018), structures qui n'ont pourtant pas vocation première nutritive, ce qui pourrait mettre en évidence des associations et des échanges fongisymbiotiques. Cette liaison s'observe entre des ascomycètes (Mniaecia) et certaines hépatiques (céphaloziacées, calypogéiacées et jungermanniacées ; Vadam, 2009).
Des relations de parasitisme, notamment une présence de champignons sur les protonémas et les gamétophytes des bryophytes, ont aussi été observées. Les parasites peuvent être spécifiques de l'hôte (par exemple Octospora hetieri ne se fixe que sur Funaria hygrometrica) même si, dans la grande majorité des cas, les champignons sont polyvalents.
Conclusions
Des services écologiques
Au regard de cette étude bibliographique et des premiers résultats obtenus sur les essais, les bryophytes apparaissent donc, dans les parcelles agricoles, comme un élément important de la biodiversité par la place qu'elles pourraient occuper dans ces agrosystèmes. En effet, malgré certains « dysservices »(4) supposés, comme des effets allélopathiques potentiels, la balance appréciative semble pencher en faveur des effets positifs dans les environnements déjà étudiés (prairie, jachère, etc.). À l'image des espèces adventices vasculaires, les bryophytes sont capables de rendre des services écosystémiques, comme la protection du sol contre l'érosion, et peuvent servir d'indicateurs de pollution, notamment aux métaux lourds. Une reconsidération de ces organismes, plus comme des auxiliaires de cultures que comme une composante nuisible, doit donc être à envisager. Il semble ainsi important de mettre en avant la protection des espèces menacées en prime de la simple préservation de la diversité des populations de bryophytes. Pour cela, privilégier certaines pratiques agricoles comme le déchaumage tardif, le chaume constituant l'habitat préférentiel des bryophytes des terres arables, peut être un levier de sauvegarde.
Étudier la nuisibilité potentielle sur les cultures
Toutefois, il apparaît que le corpus de littérature n'est pas encore suffisamment conséquent d'un point de vue agronomique pour cerner de façon nette l'impact des bryophytes sur les grandes cultures. Il semble donc intéressant d'approfondir les recherches sur les bryophytes dans les milieux cultivés en déterminant tout d'abord une méthode d'échantillonnage fiable et appropriée. Si l'agriculture de conservation pourrait être favorable au développement de ces organismes, il n'existe en effet quasiment pas de publications scientifiques permettant de valider cette hypothèse. Par ailleurs, qu'adviendrait-il de la nuisibilité de ces organismes si leur densité et leur recouvrement devenaient trop importants au moment de la levée de la culture ?
(1) Jardins, espaces végétalisés et infrastructures.(2) Voir Phytoma n° 713 et n° 715.
RÉSUMÉ
CONTEXTE - Les bryophytes sont largement présentes dans les milieux occupés par l'homme. Comme pour beaucoup de communautés se développant dans de tels environnements (espèces adventices, insectes, etc.), leur présence peut être perçue positivement ou négativement en fonction de la gêne, fondée ou infondée, qu'elle provoque.
ÉTUDE - Cet article a pour objectif de mieux connaître cette composante de l'agroécosystème et de comprendre comment elle fonctionne et quelles sont ses interactions potentielles avec la culture, ainsi que les modes de gestion les plus utilisés et adaptés dans les milieux anthropisés.
RÉSULTATS - Les données recueillies montrent un développement de populations de bryophytes beaucoup plus important dans des parcelles menées en agriculture de conservation par rapport à des parcelles régulièrement travaillées.
MOTS-CLÉS - Bryophytes, non-travail du sol, milieux anthropisés, cultures, Jevi, biodiversité.
2 - Les mousses en productions horticoles
Dans la filière des productions horticoles cultivées hors-sol, certaines bryophytes sont problématiques et font l'objet d'une gestion ciblée. Leur développement, parfois intempestif, lié à l'humidité quasi permanente des bâches de culture, tablettes et passe-pieds, expose les personnels à des glissades (à l'extérieur comme sous abri), mais aussi colonise la surface des substrats de culture à base de tourbe, en particulier Marchantia polymorpha, considérée comme une espèce nuisible. Les plantes les plus envahies (en alvéoles, godets, pots, conteneurs) sont celles produites sous tunnels plastique simple paroi, parfois aussi en serres verre. Des essais de mise au point de méthodes de lutte ont été réalisés par des stations du réseau Astredhor (institut technique national de l'horticulture).
POUR EN SAVOIR PLUS
CONTACT : bruno.chauvel@inrae.fr
LIENS UTILES :
http://bryophytes-de-france.org/
http://bryologia.gallica.free.fr/les-bryophytes-de-france.php
BIBLIOGRAPHIE : - Andriuaityte D. et Jukoniene I., 2013. Patterns of bryophyte diversity in arable fields of Lithuania. Acta Societatis Botanicorum Poloniae, n° 82(1), p. 57-65.
- Anses, 2019. Étude Pesti'home. Enquête nationale sur les utilisations domestiques de pesticides. Recommandations de l'Anses. Rapport d'étude. [consulté le 4 septembre 2020]. https://www.anses.fr/fr/system/files/2019Pestihome.pdf.
- Bardat J. et Hauguel J. C., 2002. Synopsis bryosociologique pour la France. Cryptogamie. Bryologie, n° 23 (4), p. 279-343.
- Bisang I. (1996). Quantitative analysis of the diaspore banks of bryophytes and ferns in cultivated fields in Switzerland. Lindbergia, 21, 1:9-20.
- Bisang I., Bergamini A. et Lienhard L. (2009). Environmental-friendly farming in Switzerland is not hornwort-friendly. Biological Conservation 142:2104-2113.
- Boch S., Fischer M., Knop E. et Allan E. (2015). Endozoochory by slugs can increase bryophyte establishment and species richness. Oikos 124:331-336.
- Burgisser L. et Cailliau A. (2012). Les mousses : Liste rouge, inventaire et initiation aux bryophytes du canton de Genève. Rapport, publication. Hors-Série n° 14, Conservatoire et Jardin botaniques de la Ville de Genève. 172 p.
- Cottet A. C., Scervino J. M. et Messuti M.I. (2018). An improved staining protocol for the assessment of arbuscular mycorrhizal in bryophytes. Boletín de la Sociedad Argentina de Botánica 53(2):201-206.
- Fitter A (2003). Making allelopathy respectable. Science 301 (5638):1337-1338.
- Hinden H. et Price M. (2012). Les bryophytes de la ville de Genève. Rapport Projet Aalborg. Conservatoire et Jardin botaniques de la Ville de Genève. 18 p.
- Huber J. K. , Kollmann J. (2020). Recruitment filtering by a moss layer disadvantages large-seeded grassland species. Basic and Applied Ecology, 42, 27-34.
- Hugonnot V. et Leica Chavoutier J. (2021). Les bryophytes de France. Volume 1 : Anthocérotes et Hépatiques. Biotope, Mèze (34), Muséum national d'histoire naturelle, Paris, 652 p.
- Hugonnot V., Celle J. et Pépin F., 2017. Mousses et hépatiques de France. Manuel d'identification des espèces communes. 2e édition, Biotope, Mèze (34), 320 p.
- Jukoniene I., Andriuaityte D. et Raomavieius V., 2012. Bryophyte diversity and phenological aspects in different habitats of arable land. Journal of Food, Agriculture and Environment, n° 10(1), p. 718-725.
- Kleinhans J.-L. et Grolleau S (2010). La quinoclamine anti-mousse et anti-hépatiques. Phytoma n° 631, 48.
- Michel P., Burritt D. J. et Lee W. G. (2011). Bryophytes display allelopathic interactions with tree species in native forest ecosystems. Oikos 120:1272-1280.
- Pierre P., Deleau D., Osson B., 2013. Quel entretien pour les prairies permanentes ? De l'amélioration par les pratiques à la rénovation totale. Fourrages, n° 213, p. 45-54.
- Porley R. D., 2008. Arable bryophytes. A field guide to the mosses, liverworts and hornworts of cultivated land in Britain and Ireland. WILDGuides, Old Basing, Hampshire, UK. 140 p.
- Parisod C. et Streiff A. (2002). Contribution à l'étude de l'écologie de Bryophytes dans les champs cultivés du Chablais vaudois. Bulletin de la société vaudoise des sciences naturelles 88.1:1-17
- Preston C. D., Hill M. O., Porley R. D. et Bosanquet SDS (2010). Survey of the bryophytes of arable land in Britain and Ireland 1: a classification of arable field assemblages. Journal of Bryology 32:61-79.
- Raudenbush Z., Keeley S. J., Stark L. R., 2015. A Review: Establishment, Dispersal,and Management of Silvery-thread Moss (Bryum argenteum Hedw.) in Putting Greens. crop, forage & turfgrass management, DOI: 10.2134/cftm2014.0094, 9.
- Smith R. M., Thompson K., Warren P. H. et Gaston K. J. (2010). Urban domestic gardens (XIII): Composition of the bryophyte and lichen floras and determinants of species richness. Biological Conservation 143:873-882.
- Tsubota H., Kuroda A., Masuzaki H., Nakahara M. et Deguchi H. (2006). A preliminary study on allelopathic activity of bryophytes under laboratory conditions using the sandwich method. The Journal of the Hattori Botanical Laboratory 100:517-525.
- Vadam J. C. (2009). Regard d'ensemble sur les bryophytes du canton de Neuchâtel (CH). Les Nouvelles Archives de la flore jurassienne 7:97-122.
- Zamfir M. (2000). Effects of bryophytes and lichens on seedling emergence of alvar plants: evidence from greenhouse experiments. Oikos 88:603-611.
REMERCIEMENTS
Ce travail a été financé par l'UMR Inrae 1347 Agroécologie et par le programme PEI RegGAE (réseau Quantif ; https://www.facebook.com/Quantif-107317631510288/). L'Apad Centre-Est ainsi que l'ensemble des agriculteurs qui ont mis à disposition leurs parcelles sont remerciés. Sont aussi remerciés pour leur aide dans la réalisation de ce travail Émeline Felten, Nicolas Hénon et Éric Vieren (Inrae). La détermination des bryophytes a été rendue possible grâce à l'aide et à la validation d'Olivier Bardet (Conservatoire national botanique du Bassin parisien - Muséum national d'histoire naturelle).
 Imprimer
Imprimer