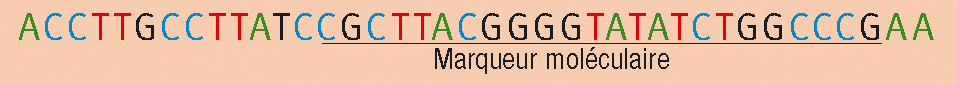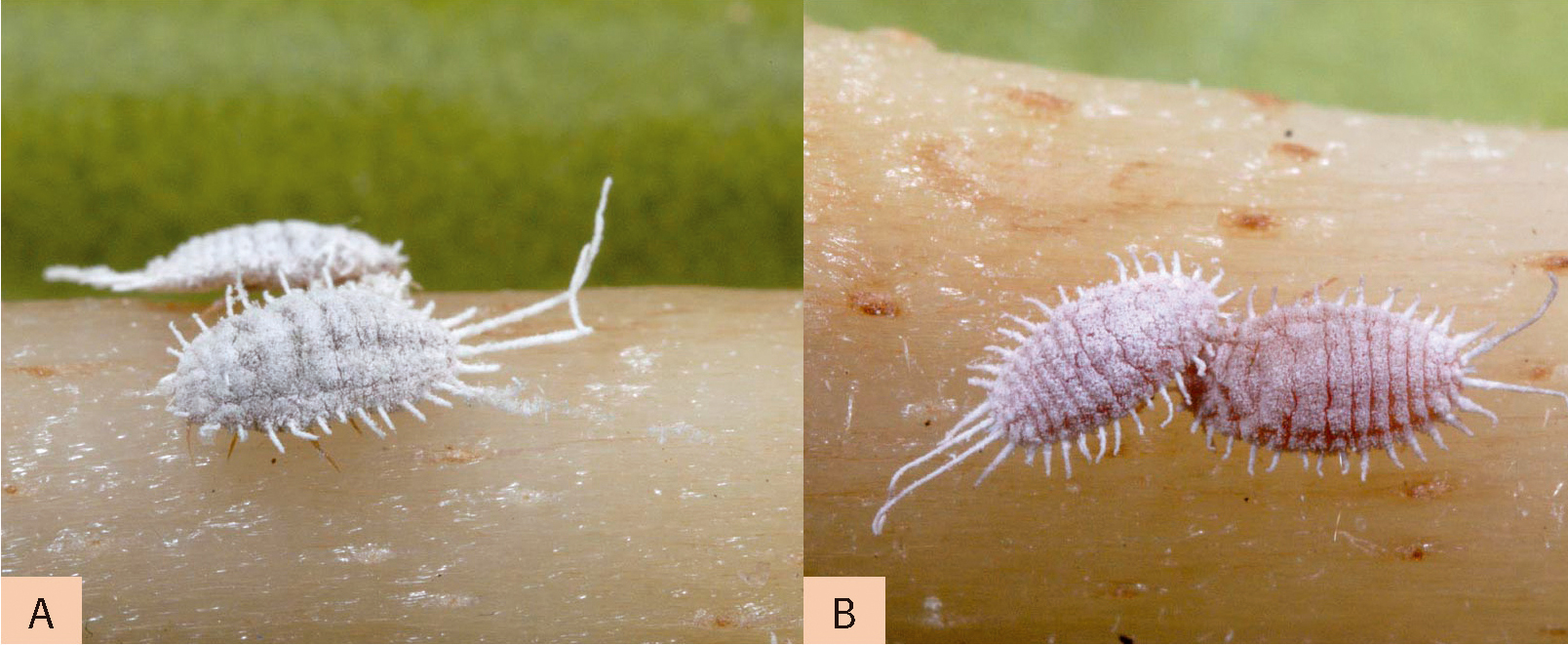
Placées sur germe de pomme de terre, deux cochenilles farineuses bien semblables ! D'où l'intérêt du diagnostic moléculaire pour déterminer leur espèce. A - Pseudococcus comstocki (femelles Hémiptère Pseudococcine ravageur du pommier Provence et Sud-Ouest). B - Pseudococcus viburni (femelles Hémiptère Pseudococcine ravageur du pommier et de la tomate en serres Provence). Photos : J.-C. Malausa
Pour protéger des végétaux contre les cochenilles farineuses, on peut pratiquer la lutte biologique en utilisant des auxiliaires. Mais la plupart de ces derniers sont des parasitoïdes spécifiques d'un genre voire d'une espèce de cochenilles, autrement dit chacun n'est efficace que contre « sa » cochenille ! Pour bien choisir son parasitoïde en fonction de l'espèce de cochenille présente, il faut commencer par l'identifier sans se tromper. Comment faire ? Nous présentons ici le principe des techniques d'identification possibles ainsi que les résultats obtenus sur l'une d'entre elles, le diagnostic par PCR, à partir de la caractérisation moléculaire d'une cinquantaine d'échantillons et une centaine d'individus de différents stades provenant de diverses cultures.
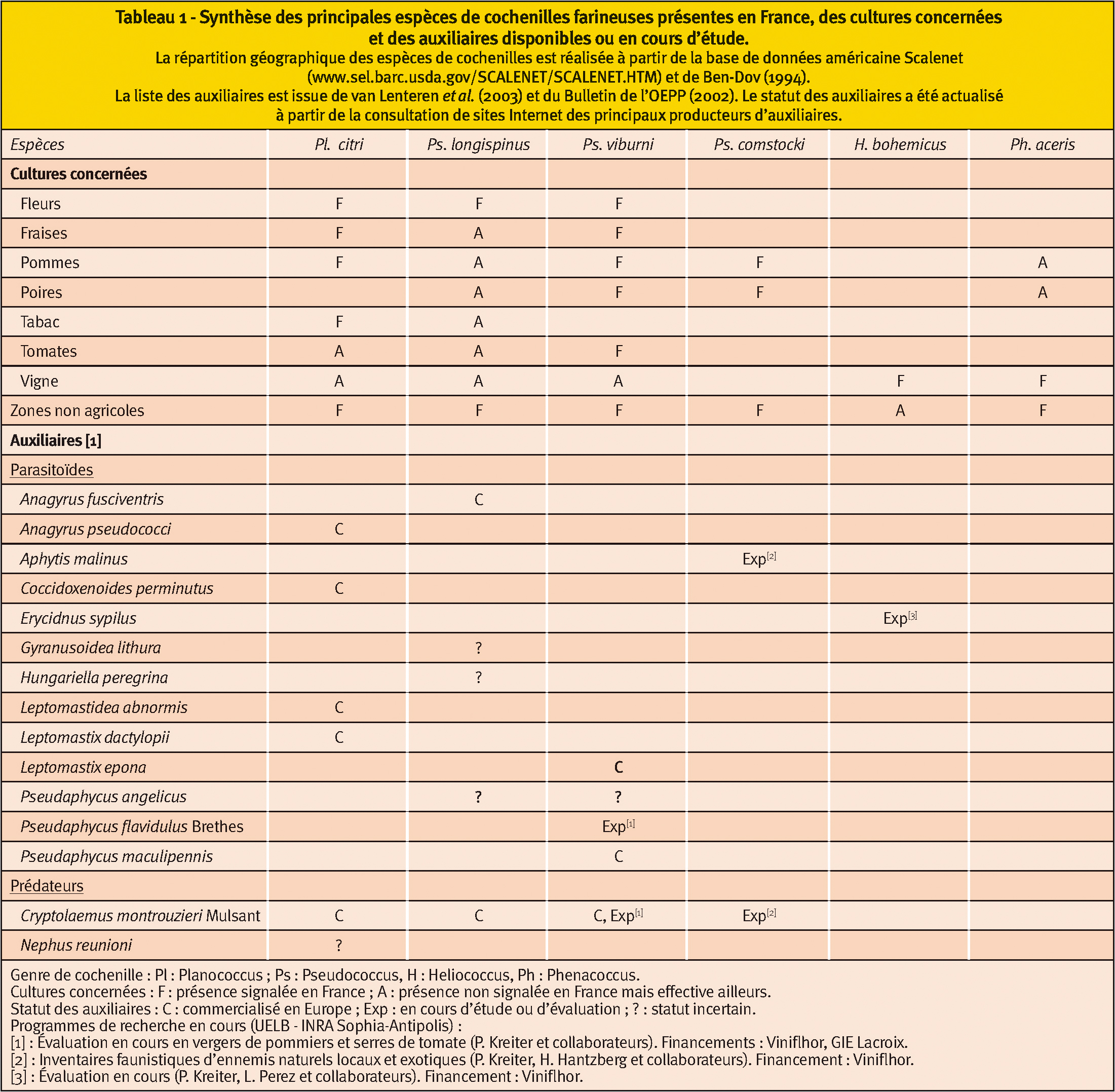
Les cochenilles farineuses (famille des Pseudococcidae), sont des insectes piqueurs-suceurs présents sur de nombreuses cultures ou en zones non agricoles (espaces verts, jardins, etc.) (Tableau 1, p. 40).
Elles peuvent infliger aux plantes des dégâts directs (plants affaiblis) ou indirects (fruits décolorés ou déformés, présence de fumagine conduisant à des écarts de tri, vection de virus). Certaines espèces sont relativement spécifiques. D'autres, plus généralistes, sont capables de se développer sur de nombreuses espèces végétales.
Il est important de noter qu'en France certaines espèces sont absentes de cultures sur lesquelles elles sont présentes ailleurs dans le monde. Cette situation suggère que la distribution des espèces n'est pas figée et qu'elle pourrait évoluer dans le temps.
Aujourd'hui, les principales espèces problématiques en France sont Planococcus citri (Risso) (cultures sous serres, zones non agricoles alias ZNA), Pseudococcus viburni (Signoret) (arboriculture, cultures sous serres, ZNA) et Pseudococcus longispinus (Targioni Tozzetti) (cultures sous serres, ZNA).
D'autres espèces comme Pseudococcus comstocki (Kuwana) semblent émerger et posent déjà localement de sérieux problèmes en verger de pommiers et sur mûrier d'ornement.
Enfin, la capacité de certaines espèces à transmettre des virus implique une vigilance spécifique, cas notamment d'Heliococcus bohemicus Šulc en vignoble.
Pourquoi tester la PCR
Lutte biologique : surtout des parasitoïdes spécifiques
Face à ces divers ravageurs, les possibilités de lutte biologique sont variables (Tableau 1).
Plusieurs auxiliaires sont commercialisés pour lutter contre P. citri. Plusieurs auxiliaires sont soit commercialisés, soit en cours d'évaluation (Kreiter et al., 2004 ; Kreiter et al., 2005) pour lutter contre P. viburni.
La mise au point de méthodes de lutte biologique débute contre P. comstocki en verger de pommiers (Kreiter et Germain, 2005) et H. bohemicus en vignoble.
L'arsenal d'auxiliaires se complète donc progressivement pour mener une lutte biologique globale contre les principales cochenilles farineuses.
Il faut souligner que l'efficacité d'un auxiliaire sur un ravageur cible peut sensiblement varier en fonction de la culture (architecture de la plante, climat, conduites culturales, etc.) Optimiser les stratégies de lutte biologique contre ces ravageurs est donc plus que jamais d'actualité.
Différencier les cochenilles : délicate « identification morphologique »
La mise en place de telles stratégies est d'autant plus complexe que plusieurs de ces espèces sont très proches morphologiquement, en particulier durant les stades juvéniles, et sont susceptibles d'attaquer une même culture. Le risque d'erreur ou d'une identification seulement partielle des ravageurs présents n'est donc pas négligeable.
Or il peut avoir des conséquences directes sur la protection des cultures concernées lorsque des auxiliaires spécifiques sont utilisés. Des erreurs de diagnostic peuvent conduire à remettre en cause, à tort, la méthode de lutte.
Seul un petit nombre de spécialistes assure l'identification morphologique précise des cochenilles farineuses. Elle repose principalement après préparation et montage entre lame et lamelle sur l'observation de systèmes glandulaires et de la chétotaxie de femelles adultes.
Par exemple, le principal caractère morphologique permettant de différencier P. viburni de P. comstocki est la présence ou l'absence de microscopiques glandes sur le premier segment des pattes postérieures. Cette distinction nécessite une réelle expérience dans ce domaine ! Dans ce contexte, la généralisation d'un diagnostic précis semble impossible. Des solutions complémentaires doivent être trouvées.
La « biomol » pas encore évaluée
L'usage de techniques de biologie moléculaire pourrait permettre de combler ce manque.
Ces techniques sont désormais très largement popularisées dans les laboratoires de recherche mais, hormis certains cas particuliers (détection de virus et de champignons phytopathogènes), on les utilise encore peu pour l'identification et plus généralement la gestion des bioagresseurs (Gariepy et al., 2007).
Matériel et méthodes
Deux ans, une cinquantaine d'échantillons
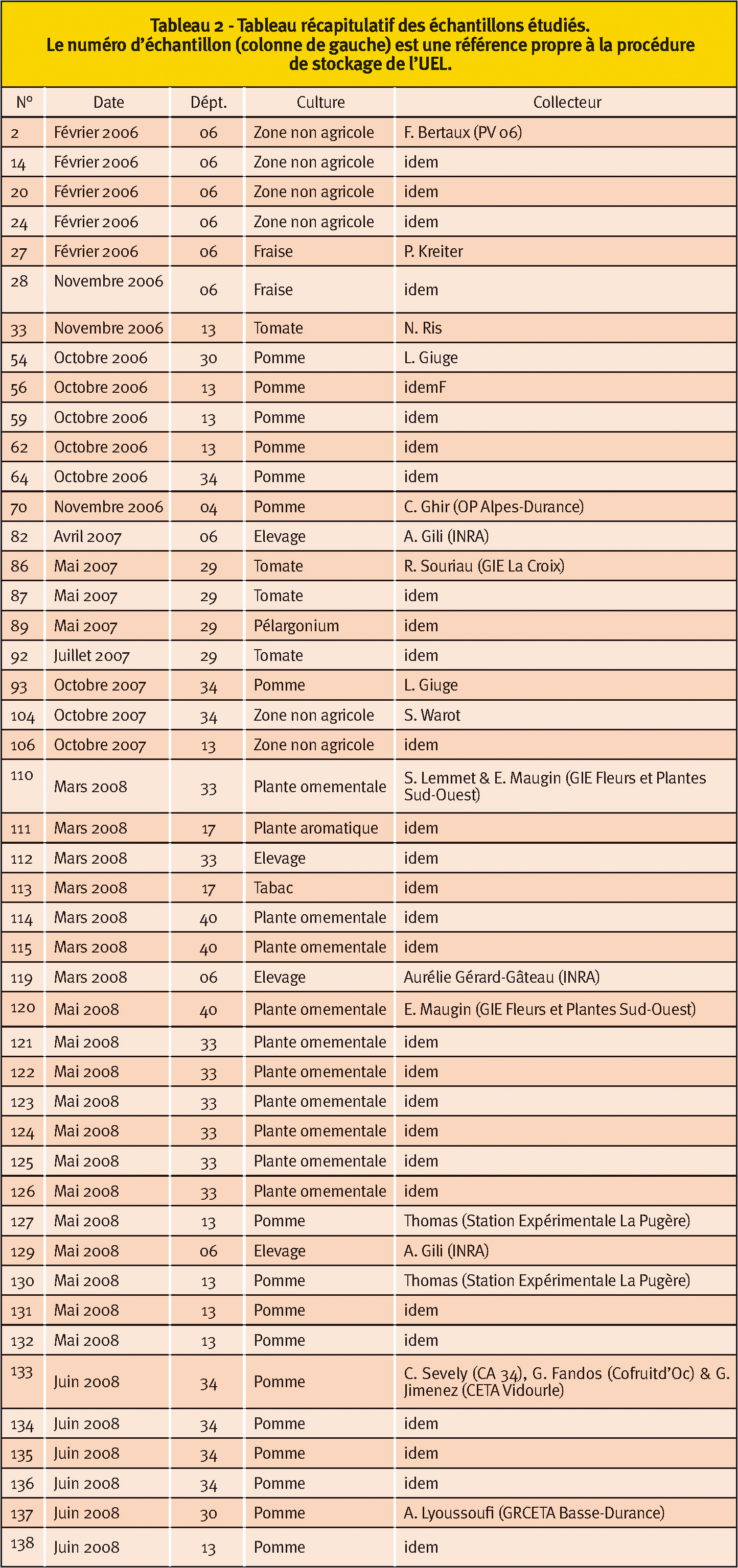
Nous avons donc décidé de tester cette identification moléculaire. Plus d'une cinquantaine d'échantillons de cochenilles ont été obtenus de 2006 à 2008 à partir de prospections réalisées par l'UELB ou ses partenaires (Tableau 2).
Les adultes, larves ou œufs contenus dans des ovisacs sont en général récupérés au pinceau, plongés dans l'éthanol (à une concentration supérieure à 70 %), puis placés dès que possible dans un congélateur. Cette procédure permet de limiter la dégradation de l'ADN avant son extraction. La plupart des échantillons sont issus du Sud de la France (Provence-Alpes-Côted'Azur et Languedoc-Roussillon notamment) et différentes cultures sont représentées.
Caractérisation moléculaire
Les descriptions des méthodes utilisées de même que la définition des termes techniques sont présentées dans l'encadré page 42.
Dans le cadre de cet article, seuls les résultats obtenus sur le marqueur moléculaire MS2-MS3 (Beuning et al., 1999) sont présentés, d'autres marqueurs ayant été mis au point et utilisés. Les amorces utilisées pour amplifier ce marqueur sont relativement spécifiques aux genres Pseudococcus, Planococcus ainsi que d'autres genres proches mais ne fonctionnent pas sur les espèces plus éloignées telles que Heliococcus bohemicus ou Phenacoccus aceris (Signoret). Le détail des procédures techniques (extractions, conditions PCR, séquençage notamment) non présenté ici est diffusable sur demande. L'ensemble de la procédure dure environ une semaine après réception des échantillons.
Résultats
46 échantillons retenus, deux régions « privilégiées »
À partir des échantillonnages réalisés entre 2006 et 2008, 46 échantillons provenant de différentes cultures (cultures sous serres et vergers de pommier en particulier) ont pu être retenus pour l'analyse (Tableau 2).
D'un point de vue géographique, deux régions ont été plus principalement échantillonnées, à savoir le pourtour méditerranéen et le Sud-Ouest ; quelques autres échantillons proviennent de Bretagne. Important : cette répartition ne reflète vraisemblablement pas la distribution réelle géographique de ces espèces mais elle est plutôt le reflet de l'effort d'échantillonnage réalisé.
Quatre espèces bien différenciées
D'une façon générale, les résultats obtenus montrent une bonne efficacité de la technique d'extraction utilisée, aussi bien sur les stades les plus âgés (L3 ou adulte) que sur les stades plus jeunes (œufs contenus dans les ovisacs ou jeunes larves).
Les quatre espèces (P. citri, P. comstocki, P. longispinus et P. viburni) sont clairement différenciées sur l'arbre phylogénétique présenté dans la figure 1.
Concernant P. viburni (parfois nommé P. affinis dans la littérature) et P. longispinus, on constate que les séquences obtenues sont logiquement très similaires à celles déjà disponibles dans les bases de données internationales spécialisées, (respectivement « Pseudococcus viburni » et « Pseudococcus longispinus » sur la figure 1). Les séquences concernant les espèces P. comstocki et P. citri sont quant à elles originales.
Comparaison avec l'identification visuelle
En termes de diagnostic, cette étude a permis :
– d'identifier sans ambiguïté une vingtaine d'individus provenant de neuf échantillons pour lesquels aucune identification visuelle n'avait été réalisée (échantillon « à déterminer » sur la figure 1).
– d'identifier deux échantillons pour lesquels une « erreur » d'identification avait été initialement faite (échantillons 130 et 131). Il s'agit dans les deux cas de prélèvements réalisés sur pommiers, sur lesquels P. viburni et P. comstocki peuvent coexister.
– de mettre en évidence un cas (échantillon 14) pour lequel deux espèces (P. citri et P. viburni) étaient en mélange, au niveau de la plante.
Conclusion
Les résultats présentés ici mettent en évidence l'intérêt de la biologie moléculaire dans le cadre du diagnostic de bioagresseurs difficilement identifiables morphologiquement.
Au-delà des cochenilles farineuses traitées ici, de telles approches pourraient être généralisées à d'autres groupes.
Mais l'expertise morphologique reste nécessaire
Il convient de remarquer que de telles techniques ne remplacent pas l'expertise morphologique qui reste nécessaire pour décrire et identifier de nouvelles espèces notamment ! D'importants programmes de recherche sont d'ailleurs actuellement consacrés à la caractérisation morphologique et moléculaire des ravageurs des cultures.
En France, le LNPV a eu ainsi à identifier morphologiquement plus de 60 espèces de Coccoidea, super-famille qui inclut les Pseudococccidae. Dans la pratique, l'avantage majeur du diagnostic moléculaire réside dans sa capacité de traitement des informations puisqu'il est possible de traiter de nombreux échantillons en parallèle et, dans une certaine mesure, d'automatiser certaines tâches (extractions, PCR, etc.).
En pratique, cela dépend aussi de...
L'intérêt de telles techniques et leur passage dans la pratique dépendent toutefois de différents facteurs :
• la fréquence effective des imprécisions ou des erreurs d'identification visuelle. Sur ce point, notre échantillonnage est probablement encore insuffisant pour estimer précisément la fréquence de ces cas et ce travail mériterait d'être généralisé ;
• les conséquences réelles de ces erreurs de diagnostic. Elles sont probablement relativement faibles lorsque les moyens de lutte peu spécifiques sont utilisés (traitements chimiques par exemple), et bien plus importantes lorsque des auxiliaires de lutte biologique spécifiques sont exploités.
Dans ce dernier cas, il faut noter qu'un éventuel échec de la maîtrise des cochenilles serait attribué à la méthode de lutte biologique, alors qu'en fait c'est le diagnostic en amont qui serait en cause.
• le coût du diagnostic. à titre d'exemple, le coût unitaire d'une identification lors de ce travail a été estimé à environ 15 € / individu... amortissement de l'équipement et personnel non compris ! Il s'agit probablement en l'état d'un prix prohibitif mais une réduction sensible est envisageable en adaptant et simplifiant certains protocoles.
• l'existence de structures pérennes dédiées pour centraliser et analyser en routine ces échantillons. D'un point de vue pratique, il convient de remarquer que ces techniques ne nécessitent qu'un équipement standard, probablement disponible dans de nombreux laboratoires d'analyse.
Demain, pister des biotypes ?
Enfin, il faut noter que le niveau de l'« espèce » n'est probablement pas toujours suffisant. Il conviendrait dans certains cas de caractériser des niveaux de variabilité plus fins.
En effet, de nombreuses espèces de ravageurs ne sont pas homogènes d'un point de vue génétique. Différents facteurs sont susceptibles de structurer leur variabilité génétique, en particulier la plante hôte ou d'autres facteurs environnementaux. C'est la notion de « biotype », bien connue notamment chez l'aleurode B. tabaci mais encore peu étudiée chez d'autres ravageurs piqueurs-suceurs. On peut faire l'hypothèse que plusieurs de ces espèces seraient composées de « sous-groupes » avec des différences biologiques notables en termes de réponse aux produits phytosanitaires (résistance/ sensibilité) voire aux ennemis naturels (résistance/virulence) ou encore de relation aux virus (capacité de vection).
Dans le cas des cochenilles farineuses, une telle caractérisation intra-spécifique pourrait plus précisément permettre :
– de mieux comprendre les processus à l'œuvre chez les espèces généralistes (P. viburni et P. citri notamment), tester l'existence de biotypes et étudier leurs conséquences sur l'efficacité des méthodes de lutte biologique ;
– de documenter les processus de diffusion des individus à l'échelle régionale (ex : P. comstocki) ou locale (P. viburni, P. citri par exemple). Concernant ce dernier point, l'importance relative des différentes sources (foyer résiduel ou contamination extérieure) des populations de cochenilles en serres fermées pourrait ainsi être étudiée et fournir des éléments pour élaborer des stratégies de phytoprotection.
Contrairement aux marqueurs utilisés pour la discrimination au niveau de l'espèce, les marqueurs nécessaires (marqueurs microsatellites notamment) pour cette discrimination ne sont actuellement pas disponibles et doivent encore faire l'objet de développement.
Remerciements
Les auteurs remercient vivement toutes les personnes qui ont contribué à l'échantillonnage. Ce travail a été financé par l'Agence nationale de la recherche (ANR) dans le cadre du programme ANR-05-PADD, EcoSerre (Responsable : Thierry Boulard).
<p>* Unité expérimentale INRA de Lutte Biologique, 400, route des Chappes, BP 167, 06903 Sophia-Antipolis.</p> <p>** LNPV, Laboratoire national de la protection des végétaux, Station de Montpellier, CBGP Campus international de Baillarguet CS 30016, 34988 Montferrier-sur-Lez cedex.</p> <p>*** Unité mixte de recherche interactions biotiques en santé végétale, 400, route des Chappes, BP 167 06903 Sophia-Antipolis</p> <p>Contacts : Nicolas Ris (Caractérisation moléculaire) : Nicolas.Ris@sophia.inra.fr</p> <p>Philippe Kreiter (Recherche et développement d'auxiliaires) : Philippe.Kreiter@sophia.inra.fr</p>
Figure 1 -
Arbres phylogénétiques obtenus à partir de l'analyse bioinformatique des séquences d'ADN.
Chaque échantillon est indiqué de la façon suivante : le nom de l'espèce a priori ou la mention « à déterminer », le stade des individus (A : ovisac ; B : jeunes larves ; C : larves agées ou femelle), le numéro de l'échantillon (cf tableau 2) et, entre parenthèses, le nombre d'individus testés.
Les méthodes de reconstruction de l'arbre phylogénétique et d'analyse de cet arbre sont diffusables sur demande.
Présentation simplifiée des principales techniques et définitions associées à l'étape de caractérisation moléculaire
Les molécules d'ADN sont des longues molécules que l'on retrouve dans la plupart des cellules animales. Chacune de ces molécules est constituée de deux brins complémentaires. Chaque brin est constitué de très nombreuses « briques » qui contiennent chacune une de ces 4 bases : l'adénine (A), la thymine (T), la cytosine (C) et la guanine (G). La complémentarité entre les deux brins se fait de la façon suivante : les bases A et T doivent se faire face, de même que les bases C et G. Une partie de molécule d'ADN peut donc se représenter de la façon suivante :
L'enchaînement des bases constitue une séquence qui contient de l'information génétique nécessaire pour la vie de l'organisme. Comme les deux brins sont complémentaires, un seul suffit à décrire la molécule. Lorsque l'on veut faire du diagnostic, on cherche à comparer l'ADN d'individus sur des zones particulières appelées marqueurs moléculaires. Après l'extraction de l'ADN des cellules, la PCR est une réaction chimique qui va permettre d'obtenir artificiellement de très grandes quantités du marqueur.
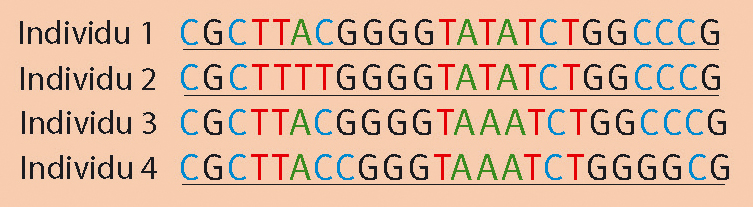
Après la PCR, on obtient majoritairement pour un individu la séquence :
L'ordre des bases n'est à ce moment toujours pas connu et c'est le séquençage qui va réellement permettre de « décoder » la séquence. Des analyses bioinformatiques vont ensuite permettre de mesurer la similarité entre individus. C'est à partir de ces alignements que peuvent être construits les arbres phylogénétiques (Voir figure 1).

 Imprimer
Imprimer