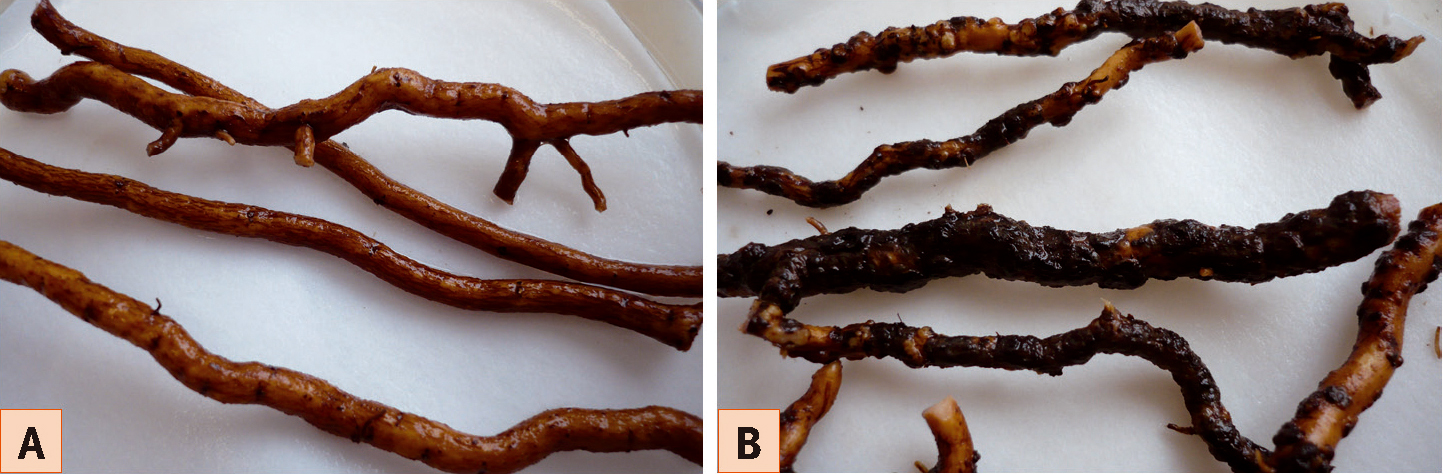
Racines du Nemadex Alain Bouquet (A) et d'un hybride sensible (B) après co-culture avec du phylloxéra. Des déformations sont présentes sur les racines sensibles, alors que celles du Nemadex AB sont intactes. Photos : L. Bordenave, INRA

Le porte-greffe Nemadex AB : A - Feuille et B - Bourgeonnement. Photos : J.-M. Boursiquot, Supagro Montpellier

Parcelle d'essai de Cabernet-Sauvignon 12 ans après plantation dans un environnement fortement contaminé par X. index à Montpellier. A et B - Plants greffés sur SO4 encadrés par des plants greffés sur Nemadex AB. C - Détail : 1er plan, vigne greffée sur SO4 ; 2e plan, vigne greffée sur Nemadex AB. Photos D. Esmenjaud, INRA.
Trente-six ans, quasiment une carrière de chercheur. C'est le temps qu'il a fallu pour mettre au point un porte-greffe « anti-courtnoué » par des procédés de sélection classique. La résistance variétale est un moyen très élégant de protéger une culture contre ses maladies, mais quel travail pour la mettre au point ! C'est encore plus vrai dans le cas du courtnoué : le moyen de protection ne peut agir qu'avant l'infection, mais son effet doit perdurer durant les années de production de cette culture pérenne qu'est la vigne. Soyons précis, son inventeur l'aurait voulu : ce porte-greffe freine l'infection par les virus du court-noué en agissant sur les nématodes du sol vecteurs de ces virus. Il se nomme Nemadex Alain Bouquet, du nom de son créateur.
La maladie du court-noué est la virose la plus grave de la vigne. Elle est répandue dans la quasi-totalité des vignobles du monde. Une estimation réalisée en 2004 par France AgriMer indique que 60 % du vignoble français serait contaminé par cette maladie, dont 30 % très fortement, et ce dans toutes les régions viticoles françaises.
Pourquoi un porte-greffe contre le court-noué ?
Une maladie très nuisible
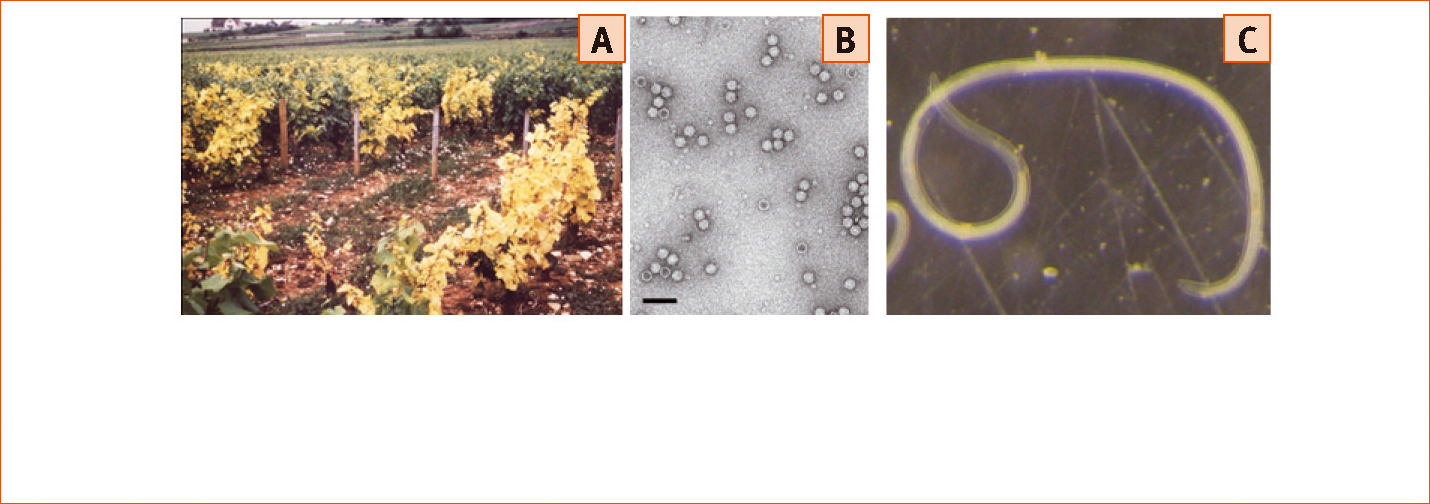
Cette maladie se caractérise principalement par un jaunissement et une déformation des feuilles, un raccourcissement des entre-nœuds (d'où son nom) et une dégénérescence progressive des ceps provoquant dans des cas ultimes leur mort (photo 1A). Elle peut engendrer jusqu'à 80 % de perte de récolte et réduit significativement la qualité des moûts.
Des plantes malades à vie après contamination
L'agent principal responsable de cette maladie est le Grapevine Fanleaf Virus (GFLV), virus de la famille des népovirus. En Europe, l'Arabis Mosaic Virus (ArMV), autre virus très proche du GFLV, est également responsable de cette maladie mais dans une moindre mesure.
Ces virus font 30 nm de diamètre et les particules virales se présentent sous une forme d'icosaèdre (photo 1B). Les particules virales hébergent le génome du virus qui porte les informations nécessaires à sa multiplication et sa propagation dans l'environnement.
Il n'y a aucun moyen de lutte direct contre ces virus une fois qu'ils ont infecté un cep. En revanche, on peut chercher à empêcher cette infection en s'attaquant à leurs vecteurs.
Des nématodes vecteurs, le portegreffe porte d'entrée naturelle
En effet, le GFLV et l'ArMV sont transmis de vigne à vigne par de petits invertébrés, précisément des nématodes, qui s'alimentent au niveau des racines. Le GFLV est transmis spécifiquement par le nématode Xiphinema index (photo 1C) alors que l'Arabis Mosaic Virus (ArMV) est transmis par X. diversicaudatum.
C'est lors des phases d'alimentation du nématode que le virus est acquis à partir d'une vigne infectée, puis transmis à une vigne saine. Les particules virales sont retenues sur la cuticule de l'appareil alimentaire du nématode. De ce fait, la porte d'entrée du virus dans un cep de vigne est son système racinaire, qui est celui de son porte-greffe dans le cas général des vignes françaises(1). C'est donc à ce niveau-là que l'on peut agir.
Une association persistante
L'association GFLV/X. index est spécifique et persistante dans le temps. Cette longévité est étroitement liée à la biologie du nématode qui a un cycle de vie très long, un faible taux de reproduction et des capacités de survie importantes dans des sols profonds.
En effet des nématodes vivants et porteurs du virus ont été isolés vivants à partir de sol provenant d'une parcelle naturellement infectée et conservés pendant 4 ans en l'absence de toute source d'alimentation.
Ces propriétés remarquables expliquent pourquoi les vignes sont re-contaminées par le GFLV même après de très longues périodes de repos du sol après l'arrachage d'une vigne, si aucun moyen de lutte contre ces nématodes n'est mis en œuvre.
La lutte chimique, c'est du passé
Jusqu'à récemment la lutte contre le courtnoué reposait principalement sur l'utilisation de matériel végétal sain et l'application de nématicides entre deux cultures pour contrôler les populations de nématodes.
Cette stratégie de lutte chimique, coûteuse et non respectueuse de l'environnement, n'est plus utilisable car les nématicides ont été progressivement interdits pour des raisons de toxicité pour l'environnement. Le dernier d'entre eux, le 1-3 dichloropropène qui était le fumigant le plus utilisé en viticulture, a été retiré du marché vigne en mars 2009.
Repos du sol, 7 ans c'est long
À défaut de traitement chimique, un repos du sol d'une durée minimale de 7 ans entre deux vignes successives est nécessaire afin d'éradiquer le nématode. Une telle interruption est économiquement inacceptable pour les vignerons, notamment dans les vignobles de cru. De ce fait, pour réduire ce délai et remplacer la lutte chimique, des stratégies de lutte contre le courtnoué sont à l'étude depuis plusieurs années.
Parmi ces alternatives, figurent la sélection de matériel porte-greffe résistant aux nématodes et le choix d'espèces végétales de jachère pour réduire les populations du nématode vecteur dans le sol.
Nemadex Alain Bouquet (AB), toute une vie de chercheur
Transmettre une résistance à du matériel greffable
En 1975, l'INRA confie à Alain Bouquet la lourde tâche d'évaluer le potentiel de Muscadinia rotundifolia (la muscadine ou « vigne à feuilles rondes »), espèce apparentée à la vigne cultivée, pour créer des variétés résistantes aux principales maladies et ravageurs. Les porte-greffe sont bien sûr concernés car M. rotundifolia est totalement résistante au phylloxéra et certains représentants sont résistants à X. index.
Mais cette espèce ne peut être utilisée directement comme porte-greffe car elle racine mal et présente une mauvaise aptitude au greffage. Il faudra donc par croisement, créer des hybrides avec d'autres espèces de Vitis pour utiliser son potentiel de résistance.
La difficulté majeure est que cette muscadine est caractérisée par 40 chromosomes alors que les espèces de Vitis en ont 38. Cela rend les croisements particulièrement hasardeux et leur taux de réussite faible.
En collaboration étroite avec des collègues américains, Alain Bouquet réalise des centaines de croisements avec du Vitis vinifera pour obtenir, in fine, un petit nombre d'hybrides de première génération et poursuivre la démarche de sélection de porte-greffe résistants au phylloxéra et limitant la recontamination par le virus du court-noué.
Pour choisir les meilleurs hybrides et poursuivre le processus, il réalise de nombreuses évaluations en conditions contrôlées notamment pour le phylloxéra (photos A et B ci-dessous), mais aussi des évaluations de plus longue durée dans des vignobles à fort potentiel infectieux vis-à-vis du court-noué.
Années 80, croiser hybrides et porte-greffe inscrits
Au milieu des années 80, il commence à croiser ces hybrides de première génération avec des porte-greffe inscrits au Catalogue Officiel, afin d'améliorer les propriétés agronomiques du matériel obtenu, et notamment son adaptation à la chlorose ferrique.
Ainsi un hybride de deuxième génération issu du croisement avec 140 Ru est repéré car il semble avoir conservé au moins en partie la capacité de limiter la recontamination par la maladie du court-noué.
L'an 2000 approche, un candidat retenu... pour se présenter
Fin des années 90, les premières expérimentations sont installées au vignoble avec ce portegreffe candidat.
Après 10 années d'observations à la fois virologiques et agronomiques, la démarche d'inscription est initiée pour le nouveau porte-greffe Nemadex Alain Bouquet. Hélas Alain Bouquet n'aura pas la joie de voir l'aboutissement de ses efforts, puisqu'il décède en mai 2009.
Inscription en 2011
Le Nemadex Alain Bouquet (photos A et B cidessus) est finalement inscrit au Catalogue officiel des espèces et variétés de plantes cultivées en France en mai 2011 (plants de vigne, JORF n° 0122 du 26 mai 2011).
Un porte-greffe qui retarde la contamination par le virus du court-noué
L'effet vis-à-vis du court-noué, vient de celui sur les populations de nématodes
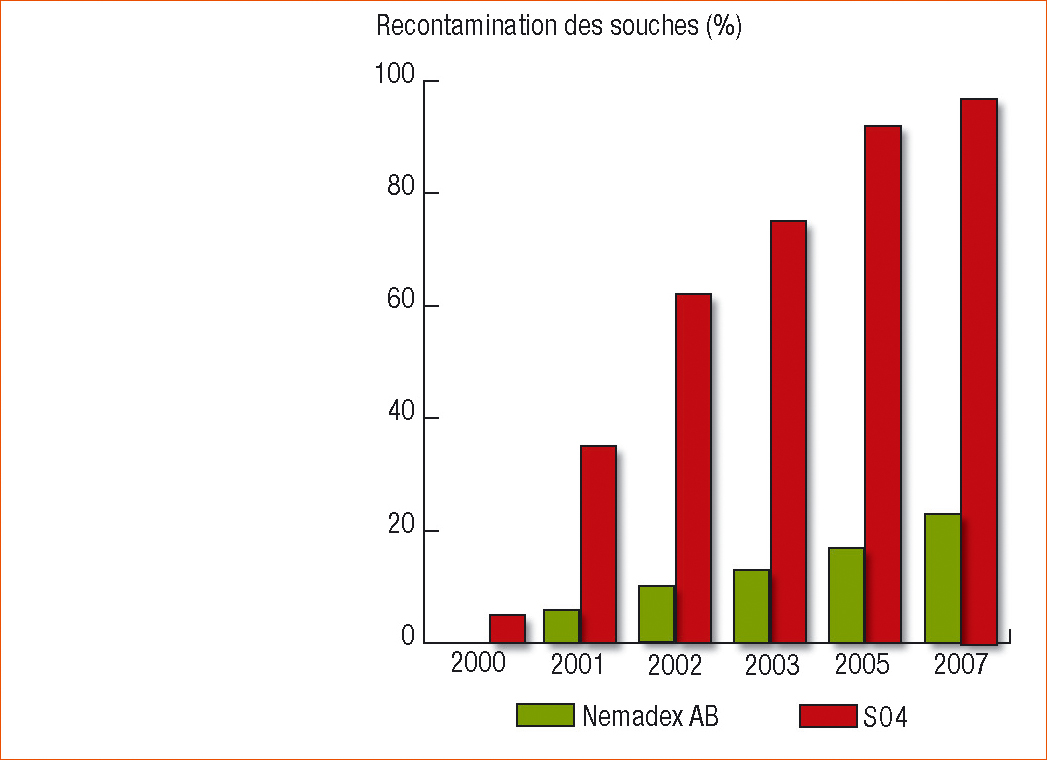
Le principal atout du Nemadex AB est qu'il retarde fortement le développement des populations du nématode vecteur X. index. Par conséquent, il induit au vignoble un net retard à l'infection par le GFLV. Dans des parcelles où les plants greffés sur des porte-greffe témoins ont été réinfectés à 100 % au bout de 5 ans après plantation, les plants greffés sur Nemadex Alain Bouquet n'ont pas dépassé le taux de 20 % d'infection à cette date (Figure 1 et photos ci-dessus).
La recontamination des plantes greffées sur des porte-greffe témoins est plus rapide que celle des plantes greffées sur Nemadex AB.
Attention aux limites
Cependant, il est pour l'instant fortement recommandé de dévitaliser les vignes avant arrachage et de laisser le sol au repos au minimum une année avant plantation avec ce porte-greffe. Dans des parcelles très contaminées, ces préconisations sont impératives. Il n'est pas recommandé de l'utiliser pour complanter dans des parcelles fortement court-nouées.
Comportement agronomique
En pied mère, le Nemadex AB paraît faible producteur de bois (au niveau du 333 EM ou du Rupestris du Lot) avec des rameaux assez grêles et une forte propension au développement des axillaires, ce qui lui donne un aspect buissonnant. Des systèmes de conduite favorisant sa culture sont à l'étude.
Il présente une aptitude au bouturage et au greffage ligneux moyenne à bonne. Les expérimentations réalisées par l'IFV avec plusieurs greffons ont révélé des taux de réussite variant de 50 à 70 %.
Son aptitude au greffage herbacé est également moyenne à bonne, du même ordre de grandeur que les autres porte-greffe. Les résultats obtenus dans le cadre du réseau d'expérimentation national implanté à partir de 2008 montrent une très bonne reprise à la plantation pour les greffesboutures herbacées, et ceci pour les 19 cépages expérimentés.
Sa résistance à la chlorose calcaire semble assez faible. Elle serait, d'après les premières expérimentations au vignoble, légèrement inférieure à celle du SO4. Il est préférable de réserver ce porte-greffe à des sols ne dépassant pas 15 % de calcaire actif et 30 d'IPC. Un effet cépage important a été noté sur la sensibilité à la chlorose en Champagne.
Il est encore trop tôt pour définir précisément sa tolérance à la sécheresse. Mais les observations faites en 2010 sur des plantations de 2 ans en zones sèches semblent révéler que le Nemadex AB est moins résistant que les porte-greffe auxquels il a été comparé (140 Ru, Fercal).
D'après les données recueillies sur des dispositifs adultes (> 5 ans), il paraît qu'en situation saine le porte-greffe permet de contrôler la vigueur conférée et le rendement en comparaison avec des porte-greffe témoins tels que SO4 et 110 R. Les données qualitatives obtenues sur les vins ne montrent pas d'effet spécifique du porte-greffe sur la maturation.
Comment se procurer du matériel végétal ?
C'est l'IFV qui est pré-multiplicateur officiel et exclusif de ce porte-greffe. L'installation des parcelles de pré-multiplication et de multiplication a démarré et trois parcelles de prémultiplication ont été plantées. Les premières récoltes de bois auront lieu au cours de l'hiver 2011-2012. Des plants issus de bouturage herbacé ont déjà été mis à disposition de la filière.
Les commandes de plants de base ont bien démarré et devraient être satisfaites fin 2013. Les premiers plants greffés sur Nemadex AB devraient être distribués par les pépiniéristes à partir de 2013 (plants en pots) ou 2014 (plants traditionnels) mais les quantités disponibles seront très limitées. Les viticulteurs ne trouveront de plants disponibles sur le marché en quantité significative, qu'à partir de 2015-2016.
Le réseau national d'expérimentation
Associé à 19 cépages et comparé avec 10 autres porte-greffe
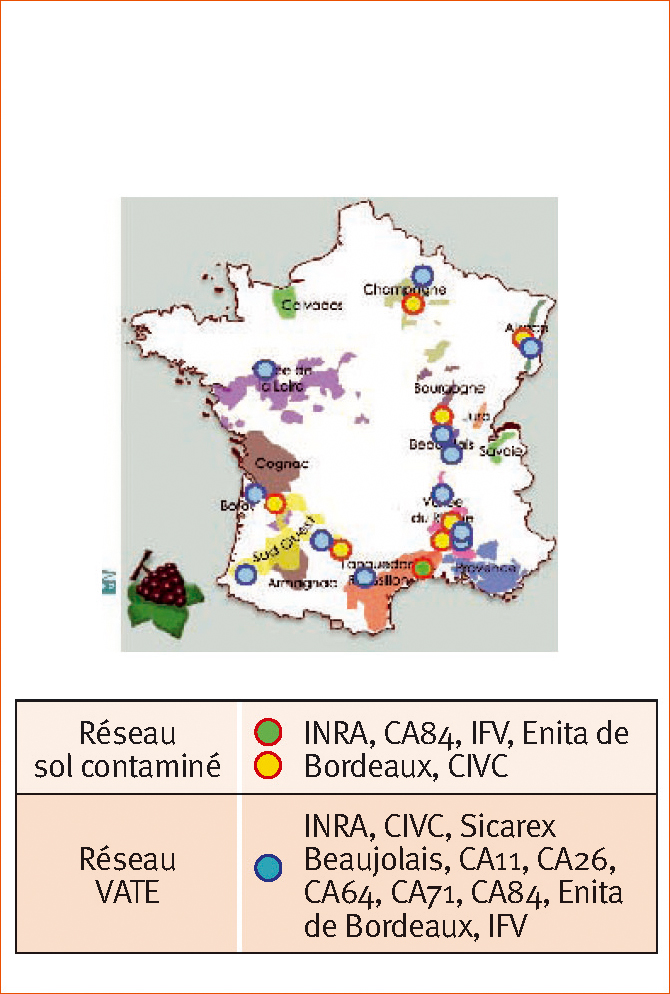
Ce nouveau porte-greffe est en cours d'évaluation agronomique dans une vingtaine de sites en France (Figure 2). Il est ainsi associé à 19 cépages différents et comparé à 10 porte-greffe témoins.
L'objectif de cette évaluation est d'acquérir plus de références sur le comportement du Nemadex AB en situation fortement contaminée et d'observer son comportement agronomique avec plusieurs variétés de greffons (réseau 'VATE' Valeur Agronomique Technologique et Environnementale), le tout dans diverses situations pédo-climatiques françaises. Ceci permettra de compléter les observations citées plus haut et de mieux cerner les atouts et limites de ce porte-greffe.
Huit parcelles en sol contaminé
Le réseau en sol contaminé est constitué de huit parcelles. Deux parcelles adultes, l'une de 12 ans à Montpellier (citée plus haut) et l'autre de 8 ans à Châteauneuf-du-Pape ont été replantées immédiatement après l'arrachage.
À Montpellier, il n'y avait pas eu dévitalisation avant l'arrachage, contrairement à Châteauneuf-du-Pape. En 2008, six parcelles supplémentaires ont été mises en place dans des conditions maximales d'infestation (remplaçants au sein d'une parcelle très court-noué, sans dévitalisation et sans ôter les racines du cep précédent). Le suivi porte sur l'avancement de la recontamination par le court-noué (évaluée par tests Eli sa). Mais il prévoit aussi d'aller jusqu'au comportement des ceps contaminés en termes de rendement et d'expression végétative.
Sur les deux parcelles adultes, un net retard à la contamination a été observé avec le Nemadex AB. Les vignes greffées sur le porte-greffe témoin se distinguent fortement de celles plantées avec le Nemadex AB par la présence de symptômes très marqués de court-noué. Sur les parcelles jeunes, les premiers résultats sont en cours d'acquisition. Ils permettront de fixer les conditions d'utilisation du porte-greffe les mieux adaptées.
12 parcelles en sol non contaminé
Le réseau VATE est constitué de 12 parcelles en sol volontairement non contaminé. Il a pour objectif de caractériser le comportement du Nemadex AB comparé à un porte-greffe témoin adapté à la région et à la parcelle. Cette caractérisation passe par la réalisation de mesures agronomiques (phénologie, production, maturité, résistance aux maladies, carences notamment chlorose, comportement hydrique) allant jusqu'à la vinification et la dégustation des vins.
Les résultats de ce réseau sont en cours d'acquisition puisque les parcelles les plus anciennes ont été plantées en 2007.
Les perspectives
Nous venons de voir que les avantages et les limites de l'utilisation du Nemadex AB sont à l'étude à l'échelle du vignoble français.
Les résultats obtenus à partir des parcelles les plus anciennes montrent que la recontamination virale est significativement retardée au vignoble, mais qu'elle a cependant lieu. Ces résultats soulignent la nécessité d'associer ce porte-greffe à d'autres voies de contrôle du nématode vecteur et de poursuivre les recherches pour créer d'autres porte-greffe plus performants.
Début de travail sur les « plantes à jachère anti-nématodes » et leur association avec le Nemadex AB
Parmi les méthodes de contrôle du nématode vecteur, la jachère cultivée entre deux implantations de vignes est la voie préférentielle. Pour être efficace, la jachère utilisée seule doit aujourd'hui être de longue durée (> 7 ans) et basée sur des cultures a priori non hôtes du nématode. Cette nécessité d'une longue durée de repos du sol a été confirmée par la mise en évidence des aptitudes remarquables de survie du nématode (sans plante hôte) et de la présence du GFLV dans le nématode, pour une période au moins égale à 4 ans.
La caractérisation de plantes à effet antagoniste vis-à-vis de Xiphinema index, qui seraient en mesure de réduire cette durée de repos, a fait l'objet de très peu d'études. Des travaux entrepris récemment en France portent sur une première étape d'évaluation de l'effet antagoniste, en pot sous infestation contrôlée de serre, de plantes sélectionnées sur la base de leur effet vis-à-vis d'autres nématodes. Cette étape a permis de pré-sélectionner des espèces candidates pour une évaluation en parcelle viticole naturellement contaminée dans un dispositif dit « en damier » et sur un seul cycle de culture.
Un dispositif de terrain de longue durée (6 à 10 ans) permettra ensuite d'étudier l'effet des plantes testées durant le repos du sol sur le processus de recontamination de la vigne qui suit. Ces dispositifs permettront de valider directement en parcelle fortement infestée par des nématodes porteurs de virus l'intérêt agronomique des plantes retenues.
Certains de ces essais de longue durée incluront le porte-greffe Nemadex AB en comparaison avec un porte-greffe témoin. Il sera ainsi possible d'évaluer l'effet combiné du repos du sol et de l'utilisation de Nemadex Alain Bouquet sur la dynamique de recontamination par le virus de la parcelle de vigne concernée. Cette approche combinée doit permettre à terme d'optimiser l'utilisation du porte-greffe Nemadex AB dans le cadre d'une véritable lutte intégrée contre le court-noué au vignoble.
Et lui trouver des « petits frères », issus de la même mère hybride ?
En parallèle, des recherches ont été conduites pour identifier d'autres sources de résistance chez les Vitacées vis-à-vis du nématode vecteur. Des croisements entre la mère de Nemadex AB (l'hybride F1 Vitis x Muscadinia) et un parent plus résistant que 140 Ru vis-à-vis de X. index ont commencé. Ils permettront de sélectionner du matériel porte-greffe avec un niveau accru de résistance au nématode et entraînant une contamination encore plus tardive par le courtnoué. L'objectif est de pouvoir utiliser ces nouveaux porte-greffe sans repos de sol et pour les complantations. Ces travaux doivent également permettre d'améliorer les propriétés culturales de ce nouveau matériel végétal.
Ce programme d'innovation porte-greffe est soutenu activement par l'INRA. Lorsqu'arrivera cette nouvelle génération de porte-greffe, l'ensemble des données recueillies au vignoble sur Nemadex AB auront permis de mieux définir le mode d'emploi d'un porte-greffe résistant au nématode vecteur en fonction de la spécificité de nos vignobles.
Par ailleurs, des travaux basés sur la résistance dérivée du virus par ARN interférence sont entrepris afin de tenter de combiner la résistance génétique au nématode et la résistance transgénique au GFLV. Cette étude menée en confinement, et dans une perspective d'acquisition de connaissances sur la robustesse et la durabilité d'une telle association de résistances, permettra d'évaluer le potentiel de l'ARN interférence dans la résistance à l'ensemble du pathosystème « court-noué », des porte-greffe de type Nemadex AB.
<p>* INRA, ISVV, UMR EGFV, 210, chemin de Leysotte, 33140 Villenave-d'Ornon, ollat@bordeaux.inra.fr</p> <p>** IFV, Domaine de l'Espiguette, 30240 Le Grau-du-Roi.</p> <p>*** INRA, UMR IBSV, 06903 Sophia-Antipolis.</p> <p>**** INRA, UMR SVQV, 28, rue de Herrlisheim, 68021 Colmar.</p> <p>*** ** Chambre d'agriculture de Vaucluse, 2260, route du Grès, 84100 Orange.</p> <p>*** *** ENITA-ISVV, VitInnov, 1, cours du Général-de-Gaulle 33170 Gradignan.</p> <p>(1) En France, depuis la crise phylloxérique du XIXe siècle, il n'y a quasiment plus de vignes de production franches de pied, à quelques curiosités près comme les mythiques « vieilles vignes françaises » de Bollinger : 58 ares...</p>
Figure 1 - Évolution du pourcentage de souches contaminées par le court-noué au cours de 7 années après la plantation sur une parcelle très contaminée plantée de Cabernet-Sauvignon greffée sur Nemadex AB et sur SO4. (Source INRA/IFV)

 Imprimer
Imprimer