Les plantes résistent à la majorité des bioagresseurs : elles perçoivent leurs attaques et y répondent en déclenchant des mécanismes de défense variés. Les cas de « maladie » résultent d'une perception défaillante. D'où l'idée d'utiliser des substances stimulatrices de défense des plantes (SDP) pour pallier cette défaillance. Mais il faut tester ces substances. La qPFD peut aider à cela.
Que font les plantes face aux bioagresseurs ?
Mécanismes de défense, trois catégories
Il existe trois catégories de mécanismes de défense des plantes :
– l'établissement de barrières chimiques grâce à la synthèse de composés à action antimicrobienne et insecticide,
– l'établissement de barrières physiques par épaississement et rigidification des parois des cellules végétales,
– l'émission de signaux à partir du point d'attaque pour une activation généralisée des défenses dans l'ensemble de la plante.
Les deux premières catégories mettent en œuvre des voies métaboliques variées, parfois communes. La troisième correspond à une signalisation hormonale mettant en jeu trois phytohormones principales, l'acide salicylique, l'acide jasmonique et l'éthylène. Chaque hormone gouverne ses voies (ou parties de voies) métaboliques propres mais les trois interagissent de façon complexe d'où des synergies et antagonismes.
Les réponses de défense exprimées en aval ne sont pas spécifiques d'un agresseur donné. Néanmoins, la plante ne déclenche jamais simultanément tout son arsenal. En fait, elle adapte dans une certaine mesure sa réponse à ce qu'elle perçoit grâce à la fine régulation de sa signalisation hormonale.
La maladie, un cas particulier
L'état de maladie d'une plante est donc en fait un cas particulier. Il résulte d'une adaptation extrême de certains bioagresseurs, micro-organismes ou ravageurs.
Cette adaptation se traduit notamment par une perception absente ou incomplète de la part de la plante (dite plante hôte), qui ne déclenche pas ses défenses ou ne les déclenche pas efficacement. Le bioagresseur peut alors s'installer, se multiplier aux dépens de son hôte et, in fine, entraîner des symptômes donc des pertes de rendement ou de qualité des cultures.
D'où l'intérêt des SDP
Objectif commun pour deux catégories
L'objectif visé par l'application d'un stimulateur de défense des plantes (SDP, dit aussi éliciteur exogène) est de pallier l'absence de perception précoce des bioagresseurs ou leur perception imparfaite, en forçant l'activation des défenses de leurs plantes hôtes de façon temporaire.
Certains SDP déclenchent directement les défenses ; on parle alors d'effet direct. D'autres préparent la plante à déclencher ses défenses en cas d'agression ultérieure ; on parle alors d'effet potentialisateur ou encore de « priming ».
Des intrants très Ecophyto
Les SDP pourraient ainsi représenter une nouvelle génération d'intrants destinés à la protection des cultures. Ils ont des atouts dans le contexte Ecophyto de réduction des pesticides :
• Contrairement à ces derniers, ils n'ont pas, pour la plupart, d'action biocide directe sur les bioagresseurs visés, ni plus généralement sur la flore et la faune.
• L'activation d'un large panel de défenses les rend, en principe, efficaces contre divers bioagresseurs d'une même plante hôte. • Ce mode d'action indirect et varié rend peu probable l'émergence de résistance chez les bioagresseurs.
Ils peuvent être d'origine naturelle, du composé purifié au micro-organisme vivant en passant par l'extrait quasi-brut d'organismes divers, reconnus par la plante comme le « non soi ». Ils peuvent être aussi d'origine synthétique et/ou agir en aval de la perception par action directe sur des voies métaboliques impliquées dans les défenses.
Le criblage actuel des SDP en amont des essais de protection : un constat
Tester, avec ou sans cuticule ?
Avant de tester l'efficacité d'un SDP à protéger une culture sur le terrain, il est logique de s'assurer de sa capacité à activer les défenses de plantes représentatives de cette culture. Or il n'existe pas à l'heure actuelle de méthode objective standard pour mettre en évidence cette propriété.
Une capacité de stimulation de défense d'un candidat SDP peut avoir été décelée à l'aide de systèmes artificiels type suspensions cellulaires ou organes détachés, et/ou sur des plantes modèles type tabac (Nicotiana tabacum) ou arabette (Arabidopsis thaliana). Mais les organes aériens des végétaux sont recouverts d'une cuticule. Cette couche cireuse protectrice diffère d'une espèce végétale à une autre et peut empêcher le SDP d'atteindre les récepteurs de la culture à protéger.
La généralisation à partir de résultats obtenus dans des systèmes expérimentaux de ce type peut donc présenter des risques.
Selon le laboratoire
Par ailleurs, les méthodes d'analyse des défenses sont souvent différentes ou seulement partiellement superposables selon les laboratoires, qu'ils soient privés ou publics.
Ces méthodes peuvent être basées sur la quantification de l'expression de gènes, de protéines ou de métabolites, et ciblent des éventails plus ou moins larges de mécanismes de défense. Certains travaux vont jusqu'à l'analyse exhaustive des mécanismes induits par des méthodes de type transcriptomique, protéomique ou métabolomique ; mais cela reste coûteux ou non encore accessible pour toutes les espèces végétales. Il est donc difficile d'avoir une vision claire de l'efficacité d'induction de plusieurs SDP sur une même culture, ou de l'efficacité d'induction d'un SDP sur plusieurs cultures.
Méthodologie standard développée à l'INRA d'Angers sur pommier
La qPFD entre en scène
Devant ce constat, nous avons décidé de développer une méthodologie standard de criblage des SDP. Cette méthodologie nouvelle consiste à analyser sur plantes entières le niveau d'activation de 28 gènes de défense au moyen d'un outil moléculaire appelé qPFD (Puce à Faible Densité quantitative).
Phytopathologistes du pommier impliqués dans la problématique SDP depuis de nombreuses années, nous l'avons mise au point pour cette espèce. Ceci n'empêche pas de la transposer à d'autres espèces végétales, nous le verrons plus loin.
Jeunes plants de pommiers, plantes entières
L'expérimentation s'effectue en routine en conditions semicontrôlées (serre) sur jeunes plantules de 4 à 6 semaines issues de semis de pommier (Photo 1), les pépins provenant de la pollinisation libre de la variété Golden Delicious.
Ces plantes diffèrent du pommier en verger mais constituent un système moins artificiel que des cultures cellulaires ou des organes détachés. Elles permettent le développement normal de grands bioagresseurs du pommier : Erwinia amylovora (feu bactérien), Venturia inaequalis (tavelure) et Dysaphis plantaginea (puceron cendré). Elles sont disponibles toute l'année.
Candidats pulvérisés
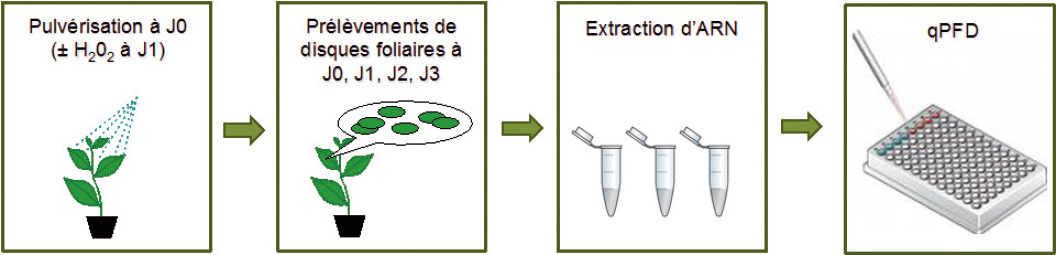
Les plantes sont pulvérisées jusqu'en limite de ruissellement avec les SDP candidats (ou de l'eau en témoin négatif) (Photo 2). Les tissus sont prélevés dans les jours suivant la pulvérisation pour y analyser les défenses (Figure 1).
Une application de peroxyde d'hydrogène (H2O2) visant à mimer une attaque par un bioagresseur peut intervenir le lendemain de la pulvérisation des SDP. Si des défenses sont induites hors application d'H2O2, on en déduit que le SDP est un stimulateur direct. Si elles sont induites seulement après application d'H2O2 (ou induites plus fortement), on aura plutôt à faire à un potentialisateur.
Mesure du niveau d'expression de 28 gènes
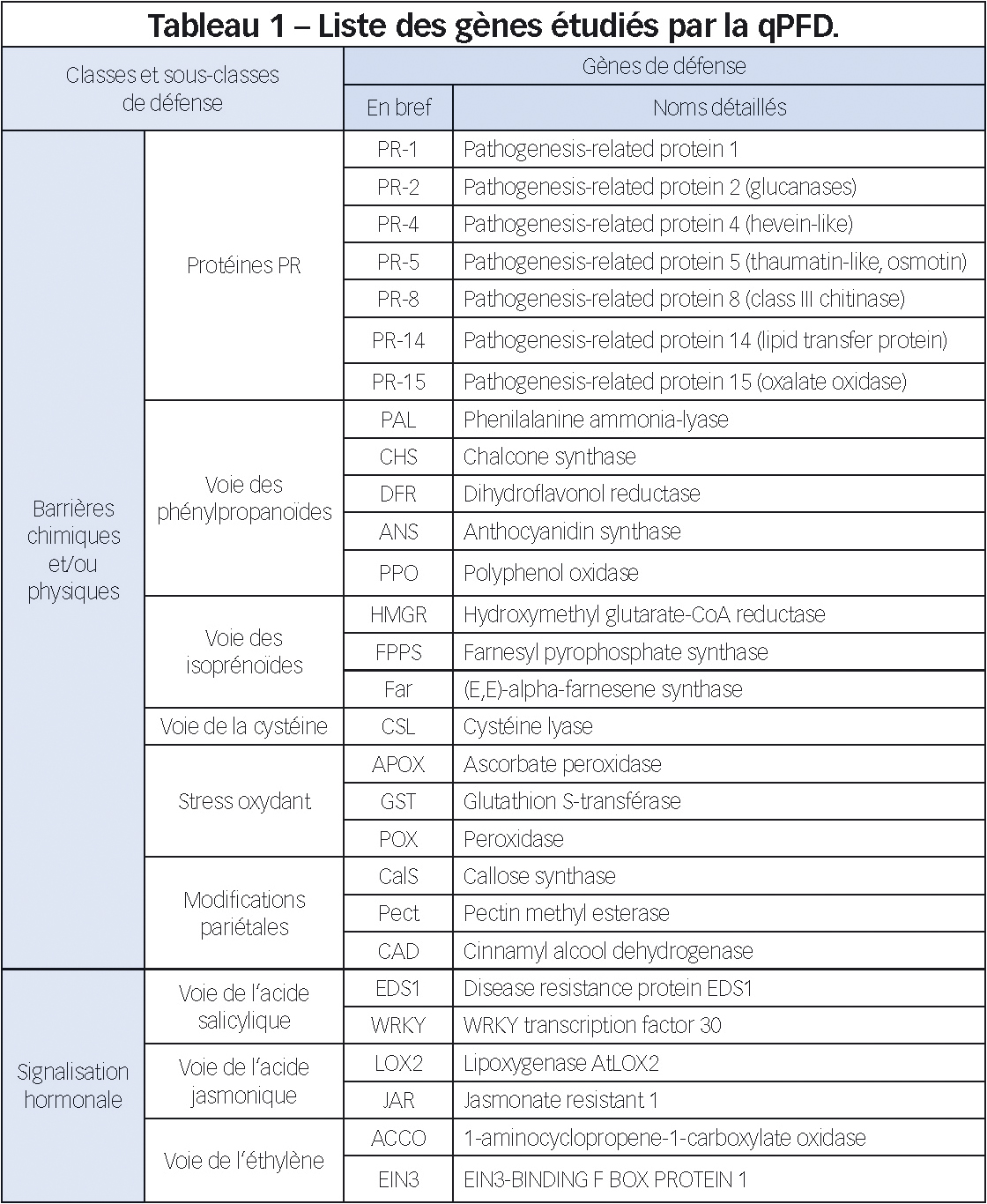
L'analyse des défenses est réalisée à l'aide de la qPFD. Cet outil mis au point par notre équipe a été récemment breveté (brevet INRA WO 2011/161388). Il permet de déterminer le niveau d'expression de 28 gènes de défense par qPCR (Polymerase Chain Reaction Quantitative) dans un échantillon de pommier. Nous avons choisi pour cible des mécanismes de défense répartis dans les trois grandes classes déjà citées : barrières chimiques (1), barrières physiques (2) et signaux (3).
Il s'agit de gènes codant des protéines PR (pour Pathogenesis Related ; classes 1 ou 2 selon les cas) et des enzymes impliquées dans diverses voies du métabolisme secondaire (classes 1 ou 2), dans la réponse au stress oxydant (classes 1 ou 2) et dans des modifications pariétales (classe 2), ainsi que des gènes de signalisation des trois principales phytohormones de défense, l'acide salicylique, l'acide jasmonique et l'éthylène (classe 3). Le détail est listé tableau 1.
Pas exhaustif mais suffisamment large
La qPFD n'est pas exhaustive vis-à-vis de l'ensemble des mécanismes de défense des plantes, mais elle analyse un éventail de gènes assez large pour que la probabilité de ne pas repérer un « vrai » SDP sur pommier soit extrêmement faible.
En effet, on l'a vu, les défenses sont soumises à des régulations complexes avec multiples interactions entre voies, et l'existence de mécanismes totalement indépendants de ceux représentés sur la qPFD n'a pas à notre connaissance été rapportée à ce jour.
Présentation pratique
En pratique, l'outil se présente sous forme d'une plaque PCR 96-puits contenant les amorces déshydratées des 28 gènes de défense et de trois gènes de référence (pour normaliser les quantités d'ADNc entre échantillons), en trois exemplaires. Il est prêt à l'emploi pour l'analyse par PCR quantitative d'un échantillon d'ARN (acide ribonucléique) de pommier rétrotranscrit en ADN (acide désoxyribonucléique), préalablement mélangé à un mix SYBR®Green (agent fluorescent intercalant permettant la quantification de l'ADN amplifié) et distribué sur l'ensemble de la plaque.
Les résultats sont des quantifications relatives d'expression des 28 gènes de défense dans les échantillons de tissus ayant reçu des candidats SDP par rapport à un échantillon témoin. Ce dernier peut être des tissus prélevés sur une plante non traitée avant début de l'expérimentation, ou un échantillon de plante traitée à l'eau et prélevé au même moment que les échantillons de plantes traitées aux candidats SDP.
Exemple de résultats obtenus avec onze SDP candidats
Une expérience réitérée trois fois
Onze SDP potentiels (codés de A à K) ont été testés selon cette méthodologie. Un traitement à l'H2O2 a été appliqué sur la moitié des lots un jour après l'application des SDP. Le test a été réalisé trois fois à l'identique sur des plantules obtenues à diverses périodes de l'année.
L'expression des défenses a été étudiée un, deux et trois jours après pulvérisation des SDP, dans les plus jeunes feuilles développées des plantules. Ce sont en effet les organes à protéger en priorité car les plus sensibles aux bioagresseurs.
Quatre des candidats révélés
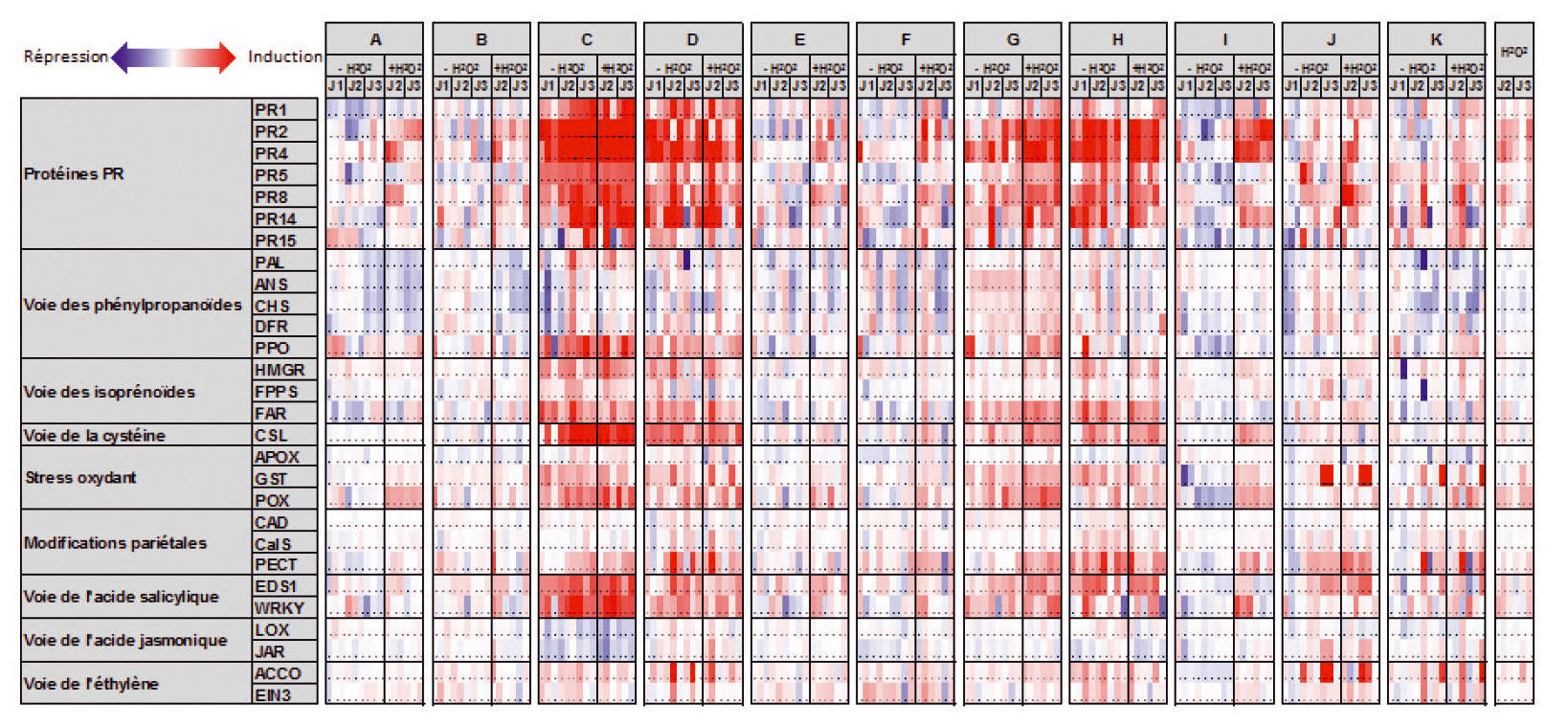
Les résultats sont présentés sous forme de carte de densité qui permet de visualiser les différences de niveaux d'expression des 28 gènes de défense dans les plantes traitées aux SDP par rapport à des plantes témoins traitées à l'eau (Figure 2).
Ils révèlent quatre produits (C, D, G et H) capables d'activer, de façon très reproductible sur les trois expériences, un bon nombre de gènes de défense présents sur la qPFD notamment dans les catégories « protéines PR », « voie des isoprénoïdes », « stress oxydant » et « voie de l'acide salicylique ». L'induction des défenses, significative dès 24 heures après traitement, se maintient sur la durée des tests (3 jours). Les produits C, D et H sont des stimulateurs directs : le traitement à l'H2O2 ne change pas le niveau d'expression des gènes. Le produit G a un effet potentialisateur qui s'ajoute à l'effet direct. Le produit I présente un profil de potentialisateur spécifique mais avec un petit nombre de gènes de défense induits après traitement à l'H2O2. Enfin, les six autres candidats n'activent pas ou peu, ou seulement ponctuellement, les gènes de la qPFD.
Pour comparer, test d'efficacité contre le feu bactérien sur pommier
Pour valider ces résultats, les onze SDP candidats ont été testés en parallèle pour leur efficacité vis-à-vis du feu bactérien.
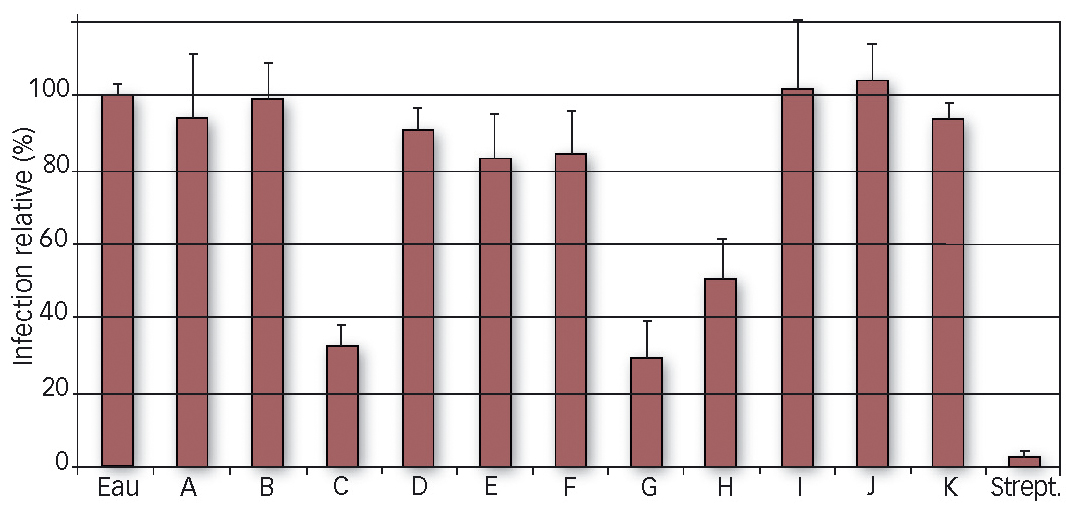
Trois tests indépendants ont été réalisés sur du matériel végétal similaire dans les mêmes conditions (serre) que pour l'analyse des défenses. Les SDP ont été appliqués 4 jours avant inoculation artificielle par la bactérie responsable E. amylovora. Leur effet a été comparé à un témoin d'infection (eau) et un témoin de protection (streptomycine appliquée 4 heures avant inoculation).
Les résultats montrent que trois produits, numérotés C, G et H, protègent de manière significative les plantules. Les huit autres produits ne diffèrent pas du témoin eau (Figure 3, photo 3).
Intérêt pour un pré-criblage
L'ensemble de ces expérimentations montre l'intérêt de la qPFD dans un pré-criblage des SDP.
La corrélation entre induction des gènes de défense et efficacité protectrice n'est pas totale : un SDP à potentiel d'induction significatif s'avère non protecteur (produit D).
En revanche, les six candidats non inducteurs de gènes de défense, ainsi que le produit I potentialisateur d'un nombre restreint de gènes, se révèlent non protecteurs tout au moins vis-à-vis du feu bactérien.
L'outil qPFD pourrait être utilisé pour repérer, avant tout essai de terrain coûteux et long, les produits sans vrai potentiel de stimulation de défense sur pommiers même placés en bonnes conditions de réactivité (environnement non stressant, pulvérisation jusqu'en limite de ruissellement, faible épaisseur de cuticule). Les tests en verger seraient bien réservés aux SDP « vrais » du pommier, d'où gain de temps, d'énergie et d'argent considérable au bénéfice de toute la profession.
Perspectives
Vigne, tomate, pomme de terre, vers la transposition
Les gènes choisis étant très conservés entre espèces végétales, la transposition de l'outil à d'autres espèces d'intérêt agronomique est possible. Elle peut être envisagée dès lors que les banques de données publiques sont suffisamment fournies en séquences nucléotidiques pour l'espèce ciblée ou, mieux, si la séquence du génome est disponible.
La transposition est en cours sur vigne, tomate et pomme de terre à l'INRA d'Angers, en partenariat avec les équipes INRA travaillant sur ces espèces (Dijon, Bordeaux, Rennes, Antibes, Avignon). Elles sont réunies dans le réseau scientifique INDRES (pour INDuction de RESistance) créé en 2010 par l'INRA autour de la problématique SDP. Arvalis-Institut du Végétal apporte son soutien au projet pour la pomme de terre.
Pommier, transfert à Végépolys réalisé
Depuis le 1er janvier 2013, le savoir-faire « pommier » et la licence d'exploitation du brevet sont transférés au Centre d'innovation de transfert de technologie du pôle de compétitivité Végépolys (www.vegepolys.eu) pour mise en œuvre dans leur service « Solutions innovantes en protection des cultures ».
Ce nouveau service s'adresse aux entreprises développant des produits destinés à la protection des plantes ainsi qu'aux autres acteurs des filières agricoles, notamment arboricole. Il propose des tests en routine sur pommier pour évaluer l'efficacité de produits vis-à-vis du feu bactérien et de la tavelure et déterminer leur mode d'action : stimulation de défenses (via la qPFD) et/ou action biocide vis-à-vis d'E. amylovora et V. inaequalis.
Autres travaux en cours
L'INRA d'Angers poursuit ses travaux sur les SDP et le pommier pour répondre aux nombreuses questions de recherche subsistant autour de l'utilisation pratique de ces produits sur le terrain. L'implication des conditions environnementales sur la réactivité des arbres en verger reste peu connue, de même que l'effet variétal, la durée d'action des produits, les interactions possibles avec d'autres intrants... Répondre à ces questions devrait permettre de mieux intégrer les SDP dans les itinéraires techniques pour leur assurer une efficacité pratique significative et reproductible, objectif qu'ils n'atteignent hélas pas encore vraiment à l'heure actuelle.
La création en 2011 du réseau national RMT Elicitra (http://www.elicitra.org) rassemblant recherche académique (dont le réseau INDRES), centres et instituts techniques, stations expérimentales, professionnels du développement agricole et pôles de compétitivité démontre la mobilisation des acteurs des différentes filières sur la problématique SDP.
Fig. 1 : Quatre étapes pour la qPFD.
Méthodologie pratiquée en routine pour le criblage de SDP sur plantules.
Les SDP, quelle offre ?
L'offre actuelle en produits revendiquant ou suggérant dans leur mode d'action une stimulation des défenses est abondante. Elle est aussi très hétéroclite, dans leur nature et aussi du fait de l'absence d'une classification réglementaire claire. On trouve en effet ces produits dans les catégories « substances phytopharmaceutiques » ou « substances fertilisantes ».
Malgré cette offre diversifiée, il faut constater que, à quelques exceptions près, les SDP n'ont pas encore fait la preuve de leur intérêt pratique en protection des plantes. Pourtant les bases scientifiques de leur usage potentiel sont solides et bien établies.
Fig. 2 : 11 candidats testés par qPFD.
Carte de densité de l'expression relative des 28 gènes de défense de la qPFD dans des plantules de pommier après traitement avec 11 SDP candidats par rapport à des plantules traitées à l'eau. Les trois expériences présentées correspondent aux trois colonnes pour chaque temps de prélèvement (J1, J2 et J3).
Fig. 3 : 11 candidats testés face au feu bactérien.
Protection de plantules de pommier contre le feu bactérien par les onze SDP candidats, comparés à l'eau et à la streptomycine, trois semaines après inoculation avec E. amylovora. Moyenne des trois répétitions d'expérience.

 Imprimer
Imprimer