Dans la première moitié des années 2000 (Grosman et al., 2005, Grosman et al., 2006, Kuntzmann 2006), une recrudescence parfois préoccupante du bois noir a été observée dans la plupart des vignobles français.
Elle a conduit à mettre en place différents suivis pour tenter de comprendre les phénomènes et de mieux lutter contre cette maladie.
Les principaux résultats acquis sont résumés ici.
Expression des symptômes de bois noir
Type de parcelles suivies
Les symptômes ont été suivis durant plusieurs années sur les mêmes parcelles. La plupart d'entre elles ont été intégrées dans un réseau d'observation en raison de l'apparition et du développement de la maladie. Certaines ont été suivies à partir de la deuxième ou troisième année après plantation, quelques-unes l'année de la plantation, la plupart étaient déjà en production quand la maladie a été signalée.
Certaines parcelles font l'objet d'observations concernant le vecteur du bois noir Hyalesthes obsoletus (piégeages, recherche du vecteur sur les plantes-hôtes).
Régions, années, cépage...
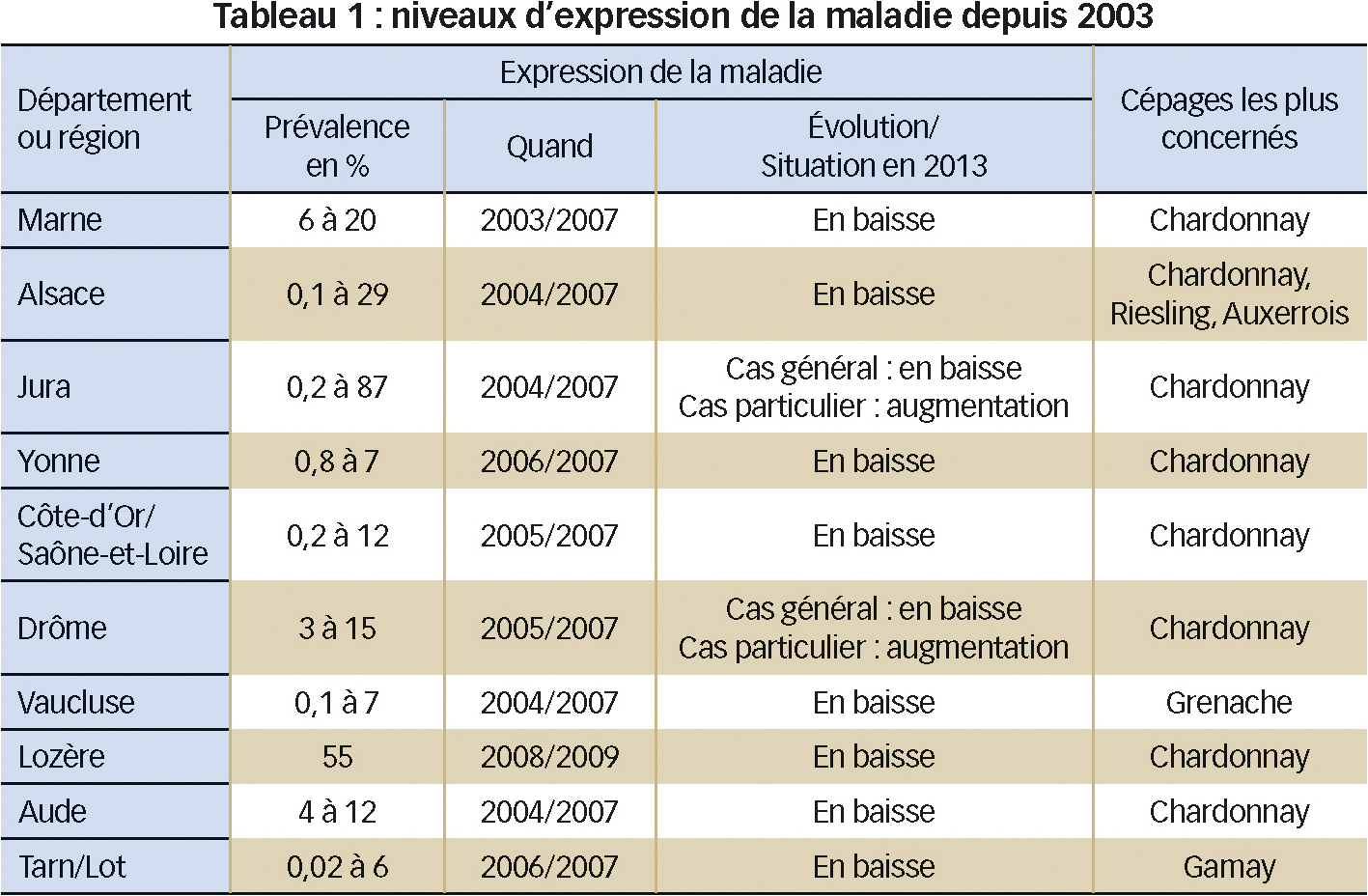
Les niveaux de prévalence les plus élevés ont été observés dans le nord-est de la France (Jura, Alsace, Marne : 20 à 30 %, voire près de 90 % dans le Jura) mais des cas de parcelles très atteintes ont été trouvés dans la partie sud (Lozère, Drôme).
Les niveaux d'expression sont les plus élevs (Tableau 1) au début des suivis, au milieu des années 2000. Sauf exception (Jura, Drôme), ils baissent ensuite, notamment sur les parcelles très atteintes au départ.
Le chardonnay est le principal cépage atteint. Dans la Drôme, une parcelle de chardonnay a été partiellement surgreffée en muscat à petit grain : aucun symptôme n'a été noté sur ce dernier cépage. En Côte-d'Or les symptômes, assez rares sur vignes adultes, touchent plutôt des vignes jeunes.
Quels liens avec l'ortie et le liseron ?
À l'instar des données bibliographiques (Kuntzmann et al., 2007, Sinn 2007, Mori et al., 2008, Kessler et al., 2010), un lien évident se montre parfois entre les foyers d'orties hébergeant le vecteur dans ou hors des parcelles et la maladie. Cette dernière s'exprime alors aussi sous forme de foyers recouvrant ou jouxtant ceux de l'ortie (Alsace, Marne, Drôme-site de Chantemerle). Dans le cas d'insectes hébergés par le liseron des champs, la répartition de la maladie est aléatoire (Vaucluse, Tarn, Drôme, Lozère), mais la prise en compte de l'expression sur plusieurs années peut aussi faire apparaître des foyers, par exemple dans l'Aude.
Les systèmes épidémiques impliqués dans les vignobles
Deux plantes-hôtes principales, deux isolats de l'agent
Les deux principales plantes-hôtes du vecteur du bois noir Hyalesthes obsoletus en France sont l'ortie dioïque Urtica dioica (Kuntzmann 2006) et le liseron des champs Convolvulus arvensis (Sforza et al., 1998, Kuntzmann et al., 2008a).
Pour aider à déterminer le système épidémique d'un vignoble ou d'une parcelle, l'étude du gène tuf du stolbur peut être un marqueur utile, car il est associé en Europe occidentale à la plante-hôte du vecteur (Langer et Maixner 2004). Le type tuf-a est exclusivement associé à l'ortie dioïque et le type tuf-b principalement au liseron des champs, mais peut aussi se trouver dans d'autres plantes (Maixner 2011).
Pour cela, des analyses spécifiques ont été réalisées sur des échantillons de vigne et sur des lots de vecteur prélevés par aspiration directement sur les plantes-hôtes ou obtenus par piégeage (pièges jaunes englués). Les résultats sont détaillés dans la synthèse nationale (voir « Pour en savoir plus », p. 36).
Deux systèmes épidémiques
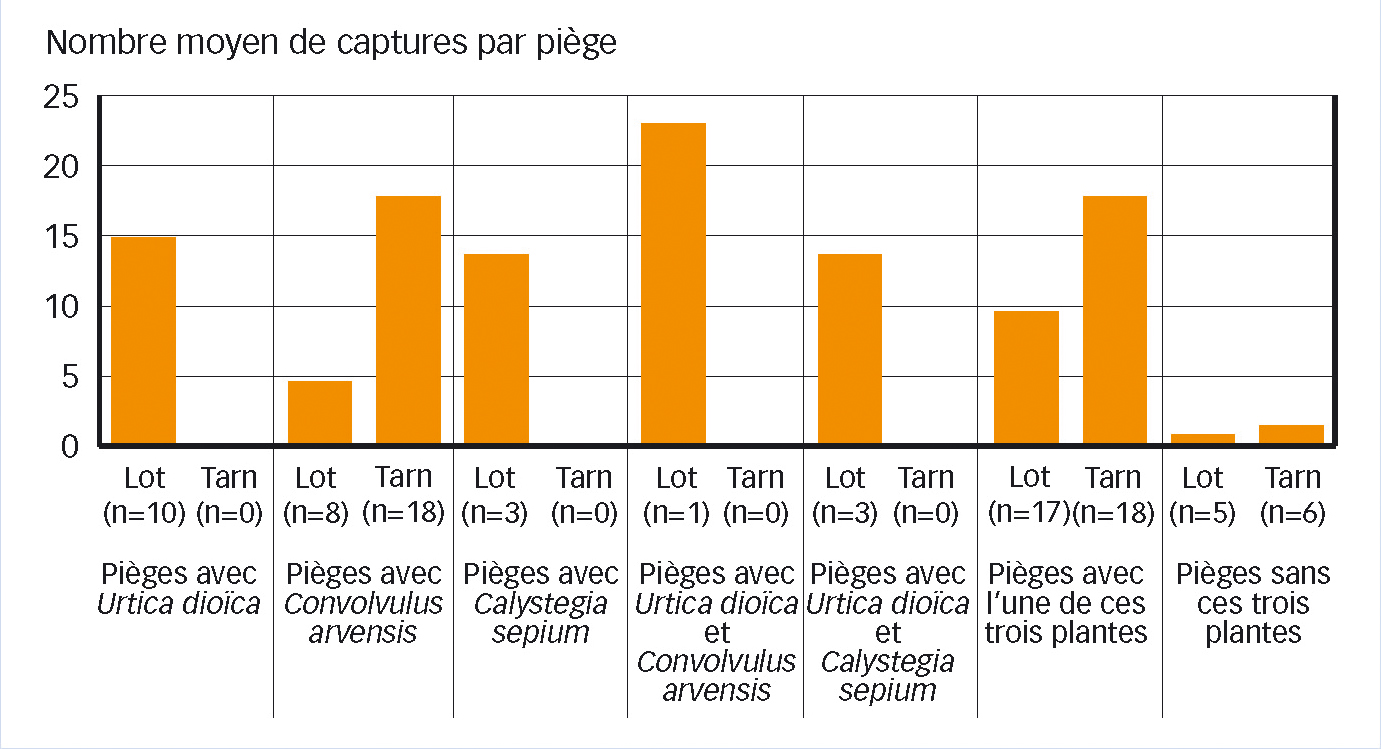
Leur interprétation est délicate. Cependant, le croisement des données entre les résultats de typage, les aspirations ciblées sur plantes-hôtes, l'environnement botanique des pièges jaunes englués (voir Figure 1), avec en complément la recherche des stades larvaires sur les plantes-hôtes, permet de tenter de caractériser le système épidémique dans chaque vignoble.
Ainsi, la Figure 1 montre les différences de niveau de capture d'adultes par piège induites par la nature de la plante-hôte à proximité, dans deux départements où cette dernière semble différente : ortie dioïque pour le Lot et liseron des champs pour le Tarn. À noter aussi que la présence de l'une de ces trois plantes augmente le niveau de capture par rapport aux pièges éloignés d'elles (partie droite de la figure).
Globalement, les systèmes épidémiques peuvent être caractérisés de la manière suivante :
– des systèmes a priori simples en Alsace et en Lozère, avec respectivement l'ortie et le liseron des champs comme plante-hôte ;
– des systèmes plus complexes ailleurs, où les effets des deux plantes coexistent à divers degrés.
Dans la plupart des systèmes complexes, l'influence du liseron des champs semble dominer celle de l'ortie, sauf cas identifiés où l'ortie abonde et peut aussi intervenir dans le Lot, le Jura, la Marne et à moindre degré la Drôme, la Côte-d'Or et l'Yonne.
Côté vecteur : la question des races et le taux d'infection
En fait, il est établi qu'une race de vecteur spécifique spécialisée sur ortie est présente en Alsace, en Allemagne et dans le nord de la Suisse. Cela permet d'expliquer la dissémination rapide du génotype tuf-a dans ces régions (Johannesen et al., 2008, Maniyar et al., 2013), alors que dans le reste de la France et dans le centre/sud ouest de la Suisse le vecteur peut utiliser indifféremment le liseron des champs ou l'ortie dioïque (Johannesen et al., 2012).
Les taux d'infection estimés des populations adultes correspondantes, variables selon les années (effet de l'échantillonnage), sont en général plutôt élevés : de 45 % à près de 70 %.
Cela s'explique par la durée de la vie larvaire du vecteur. Elle est assez longue pour que l'insecte puisse acquérir le phytoplasme en se nourrissant sur les racines de ses plantes-hôtes et devenir infectieux.
En Alsace des prélèvements ont montré que 25 % à près de 50 % des larves et de 26 % à 100 % des adultes étaient déjà porteurs du phytoplasme. Mais il est impossible de savoir si tous ces adultes étaient infectieux ou seulement infectés, à cause du temps de latence nécessaire au phytoplasme pour atteindre les glandes salivaires.
Activité de vol du vecteur
Suivie par piégeage du vecteur Hyalesthes obsoletus
L'activité de vol du vecteur a été suivie au moyen de pièges jaunes englués disposés à hauteur de la strate herbacée dans ou aux abords des vignes. Les pièges étaient soit enroulés sur un cylindre de PVC (cas général : Vaucluse, Alsace, Tarn, Lot, Marne, Yonne, Savoie, Lozère) soit fixés verticalement (Jura, Drôme, Aude).
Nous avons vérifié au préalable que les pièges de couleur jaune capturent davantage que les transparents (Alsace, Vaucluse), et que les pièges capturent plus à hauteur de la strate herbacée qu'à hauteur de la zone des grappes (Alsace, Vaucluse, Drôme, Tarn). De même, les aspirations réalisées sur vigne en Bourgogne montrent que les captures sont très faibles sur les ceps.
Résultats selon les régions
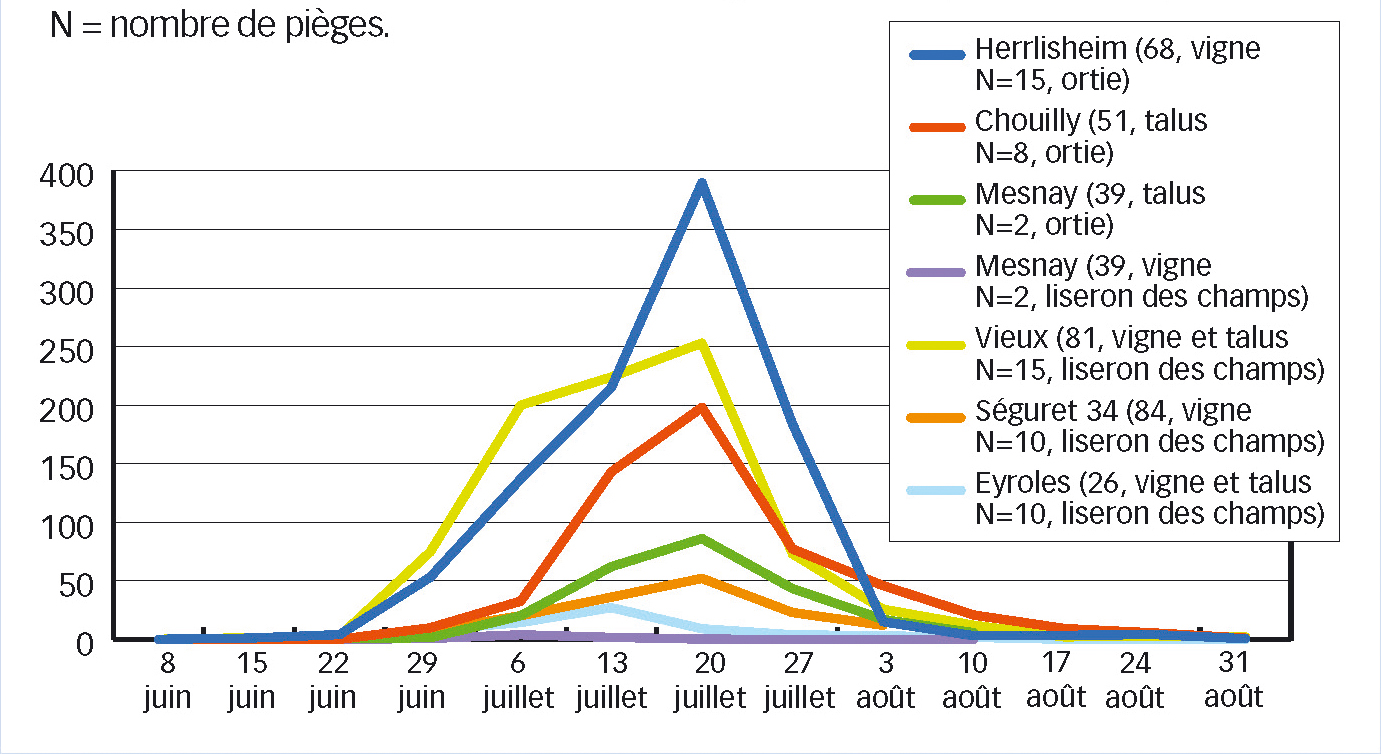
Le vol débute de fin-mai à fin-juin, selon la climatologie de l'année. Il peut exister quelques différences entre régions (voir Figure 2) et selon la plante-hôte, car les insectes effectuant leur cycle sur liseron des champs débutent le vol plus tôt que les autres. De plus, entre parcelles d'une même région, des décalages plus ou moins importants peuvent apparaître en fonction de la précocité du site liée à la topographie (altitude, exposition, pente) ou à la microtopographie (talus, muret).
Le vol dure huit à dix semaines, soit jusqu'à mi-août/fin août selon les régions et les conditions climatiques de l'été.
En général, un pic de vol assez marqué est observé. Ces pics ont lieu plus ou moins simultanément dans les différents vignobles entre le 15 et le 21 juillet.
Repérer le début du vol du vecteur
Il est possible de prévoir le début de vol du vecteur d'après un modèle degrés-jours (Maixner et Langer 2006, Maixner 2010). Les données du modèle se sont montrées assez fiables dans différentes conditions (Alsace, Jura, Tarn) mais peuvent être complétées par des observations de terrain des larves de dernier stade.
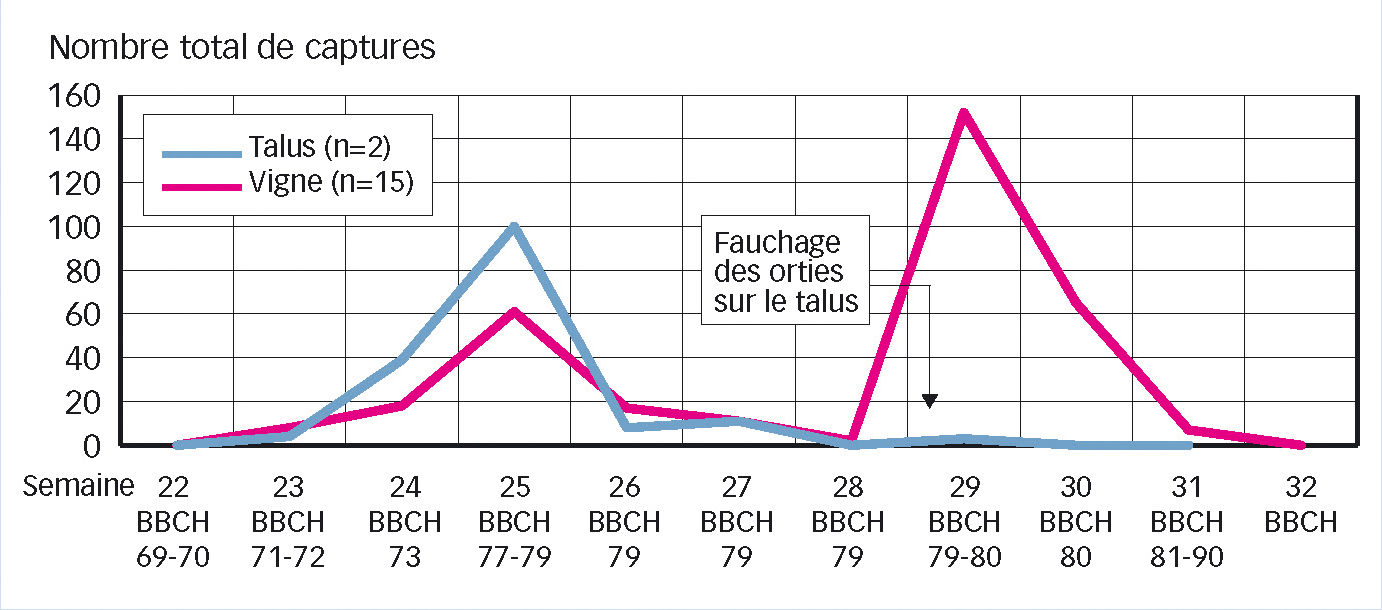
C'est utile pour indiquer la période à risque du vol de l'adulte, lors de laquelle il faut éviter d'intervenir sur le couvert végétal. En effet, comme indiqué dans la littérature (Mori et al., 2011), il est déconseillé de faucher un enherbement ou des talus hébergeant des plantes-hôtes en période de vol de l'adulte car cette fauche favorise le déplacement du vecteur.
La Figure 3 montre l'augmentation des captures liée au fauchage d'un talus avec de l'ortie hébergeant le vecteur en Alsace : un deuxième pic de vol apparaît alors que les captures étaient en baisse.
Des faits similaires (après fauche de talus à ortie) ont été constatés dans le Jura et la Drôme. De même, en présence d'ortie sur un talus extérieur à la parcelle, un gradient de captures est souvent observé de l'extérieur vers l'intérieur (Alsace, Lot).
En présence de liseron des champs, les captures sont plus aléatoires, sans différence entre le niveau de capture des pièges à l'extérieur/ bord des parcelles et ceux à l'intérieur/ cœur de parcelle (Aude, Vaucluse).
Dans l'Aude, des pièges placés en pépinières ont montré que celles-ci pouvaient être autant fréquentées par le vecteur que les vignes en production, en lien avec la présence d'ortie à proximité.
Densité de population du vecteur et cycles épidémiques de la maladie : rôle du climat ?
Ce qui a été observé
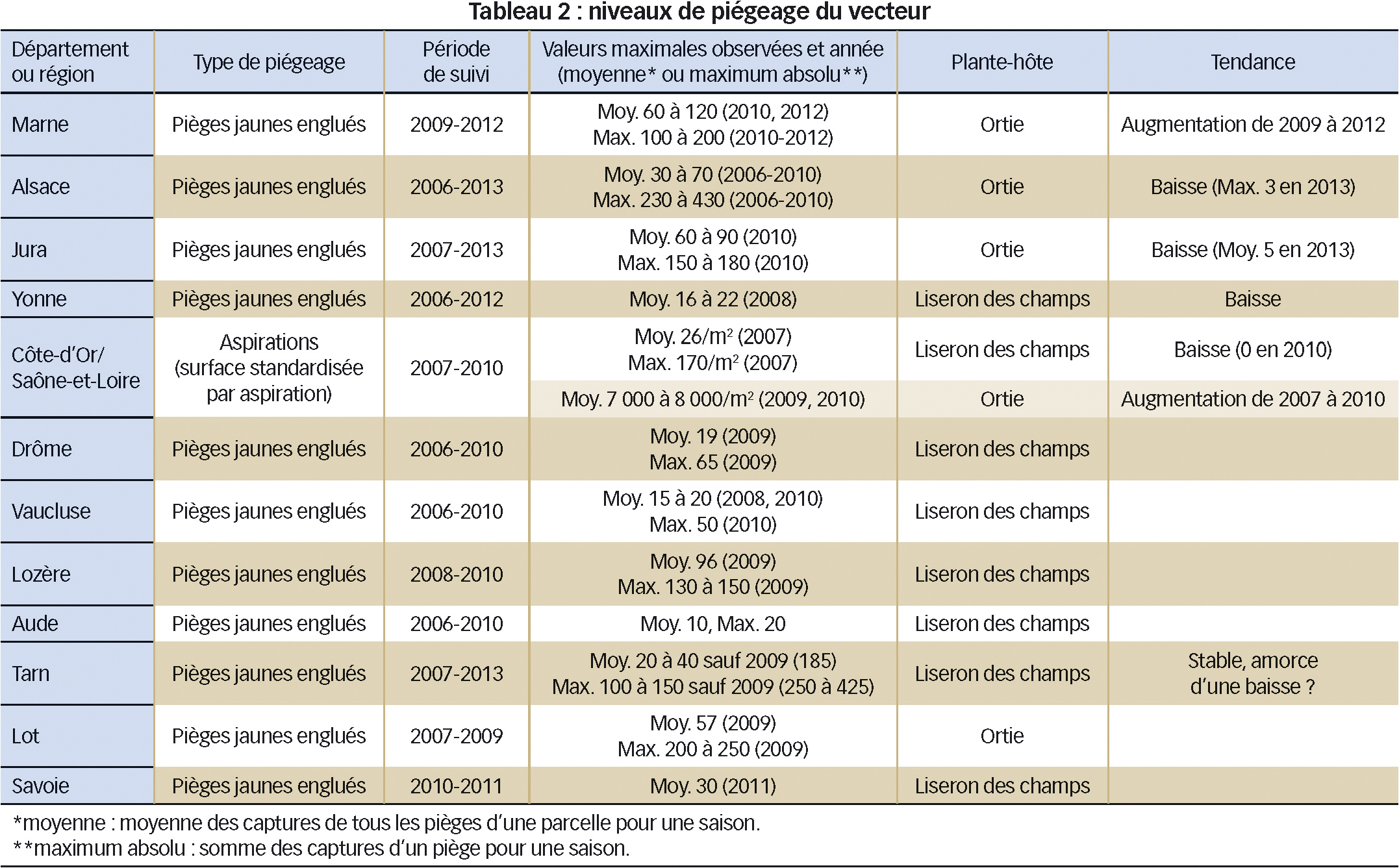
Les niveaux de piégeage varient selon les régions (Tableau 2). Les niveaux les plus élevés ont été observés, pour l'ortie : en Alsace, dans une moindre mesure dans le Jura et la Marne et ponctuellement en Côte-d'Or ; pour le liseron des champs : en Côte-d'Or, Lozère et Tarn. Dans le Jura et la Marne, une augmentation des captures en 2010 a été notée pour les vecteurs inféodés à l'ortie mais, de façon générale, sur le plan national, le niveau de captures baisse depuis 2010-2011, voire même depuis 2008-2010 dans l'Yonne et la Côte-d'Or pour ceux inféodés au liseron des champs.
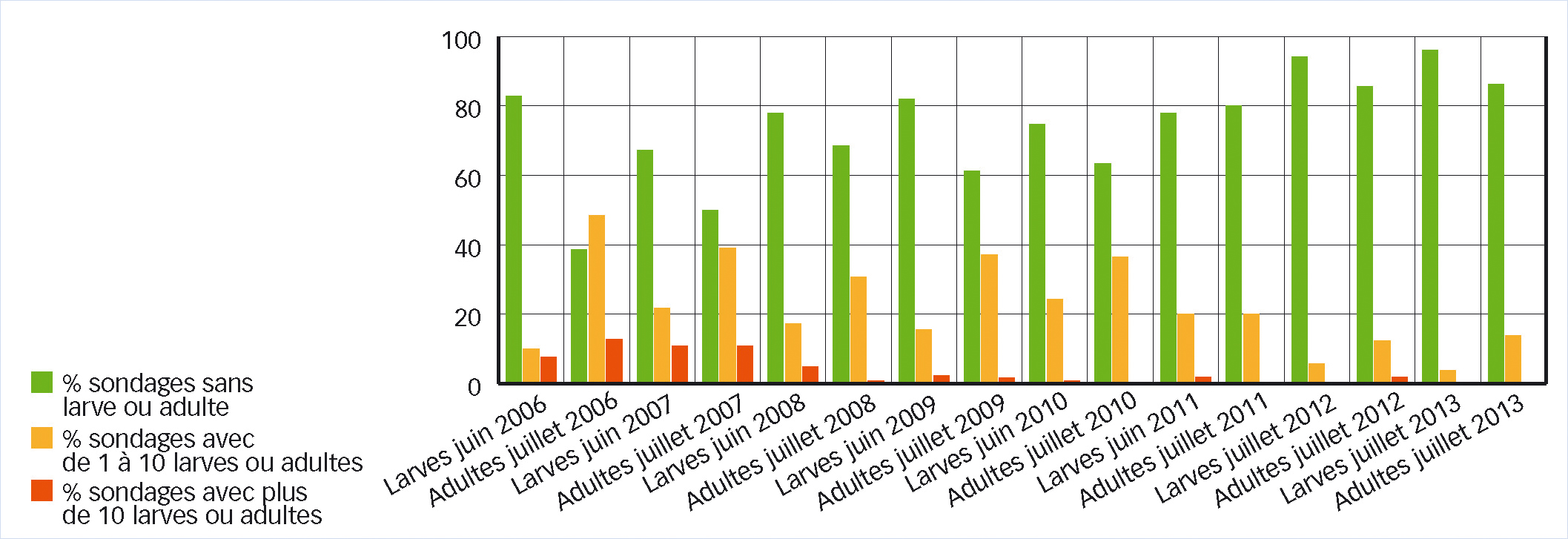
En Alsace, une baisse très nette du niveau de piégeage a été relevée en 2011 (quatre individus en moyenne par piège et par saison, au lieu de 21 à 28). Elle se poursuit en 2012 (deux individus par piège) et 2013 (moins de un individu ; voir aussi Figure 4).
Hypothèse température : peu convaincante
Il ne paraît pas pertinent d'expliquer cette baisse comme une conséquence des froids de décembre 2010 qui auraient pu éliminer une partie des larves. En effet, en 2009 il a fait un froid comparable à une période similaire, sans incidence sur le niveau de piégeage en 2010. Les conditions climatiques de l'été 2010, parfois fraîches et peu ensoleillées en août, auraient pu avoir un impact sur l'accouplement, la ponte et la viabilité des œufs, d'où la baisse des captures en 2011. Mais cet argument ne semble pas recevable non plus : des conditions similaires ont eu lieu en 2008 (mois d'août un peu frais) et 2006 (mois d'août frais, pluvieux et peu ensoleillé), sans impact l'année suivante.
L'hypothèse « précipitations » est bien plus plausible
En revanche, l'année 2011 se caractérise par de très faibles précipitations de janvier à mai. Globalement, depuis le début des années 2000, on assiste à une baisse des précipitations et de la température moyenne annuelle à Colmar.
Certes, la chute des populations du vecteur pourrait être simplement liée à la lutte contre l'ortie dans les parcelles de vigne (pièges posés presque exclusivement dans les vignes). Cependant des observations réalisées sur des massifs d'ortie hors des parcelles (Figure 4), sans aucune lutte menée contre cette plante, montrent aussi que la présence du vecteur diminue depuis le milieu des années 2000 : augmentation du nombre de massifs d'orties sans H. obsoletus et baisse du nombre de massifs fortement occupés par H. obsoletus.
Ainsi, les précipitations pourraient favoriser le développement de l'insecte, les années sèches lui étant défavorables.
Cette hypothèse peut paraître contre-intuitive pour un insecte dont les stades larvaires se déroulent dans le sol (photo ci-contre). Mais cela pourrait être cohérent en considérant l'impact des précipitations non pas sur l'insecte directement mais sur la plante par l'intermédiaire de son alimentation. Cela expliquerait les niveaux de population très élevés rencontrés sur des parcelles plantées au début des années 2000 après défrichement, donc dans des situations très favorables à l'ortie (Kuntzmann et al., 2014), et corrobore l'observation selon laquelle deux massifs d'orties fortement occupés, observés en 2012 et en 2013, se trouvaient sur des sols où coulaient des eaux de ruissellement en cas de pluie.
Enfin, Panassiti (2009) a montré que la teneur en carbone du sol était un facteur important expliquant la présence du vecteur. Ceci pourrait correspondre à l'accumulation de matière organique dont la minéralisation accrue lors d'années chaudes et humides favorise le développement de plantes types ortie ou liseron. Ainsi en 2012, année de très faibles captures pour la parcelle suivie dans le Tarn, les trois premiers mois de l'année sont très secs alors qu'en 2009, année des plus fortes captures, le début de l'année est arrosé.
Le caractère cyclique est confirmé
La nature cyclique de la maladie, avec des périodes de forte expression alternant avec des périodes d'accalmie plus ou moins longues est connue : Ravaz, en 1922, cite un dépérissement dont la description correspond à celle du bois noir, indiquant que la même maladie avait été signalée déjà vers 1908, et même avant l'invasion du phylloxera. Branas (1956) parle de la maladie du chardonnay qui touche particulièrement les vignobles de Bourgogne et de Franche-Comté à la fin des années 1940. Les données climatologiques montrent aussi des variations cycliques des précipitations en Alsace et sur d'autres stations françaises, avec des pics et des creux qui se superposent : entre 1910 et 1920 et à nouveau entre 1940 et 1950 sont observés deux pics de précipitations.
Dans beaucoup de situations septentrionales, la nature particulière des biotopes occupés par cet insecte (talus, coteaux bien exposés, sols pierreux et drainants, murets) pourrait reléguer le facteur température au second plan par rapport au facteur précipitation.
Un essai exploratoire, mené durant trois ans dans le vignoble de Gaillac sur une parcelle au sol argilo-calcaire très compact en présence de liseron des champs, semble indiquer que le travail du sol pourrait, sous certaines conditions, favoriser le développement et la présence du vecteur par rapport à un enherbement naturel, alors que le labour profond avant l'hiver est considéré comme une méthode de lutte efficace (Langer et al., 2003).
D'ailleurs, l'impact favorable de certaines formes de travail du sol est connu pour d'autres cixiides en grande culture (Bressan 2009).
Comment protéger les vignes du bois noir ?
Lutter contre le vecteur
La lutte contre le bois noir repose sur la lutte contre le vecteur, soit par le travail du sol, soit en éliminant les plantes-hôtes par l'application ciblée d'herbicides (Kast et al., 2007, Kuntzmann et al., 2008b, Bleyer et al., 2009, Maixner et al., 2010) ou la mise en place d'un enherbement (Maixner et al., 2001). Une étude de lutte contre le vecteur à l'aide du champignon Metarhizium anisopliae a été réalisée en Allemagne en conditions contrôlées (Langer et al., 2005), mais le passage au champ pose problème.
Diminuer l'expression des symptômes : une piste étudiée mais...
La lutte contre l'expression des symptômes fait partie des autres pistes étudiées. La présence du phytoplasme induit une reprogrammation du fonctionnement de la plante (Hren et al., 2009) et des modifications de la composition et du métabolisme des feuilles (Murolo et al., 2009, Schweigkoffler et al., 2008 et 2009). Mais l'application d'engrais foliaires adaptés n'a pas provoqué d'effet sur l'expression des symptômes (Schweigkoffler et al., 2009).
Sur la base d'essais en conditions contrôlées (Bressan et Purcell 2005), les éliciteurs ont été testés pour lutter contre l'expression des symptômes (Romanazzi et al., 2009b, Romanazzi et al., 2012). En Alsace, un éliciteur utilisé dans l'étude précédente a été appliqué dans trois situations différentes durant deux années consécutives pour tenter d'augmenter le taux de rémission. Mais les résultats n'ont pas été convaincants.
Des pratiques induisant un stress comme le « pulling » ou le « partial uprooting » sont citées comme permettant de favoriser la rémission, avec des résultats variables (Romanazzi et Murolo 2008, Romanazzi et al., 2009a), de même que la lutte par recépage ou adaptation de la taille (Ipach et al., 2009, Reggiani et al., 2009, Riedle-Bauer et al., 2010). Ces méthodes n'ont pas été testées en France suite à la rémission naturelle parfois importante observée (Kuntzmann et al., 2014). La diversité microbienne entre plantes saines et malades pourrait aussi expliquer la variabilité d'expression des symptômes (Bulgari et al., 2009).
Bilan : des progrès mais encore des questions
Des avancées incontestables
Dans un contexte initial de recrudescence du bois noir et en présence d'un vecteur souvent difficile à observer, cette étude a permis à ses participants de se familiariser avec les méthodes d'observation du vecteur au stade adulte ou larvaire dans ses habitats et sur ses plantes-hôtes. La mise en œuvre de protocoles de piégeage standardisés a facilité les comparaisons et évité les biais inhérents aux méthodes de capture.
Le suivi sur plusieurs années a permis d'indiquer que l'intensité des captures peut varier très fortement en l'espace de deux à trois années seulement. De ce fait, un faible niveau de capture ou l'absence de populations notables du vecteur une année donnée sur une parcelle donnée très atteinte par le bois noir ne permet pas de mettre H. obsoletus hors de cause et d'attribuer la vection à un autre vecteur.
La caractérisation des systèmes épidémiques permet d'orienter les méthodes de lutte. Lorsque le système épidémique repose sur l'ortie, la gestion de la maladie se complique car la source du vecteur peut se situer à l'extérieur de la parcelle. D'un autre côté, cela limite dans certains cas les risques pour la parcelle.
Restent des inconnues
La relation entre l'évolution temporelle des captures et celle de la maladie n'est pas claire. Ces différences restent inexpliquées, même en prenant soin de ne considérer que les « nouvelles » contaminations de pieds. Cela est lié au temps d'incubation du phytoplasme dans la plante et à des phénomènes complexes de rémission et de recontamination, spécifiques à la fois du cépage, du vecteur et du pathogène.
Les avancées en matière de lutte contre l'expression des symptômes ne sont pas très significatives. Elles passent par une amélioration préalable des connaissances sur le phytoplasme, le comportement alimentaire du vecteur, leurs interactions et les interactions vigne/plantes-hôtes ou réservoir. Pour la flavescence dorée, le matériel végétal est une source clairement identifiée de contaminations. Pour le bois noir, ce risque avait été qualifié de faible (Osler et al., 1997, Stark-Urnau et al., 2009), mais différents indices indiquent un risque réel. En effet la présence avérée du vecteur à proximité de pépinières (Alsace, Aude) ou de vignes mères de porte-greffe (Vaucluse) et la contamination des vignes mères de greffons pourraient suggérer que le phytoplasme puisse être introduit dans le circuit de production du matériel végétal par l'intermédiaire des greffons ou des portegreffes. En Bourgogne, des niveaux élevés de populations de l'insecte vecteur dans de jeunes parcelles en l'absence quasi totale d'expression de symptômes ont alimenté le débat autour de la question, alors qu'en parallèle des symptômes ont été observés sur de très jeunes vignes avec des populations de vecteur très faibles. Les essais mis en place en Bourgogne et en Alsace et s'intéressant à la propagation via les greffons n'ont pas permis d'apporter une réponse définitive : malgré la mortalité en pépinière de quelques plants positifs au phytoplasme, la plupart des plants n'ont pas exprimé de symptômes et le phytoplasme n'y a pas été détecté. La transmission du stolbur par les racines par le biais des larves à la recherche de leur plante-hôte après une préparation du sol à la plantation pourrait-elle expliquer certaines situations rencontrées en Bourgogne ? Aucune étude ne s'est intéressée à cet aspect mais il existe des cixiides adaptés aux rotations des cultures et pouvant passer d'une culture à l'autre au stade larvaire (Bressan et al., 2009).
Alors que la filière lavandicole investit encore fortement sur la recherche au sujet du stolbur, le projet pour la filière viticole s'arrête. Certes, la phase épidémique semble derrière nous... Mais les sujets de recherche sur le bois noir de la vigne et son phytoplasme ne manquent pas pour se préparer à la prochaine épidémie.
Fig. 1 : Niveau de piégeage et environnement floristique
Exemples en 2007 dans le Lot (3 parcelles) et le Tarn (2 parcelles).
n = nombre de pièges. Urtica dioica = ortie dioïque. Convolvulus arvensis = liseron des champs. Calystegia sepium = liseron des haies
Fig. 2 : Courbes de vol du vecteur dans différents vignobles en 2010
Sept courbes de vol (dont une quasi plate) pour six départements, qui montrent que les dates des débuts de vol diffèrent davantage entre elles que celles des pics de vol. N = nombre de pièges.
1 - Bois noir de la vigne : petit rappel
Le bois noir (BN) est une maladie décrite formellement en France par Caudwell (1961), reprenant le nom de bois noir donné par les viticulteurs de Saône-et-Loire. Elle correspond à la maladie désignée sous le nom de Vergilbungskrankheit par Gärtel (1965), en Allemagne. Le bois noir cause des pertes de rendement, baisse la qualité du raisin produit et peut conduire à la mort du pied. L'expression des symptômes est irrégulière, avec des phénomènes de rémission des pieds malades (Caudwell 1961, Maixner 2006, Prota et Garau 2010). La sensibilité varie selon le cépage, le chardonnay étant très sensible.
L'agent responsable est le phytoplasme du stolbur des solanées (qu'il infecte notamment), dorénavant décrit comme « Candidatus Phytoplasma solani » (Quaglino et al., 2013). Il n'a été associé à la maladie du bois noir qu'en 1993 (Daire et al., 1993) à la suite de plusieurs années de travail et de mise au point de méthodes de diagnostics spécifiques à l'Inra de Dijon (Caudwell 2008). Le phytoplasme se multiplie dans le phloème de la vigne.
En France, il est transmis accidentellement à la vigne par le cixiide Hyalesthes obsoletus. Le rôle de cet insecte originaire du Proche-Orient dans la transmission du BN à la vigne a été démontré d'abord en Allemagne (Maixner 1994), puis en France (Sforza et al., 1998). En Serbie, un autre cixiide, Reptalus panzeri, transmet aussi la maladie (Curkovic et al., 2014). Les cinq stades larvaires se déroulent sur les racines ou tiges souterraines de ses plantes-hôtes (ortie et liseron, notamment), de septembre à juin de l'année suivante (Sforza et al., 1999).
Fig. 3 : Influence des opérations culturales sur le vol
Exemple à Herrlisheim (Haut-Rhin), en 2007. Quand le talus envahi d'ortie a été fauché, les vecteurs, qui étaient pourtant discrets depuis 15 jours dans les pièges placés dans la vigne et sur le talus, se sont reportés sur la vigne (second pic de vol). n = nombre de pièges.
Fig. 4 : Suivi du vecteur : sept ans de régression
Suivi du vecteur sur l'ortie, sa plante-hôte dans le secteur de Turckheim (Alsace), de juin 2006 à juillet 2013. On a compté les larves à la base des tiges d'ortie puis les adultes également sur les tiges d'ortie. La régression des populations est visible.
POUR EN SAVOIR PLUS
AUTEURS : (1)P. KUNTZMANN, IFV Pôle Alsace - Biopole. 28, rue de Herrlisheim 68000 Colmar.
(2)X. FOISSAC, Inra UMR 1332 Biologie du fruit et pathologie. 33140 Villenave-d'Ornon.
(3)I. BECCAVIN, IFV Pôle Matériel végétal - Domaine de l'Espiguette 30240 Le Grau-du-Roi.
(4)C. CHAMBIN, Fredon Bourgogne, 21, rue J.-B. Gambut 21200 Beaune.
(5)S. CHOLOUX, Chambre d'agriculture de l'Yonne, 14 bis, rue Guynemer 89015 Auxerre Cedex.
(6)M. COARER, IFV Pôle Val de Loire. Château de la Frémoire 44120 Vertou.
(7)G. DELORME, Chambre d'agriculture du Jura. 455, rue du Colonel de Casteljau 39016 Lons-le-Saunier.
8)I. MEJEAN, Chambre d'agriculture de la Drôme - ZI sud. avenue de Gournier 26200 Montélimar.
(9)B. MOLOT, IFV Pôle Rhône Méditerranée. Domaine de Donadille 30230 Rodilhan.
(10)F. MOUROT, FDGDON Savoie. 40, rue du Terraillet, 73190 Saint-Badolph.
(11)I. RENARD, Chambre d'agriculture de la Marne. 17, rue Jean-Chandon-Moët 51200 Epernay.
(12)E. ROUCHAUD, Chambre d'agriculture de l'Aude - zone d'activité de Sautès à Trèbes 11878 Carcassonne.
(13)P. SAVARIT, Fredon PACA, Quartier Cantarel, BP 162 84147 Montfavet Cedex.
(14)V. VIGUES, IFV Pôle Sud Ouest, V'Innopôle, BP 22, Brames-Aïgues 81310 Lisle-sur-Tarn.
CONTACTS : claudia.renel@vignevin.com ph.kuntzmann@vitisphere-alsace.com
VERSION INTEGRALE AVEC BIBLIOGRAPHIE : La version intégrale de cet article (synthèse nationale bois noir), avec sa bibliographie (55 références), huit figures non montrées ici et le texte intégral, est disponible auprès de P. Kuntzmann (contact ci-dessus).
Le Point de vue de
FINANCEMENTS : Casdar, FranceAgriMer, Civa, Contrats de plan État-Région.
REMERCIEMENTS aux viticulteurs propriétaires des parcelles suivies et au nombreux stagiaires et autres personnels temporaires ou permanents ayant participé aux observations.

 Imprimer
Imprimer