La jaunisse nanisante de l'orge (JNO)est une maladie qui touche chaque année une proportion significative d'hectares de céréales à paille. Les impacts les plus importants sont rencontrés sur l'orge d'hiver, mais toutes les céréales à paille peuvent être affectées.
Ce que l'on sait sur la JNO
Le virus responsable
La jaunisse nanisante de l'orge (en anglais BYDV : barley yellow dwarf virus) est provoquée par un virus de la famille des Luteoviridae dont il est le plus célèbre représentant. Les lutéovirus sont des phytovirus obligatoirement transmis par les pucerons. Ils tiennent leur nom du latin luteus (« jaune ») du fait du jaunissement des plantes infectées.
La transmission du virus se fait de manière persistante. Cela signifie que le puceron acquiert et transmet le virus lors de piqûres d'alimentation prolongées sur des graminées infectées. Le virus, une fois absorbé, doit réaliser un cycle dans le corps de l'insecte avant de pouvoir être transmis à une plante saine ; on parle de virus circulant. Dès qu'un puceron est virulifère, il le restera plusieurs jours, voire sa vie entière.
Dans le cas des pucerons vecteurs de la JNO, ils doivent rester 24 à 72 heures sur une plante infectée pour acquérir le virus (Gray et al., 1991). Ensuite, la même durée d'alimentation est nécessaire pour transmettre le virus à une plante saine.
Une fois injecté à la plante via la salive du puceron, le virus migre jusqu'à atteindre les racines dans lesquelles il se multipliera (Ibriz et al., 1993).
Symptômes et dégâts
La présence du virus dans la plante peut engendrer différents symptômes en fonction de l'espèce-hôte. Concernant l'orge, les principaux symptômes sont le nanisme de la plante et le jaunissement des feuilles (photo 1). Sur blé, ils sont beaucoup moins marqués. C'est au stade « dernière feuille » que les symptômes seront le plus visible, la dernière feuille prenant une couleur « lie-de-vin » caractéristique (photo 2).
Ces symptômes s'expliqueraient d'une part par la présence de particules virales et la production de calloses(1) dans les tubes phloémiques, ce qui provoquerait des flux de sève réduits et, d'autre part, par des dérèglements biochimiques qui perturberaient des fonctions telles que la photosynthèse (Ibriz et al., 1993).
Plus le virus est transmis à un stade jeune de la plante, plus l'impact est important, engendrant des pertes qualitatives (poids spécifique et poids de mille grains faibles) et quantitatives. L'intensité de la maladie est dépendante de différents facteurs (Fabre et al., 2003) :
- pouvoir virulifère et nombre de pucerons ;
- durée d'exposition de la culture ;
- sensibilité et capacités de récupération de la culture.
Plusieurs vecteurs pour plusieurs souches
Huit souches du virus de la JNO sont identifiées dans le monde, dont trois sont présentes en France : MAV, PAV et RPV. La plus répandue est la souche PAV (Chain et al., 2005 ; Leclerq-Le Quillec et al., 1995).
En France, les trois espèces de pucerons vectrices du virus de la JNO sont : Rhopalosiphum padi, Metopolophium dirhodum et Sitobion avenae (voir Encadré 1). Toutes les souches du virus ne peuvent être transmises par tous les pucerons vecteurs. Ainsi, par exemple, la souche RPV n'est transmise que par Rhopalosiphum padi (voir tableau).
Principal vecteur à l'automne : Rhopalosiphum padi
Metopolophium dirhodum et Sitobion avenae sont rares, voire inexistants sur céréales à l'automne. Rhopalosiphum padi est le principal vecteur de la JNO à cette saison (Leclerq-Le Quillec et al., 1995) ; À l'inverse, M. dirhodum, très présent au printemps, est donc le principal vecteur du virus de la JNO à cette saison. La faible présence de S. avenae par rapport à R. padi et M. dirhodum en fait un vecteur de la JNO de moindre importance. Cependant, les trois espèces contribuent à maintenir des réservoirs de virus au printemps et en été dans des adventices graminées (ray-grass, folles avoines), voire dans le maïs.
93 % des céréales à paille semées en France étant semées à l'automne (Agreste 2015), l'essentiel de la contamination des céréales aura lieu à cette période via R. padi qui migre depuis les maïs en cours de desséchement vers les jeunes céréales.
Un vecteur qui s'adapte !
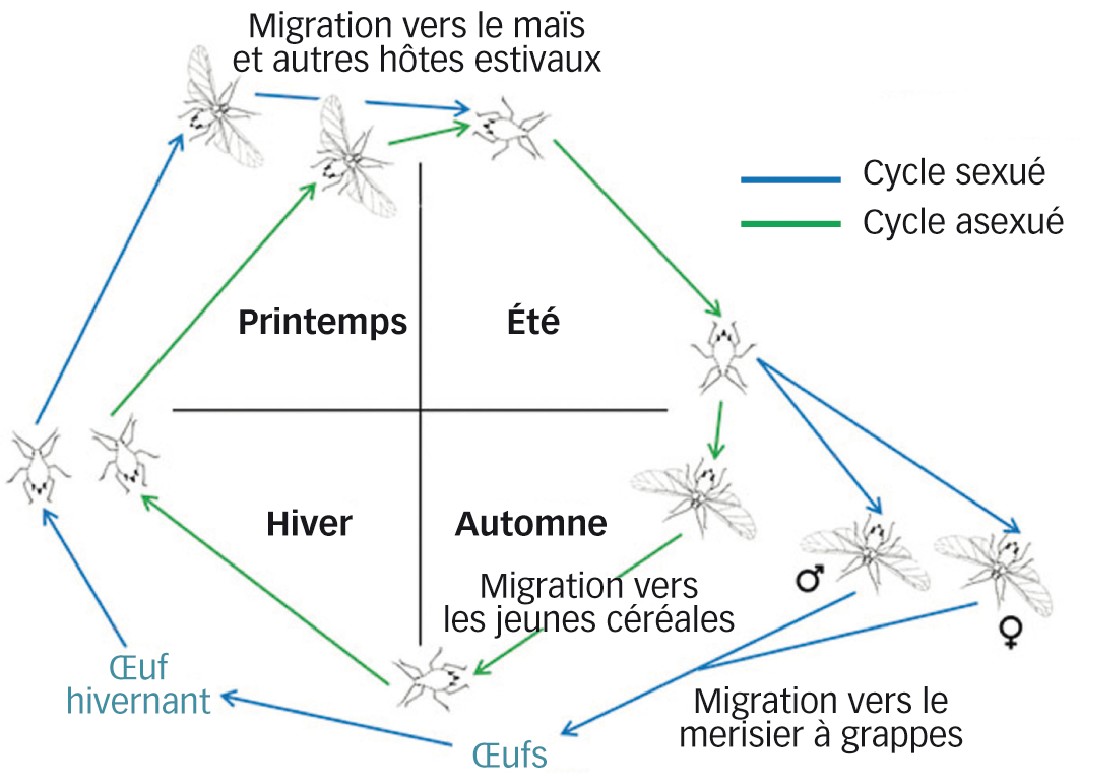
Rhopalosiphum padi (puceron du merisier à grappes) est dit anholocyclique. Autrement dit, et comme de nombreux autres pucerons, il peut se reproduire de manière sexuée (accouplement et production d'oeufs) ou asexuée (parthénogenèse, soit clonage) (Figure 1). Selon les conditions climatiques hivernales et la présence ou non de son hôte primaire le merisier à grappes (Prunus padus) (Dixon, 1971), il investit plus ou moins dans la reproduction sexuée.
Dans les régions à hiver rigoureux, R. padi investit préférentiellement dans la reproduction sexuée, les oeufs résistant au froid. Des clones sexués, produits en été, donnent naissance à des mâles et des femelles ovipares. Ces individus sexués vont ensuite migrer sur leur hôte primaire, le merisier à grappes, et ne seront pas vecteur de la JNO. Les femelles ovipares pondront des oeufs qui passeront l'hiver et donneront des femelles parthénogénétiques, lesquelles migreront sur leurs hôtes de printemps : les poacées (maïs et autres graminées) (Henry et al., 1989).
Dans les situations à hiver plus doux comme l'an dernier en France, la reproduction asexuée est privilégiée. Les femelles parthénogénétiques présentes sur les hôtes estivaux migrent vers les jeunes semis de céréales et poursuivent leur développement sur celles-ci jusqu'en été si la douceur hivernale le permet. Dans le cas contraire, elles ne survivent pas au froid (Dedryver et al., 2010).
Campagne 2015-2016
Bilan météorologique automne/hiver
Les hivers ont été relativement doux ces dernières années, particulièrement lors de la dernière campagne. En effet, l'automne et l'hiver 2015 ont vu des conditions favorables au développement, au maintien et à la survie des populations de pucerons présentes sur jeunes pousses de céréales, notamment dans la partie nord-ouest de la France. Le mois d'octobre a certes été frais (0,8 °C en dessous des normales de saison) mais novembre et décembre ont été doux avec peu de précipitations et de gelées (bilans climatiques 2015-2016, Météo-France).
Novembre 2015 est au troisième rang des mois de novembre les plus chauds depuis 1900 (2,7 °C au-dessus des normales de saison) en France. Le record est encore plus fort dans le nord-ouest où il s'agit du mois de novembre le plus chaud depuis le début des relevés (3 °C au-dessus des normales de saison). La pluviométrie a globalement été déficitaire ce mois-là.
De même, décembre 2015 est le mois le plus chaud au niveau national depuis 1900 (3,9 °C au-dessus des normales de saison et valeurs maximales jusqu'à 5 °C au-dessus des normales). Ces températures douces ont engendré un nombre de gelées très faible, notamment dans la moitié nord de la France, permettant le maintien des populations de pucerons.
Une partie de la France fortement touchée
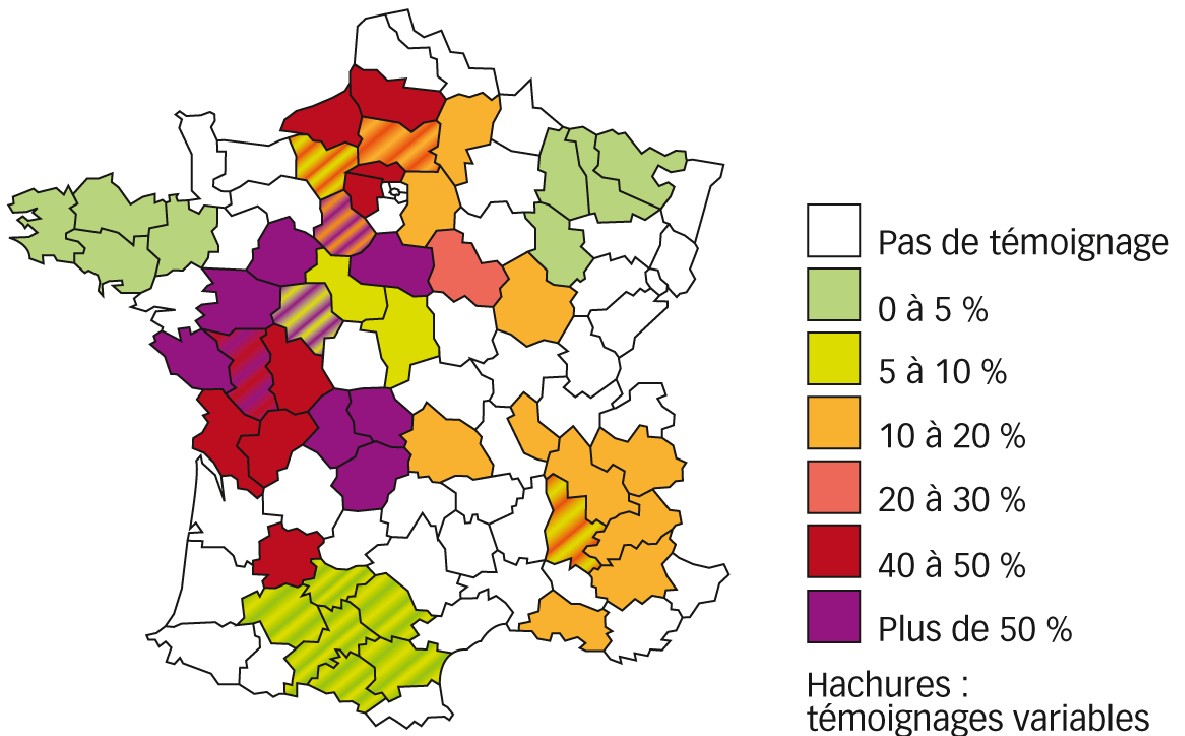
La présence de pucerons a donc été constante, engendrant des contaminations importantes. D'après le témoignage de 22 coopératives, membres du réseau d'expérimentation Santé végétale en grandes cultures d'Invivo (voir Encadré 2), les plus fortes contaminations, toutes céréales confondues, ont eu lieu dans le centre-ouest et le nord-ouest de la France, sauf en Bretagne. Ainsi, les départements du Limousin (Creuse, Corrèze et Haute-Vienne), de la Vendée, des Deux-Sèvres, de l'Eure-et-Loir et du Loiret ont été les plus touchés, avec 15 à 25 % des parcelles présentant plus de 30 % de pieds avec symptômes de JNO (voir Figure 2). La persistance des pucerons dans les cultures et l'absence de protection insecticide au semis ou en végétation peuvent dans certains cas expliquer ces contaminations importantes.
Les départements au nord de Paris ont été moyennement touchés mais avec localement des impacts très forts, par exemple dans l'Aisne où certaines parcelles ont connu des pertes de 20 à 30 quintaux/hectare sur un rendement initial de 50 q/ha. Les départements du sud-est ont été peu atteints à l'exception de la Drôme où 20 % des parcelles avaient plus de 10 % de pieds atteints. Les symptômes ont été observés tardivement, notamment sur blé. La Bretagne a été relativement épargnée, les parcelles à plus de 30 % de pieds contaminés étant des exceptions, dont moins de 1 % ont été ressemées. Le sud-ouest a été globalement peu touché, de même que le quart nord-est qui a connu moins de JNO qu'à l'accoutumée.
Les pertes de rendement sur les parcelles les plus atteintes (plus de 30 % de pieds avec symptômes) sont montées jusqu'à 30 q/ha. À l'échelle des coopératives, les pertes sont estimées entre 5 % et 35 % de la collecte selon les départements. En région Centre, l'impact sur le rendement a été estompé par l'accumulation des conditions climatiques et des événements exceptionnels de fin de cycle : excès d'eau, maladies, manque d'ensoleillement et verse.
Conditions favorables aux pucerons
Les parcelles les plus touchées sont généralement celles proches de zones de refuge des pucerons (jachères de graminées, prairies, repousses de céréales, champs de maïs qui sont les principaux hôtes estivaux de R. padi). Les parcelles les plus abritées des vents froids sont également préférées des pucerons.
Enfin, les semis précoces sont les plus exposés au risque de maladie car la probabilité que les pucerons migrent sur la culture est plus forte (Bouchet, 1981). Cependant, la présence prolongée de ces insectes dans les cultures en 2015-2016 a également engendré de fortes contaminations des semis tardifs.
Méthodes de protection disponibles
Des mesures agronomiques
Il n'existe, à ce jour, aucune méthode de lutte directe contre le virus de la JNO. Soit les méthodes de lutte utilisées limitent la présence des pucerons vecteurs du virus, soit elles tolèrent la présence du virus (variété d'orge tolérante).
La lutte contre la jaunisse nanisante de l'orge est complexe et multiple. Quelques mesures agronomiques peuvent permettre de limiter les populations de pucerons et de réduire les contaminations virales. Toutefois, en cas de conditions favorables au virus et aux vecteurs, elles ne suffiront pas à protéger la culture. Ainsi, une première mesure serait la destruction d'éventuels foyers de pucerons, comme les repousses de graminées ou de céréales.
Par ailleurs, dans l'objectif de limiter la durée d'exposition des jeunes pousses de céréales aux pucerons, il est préconisé d'éviter les semis trop précoces (début septembre/mi-octobre).
Trois leviers mobilisables
En combinaison avec les mesures agronomiques, trois leviers sont mobilisables, seuls ou combinés. Ce sont l'enrobage de semences à base d'imidaclopride (néonicotinoïde), la pulvérisation d'insecticides en végétation (surtout pyréthrinoïdes) et le semis de variétés d'orge tolérante à la JNO.
Le traitement de semences à base d'imidaclopride, de par ses propriétés systémiques, permet de lutter contre les insectes du sol (zabre, taupin) et les insectes piqueurs-suceurs (pucerons et cicadelles) du semis jusqu'à quelques semaines après celui-ci. En cas d'importantes attaques de pucerons et de semis précoce, il permet de limiter le pourcentage de surfaces virosées et de gagner en moyenne 19,5 q/ha par rapport à une orge non protégée contre les pucerons.
Cependant, en cas de fortes attaques et de maintien des populations de pucerons durant l'hiver, cette solution ne permet pas, à elle seule, de protéger intégralement la culture.
En cas de persistance des pucerons sur la culture ou d'absence de traitement de semences insecticide, le traitement en végétation peut être nécessaire. Les matières actives à la base des insecticides foliaires sont principalement de la famille des pyréthrinoïdes. Leur durée d'action est limitée à une quinzaine de jours. Il faut donc renouveler le traitement en cas de maintien des pucerons virulifères.
Ces traitements foliaires peuvent être très efficaces mais leur efficacité dépend de leur bon positionnement. Or la détection et l'observation des pucerons sont très délicates à cette période et exigent un suivi constant et poussé des parcelles.
Les variétés d'orge tolérante à la JNO permettant une protection efficace des orges ne sont pas disponibles pour l'ensemble des classes de précocité. Par ailleurs, à ce jour, il n'existe pas de variété de blé tolérante ou résistante à la JNO.
La régulation naturelle des pucerons, quant à elle, est principalement réalisée au printemps et en été. Elle est assurée par de nombreux auxiliaires : larves et adultes de coccinelles, larves de syrphe et de chrysope, hyménoptères parasitoïdes, carabes, araignées, champignons entomopathogènes... À ce jour, leur incidence globale n'a pas ou peu été évaluée.
Une interdiction qui rendra plus difficile la lutte contre la JNO en 2018
À la suite du vote de la loi pour la reconquête de la biodiversité en août 2016, tous les insecticides contenant une matière active de la famille des néonicotinoïdes seront interdits à partir du 1er septembre 2018. Une dérogation pourra être accordée à certains d'entre eux jusqu'au 1er juillet 2020. Ainsi, le traitement de semences, actuellement largement utilisé, ne pourra plus l'être en 2018. Le nombre de leviers disponibles sera réduit à deux pour les orges (insecticide végétation et variétés tolérantes) et à un seul et unique pour les blés (insecticide végétation). La lutte contre la JNO risque donc d'être plus difficile : le choix réduit rendra le succès de la protection plus aléatoire. Il en sera de même pour la lutte contre la maladie des pieds chétifs du blé transmise par des cicadelles.
L'absence de traitement de semences efficace contre les pucerons et cicadelles entraînera l'augmentation des traitements foliaires. Les modes d'action des insecticides foliaires étant peu diversifiés (essentiellement des pyréthrinoïdes), le risque de résistance de Rhopalosiphum padi aux traitements insecticides foliaires sera plus fort, à l'instar de ce qui se passe actuellement pour la grosse altise du colza.
Les méthodes actuelles de détection des pucerons sont fastidieuses à mettre en oeuvre ou ne sont pas suffisamment précises pour déclencher le traitement. En effet, l'observation directe des plantes exige, à partir d'un certain stade, « l'épluchage » de la plante pour déceler les pucerons réfugiés dans le coeur de celle-ci.
Par ailleurs, si les plaques jaunes engluées permettent de détecter les vols de pucerons et de réaliser des tests pour estimer le potentiel virulifère des pucerons piégés, elles ne permettent pas de détecter les pucerons devenus aptères qui restent sur les plantes. Il est nécessaire de développer de nouvelles techniques afin de faciliter la détection des pucerons et le déclenchement des traitements.
Enfin, la lutte génétique par variété tolérante est prometteuse mais le nombre de variétés et de mécanisme de tolérance disponibles est faible (cinq variétés). Si d'autres mécanismes de tolérance ne sont pas développés, le virus pourrait le contourner et les variétés perdraient leur tolérance.
Et pour 2016-2017 ?
Concernant la campagne en cours, aucun scénario climatique ne se dégage pour le trimestre octobre, novembre et décembre (Météo-France, 20/10/16). D'autre part, au vu des poids de mille grains faibles de cette année, la quantité d'imidaclopride par plante pour les céréales traitées avec le traitement de semences sera potentiellement plus faible. La persistance du produit pourra en être diminuée. Il faut donc être vigilant et bien surveiller les parcelles dès trois semaines après la levée.
Les conditions exceptionnelles de la campagne 2015-2016 resteront dans les annales mais le réchauffement climatique pourrait rendre ces événements de plus en plus réguliers. Il va falloir s'adapter...
(1) Glucides qui obturent les tubes phloémiques pendant l'hiver.
1 - Pucerons des céréales
Trois espèces de pucerons sont présentes sur céréales à paille en France. Leur impact est multiple : prélèvement de sève, rejet de miellat qui favorise le développement de fumagine (champignon), injection de salive parfois toxique pour la plante et transmission du virus de la JNO (Bonnemaison, 1961 ; Hulle et al., 2006).
Rhopalosiphum padi (puceron du merisier à grappes) est petit (1,5 à 2,3 mm). De forme globuleuse, il est souvent de couleur vert sombre olivâtre avec une large plage de couleur rouille à l'arrière-train. Il colonise toutes sortes de graminées. Sur céréales, il réside surtout sur feuilles et gaines.
Sitobion avenae (puceron des épis des céréales), de forme allongée, mesure de 2 à 3 mm. Sa couleur est variable, mais ses cornicules, ses antennes et ses pattes sont souvent noires. Il colonise de nombreuses poacées et est observable sur le limbe des feuilles supérieures et sur épi.
Metopolophium dirhodum (puceron des céréales et du rosier) est en général vert pâle avec une bande plus foncée sur le dos. Il ressemble par sa forme et sa taille à S. avenae mais s'en distingue par ses cornicules, antennes et pattes claires. Il colonise des graminées et des rosacées (églantier et rosier). Sur céréales, il est présent sur la face inférieure des feuilles.
Fig. 1 : Reproduction de Rhopalosiphum padi : deux cordes à son arc
Selon que l'automne-hiver est doux ou rude, c'est la parthénogenèse ou la reproduction sexuée qui sera privilégiée.
Fig. 2 : La JNO en 2015-2016
Répartition et intensité des infestations de jaunisse nanisante de l'orge sur toutes céréales d'après le témoignage de 22 coopératives membres du réseau d'expérimentation Santé végétale en grandes cultures d'InVivo.
2 - Pool technique InVivo : 40 ans d'expertise !
Une centaine de coopératives réparties sur l'ensemble du territoire national et représentant près de 50 % de la distribution des produits phytosanitaires sont regroupées par le pool technique « Santé végétale ».
Celui-ci se décline sous quatre filières : grandes cultures, vigne, arboriculture et cultures légumières. C'est un réseau d'expérimentation et une enceinte de discussions techniques, à des fins de référencement, de conseil et de prospectives.
Environ 900 essais sont mis en place tous les ans dans le cadre du pool. Ils visent à :
- évaluer des produits et leur positionnement ;
- élaborer des stratégies de contrôle ;
- évaluer les solutions alternatives.
REMERCIEMENTS
REMERCIEMENTS aux 22 coopératives ayant répondu à l'enquête sur la jaunisse nanisante de l'orge ainsi qu'à Alain Floureux (Arterris), Marc Delattre (Dijon Céréales), Joël Lorgeoux (Scael) pour leur relecture.

 Imprimer
Imprimer