Longtemps, on s'est peu inquiété des maladies du bois de la vigne, surtout l'esca. Il y avait un produit efficace, on ne sentait pas le besoin d'en savoir plus. Mais ce produit, l'arsenite de soude, a été interdit en 2001. Et les débats ont fleuri :
– sur le devenir des stocks de produits (c'est réglé) ;
– sur les causes des symptômes avec la différenciation ou non de l'esca et du BDA et le rôle des pathogènes et de l'environnement (les recherches continuent) ;
– sur les nouveaux moyens de lutte ; l'un d'eux, le Trichoderma atroviride souche I-1237, a fait parler de lui en 2008, mais est-il efficace ? Voici des résultats sur l'effet de son application en pépinières. Résultats préliminaires car des plants fabriqués en 2005 sont bien jeunes pour exprimer l'esca, mais déjà prometteurs. Voyons pourquoi.
Les maladies du bois de la vigne (Encadré 1) sont en recrudescence depuis l'interdiction de l'arsenite de soude en 2001 (Dossier Phytoma N° 609, 2007). Elles posent un problème majeur : chaque année, le nombre de ceps atteints augmenterait de 1 à 5 % selon les régions. Il en est de même dans d'autres pays : dans certains vignobles italiens, le taux de ceps malades atteindrait 20 % et la mortalité 5 % par an.
Les méthodes de lutte disponibles sont :
– les méthodes prophylactiques consistant à éliminer les bois de taille et les ceps morts ;
– le badigeonnage des plaies de taille avec un produit séchant (l'Escudo, fongicide pour badigeonner, est interdit depuis 2007) ;
– le bio-contrôle (ou lutte biologique), par traitement des plaies de taille avec une préparation dont la substance active est un micro-organisme antagoniste des champignons impliqués dans les maladies du bois (Encadré 2).
Des Trichoderma dans le monde
Les champignons appartenant au genre Trichoderma présentent des capacités antagonistes vis-à-vis d'un grand nombre d'agents pathogènes telluriques ou aériens (Pythium, Phytophthora, Rhizoctonia, Sclerotinia, Botrytis, Fusarium...) (Kubicek et Harman, 1998), et ceci sur des cultures très diverses : coton, raisin, maïs doux, laitue, vigne, oignon, pois, prune, pomme, carottes, etc.
Produit autorisé en Océanie
Dans le cas des maladies du bois de la vigne, plusieurs travaux avec des souches sélectionnées de Trichoderma ont montré une activité antagoniste efficace vis-à-vis des principaux pathogènes des maladies du bois, P. aleophilum, P. chlamydospora, Botryosphaeria obtusa, B. parva et Eutypa lata.
Ainsi, certaines préparations à base de Trichoderma de la société Agrimm sont autorisées en Australie et Nouvelle Zélande où elles ont fait l'objet d'expérimentations en pépinières depuis de nombreuses années (Harvey et Hunt, 2006 ; John et al., 2004, 2008). Selon ces auteurs, le traitement des bois avec T. harzianum permet de réduire de 85 % le développement des champignons pathogènes Botryosphaeria, Phaeomoniella et Phaeoacremonium, et les souches de Trichoderma colonisent bien le bois et persistent au delà de 20 mois. Ils ont aussi montré que cette application réduit significativement le développement d'E. lata dans les plants, aussi bien en serre qu'au vignoble (John et al., 2008 ; Hunt et al., 2001).
Travaux en Amérique, Afrique, Italie
En Californie, une équipe universitaire (Munkvold et Marois, 1993) a montré l'efficacité d'un isolat de Trichoderma viride sur certains pathogènes des bois de vigne.
En Afrique du Sud, Fourie et al. (2001) ont montré une réduction de 40 % du taux d'infection des plants par P. chlamydospora et Phaeoacremonium sp par le traitement avec une souche antagoniste de Trichoderma sp.
En Italie, une équipe de Bologne (Di Marco et Osti, 2007) a aussi obtenu des résultats satisfaisants en pépinière avec une souche de Trichoderma harzianum contre P. chlamydospora et cela jusqu'à 15 mois après inoculation de l'agent pathogène.
Tous ces résultats scientifiques sont publiés et montrent clairement que cette voie de lutte biologique est intéressante et prometteuse.
Et en France ?
En France, dans le cadre de recherches collaboratives entre la société Agrauxine et l'INRA, une équipe de l'UMR MSE de Dijon pilote depuis près de 6 ans un programme de R & D sur une souche (T1) de T. atroviride. Cette souche sélectionnée par l'INRA de Montpellier entre 1990 et 1992 pour ses bonnes capacités anti fongiques est déposée à la CNCM sous le numéro I-1237. Les études menées à l'INRA de Dijon ont permis d'identifier et confirmer l'espèce comme étant T. atroviride puis de développer un marqueur moléculaire spécifique à cette souche (Cordier et al., 2007). Les travaux ont aussi montré son innocuité sur l'environnement (Cordier et Alabouvette, 2009).
La souche I-1237 de Trichoderma est actuellement en cours d'homologation sous le nom commercial d'Esquive. Dans ce programme de recherche appliquée, un volet des travaux concerne l'évaluation de l'efficacité de la souche I-1237 contre les maladies du bois de la vigne. Ce volet est réalisé en collaboration avec les Pépinières Mercier (Mercier Novatech 85770 Le Gué de Velluire, France).
De nombreux essais ont été réalisés successivement de 2004 à 2008. Les résultats présentés ici sont une synthèse de deux essais démarrés en 2005 et 2008. Ils ont permis de montrer que la souche I-1237 de T. atroviride est non seulement capable de se maintenir dans le bois du plant de vigne mais aussi de réduire la présence de certains champignons pathogènes liés aux maladies du bois.
Travaux en France sur Trichoderma atroviride souche I-1237 : d'abord sa capacité à coloniser le bois
Protocole des deux essais
Le premier essai a été lancé en 2005 avec 8 assemblages (différents porte-greffes associés à différents cépages). Le second essai a été lancé en 2007 sur un seul assemblage (Sauvignon Blanc cl.108/Gravesac cl.264 lot N°17012447729). Les deux essais ont été conduits en serre.
En 2005 et en 2007, les plants ont été traités avec Esquive (produit contenant la souche I-1237) au moment de leur fabrication selon une technologie d'inoculation par trempage mise au point par Mercier Novatech et la société Agrauxine. Les plants ont été rempotés et mis en serre au printemps.
Les analyses de Trichoderma I-1237 ont été effectuées au laboratoire de l'UMR MSE INRA de Dijon après 3 mois de culture des plants pour le premier essai et 8 et 15 mois pour le second.
Protocole des analyses de Trichoderma dans le bois
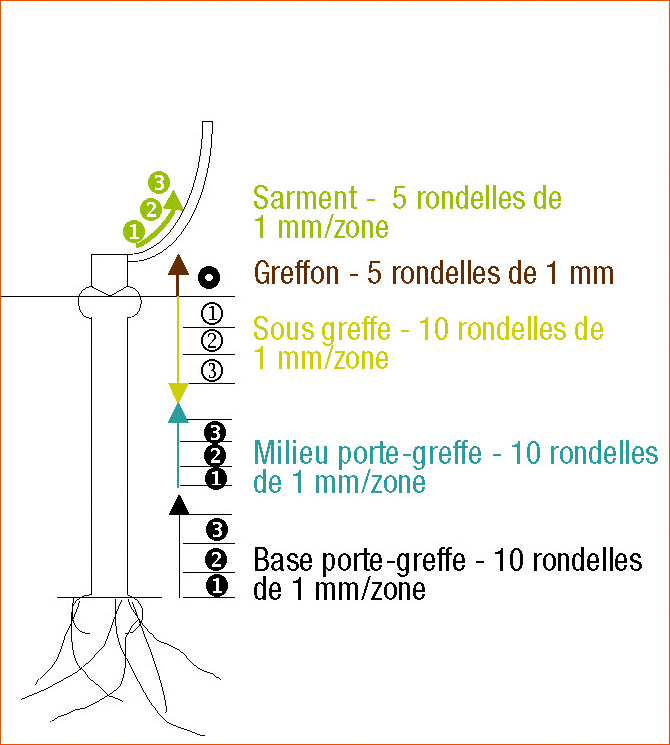
La figure 1 présente les cinq zones du plant qui sont prélevées pour le suivi de la souche I-1237, de la base du porte-greffe jusqu'au sarment. Pour chaque zone, 5 à 10 rondelles de bois sont réalisées.
Après enlèvement de l'écorce et désinfection, ces rondelles sont mises en culture sur un milieu gélosé en boîte de Petri.
On évalue le nombre de rondelles colonisées par Trichoderma I-1237, 3 jours après incubation à 25 °C.
Résultats
LA SOUCHE I-1237 TROUVÉE DANS LES PLANTS DES 8 ASSEMBLAGES 3 MOIS APRÈS TRAITEMENT
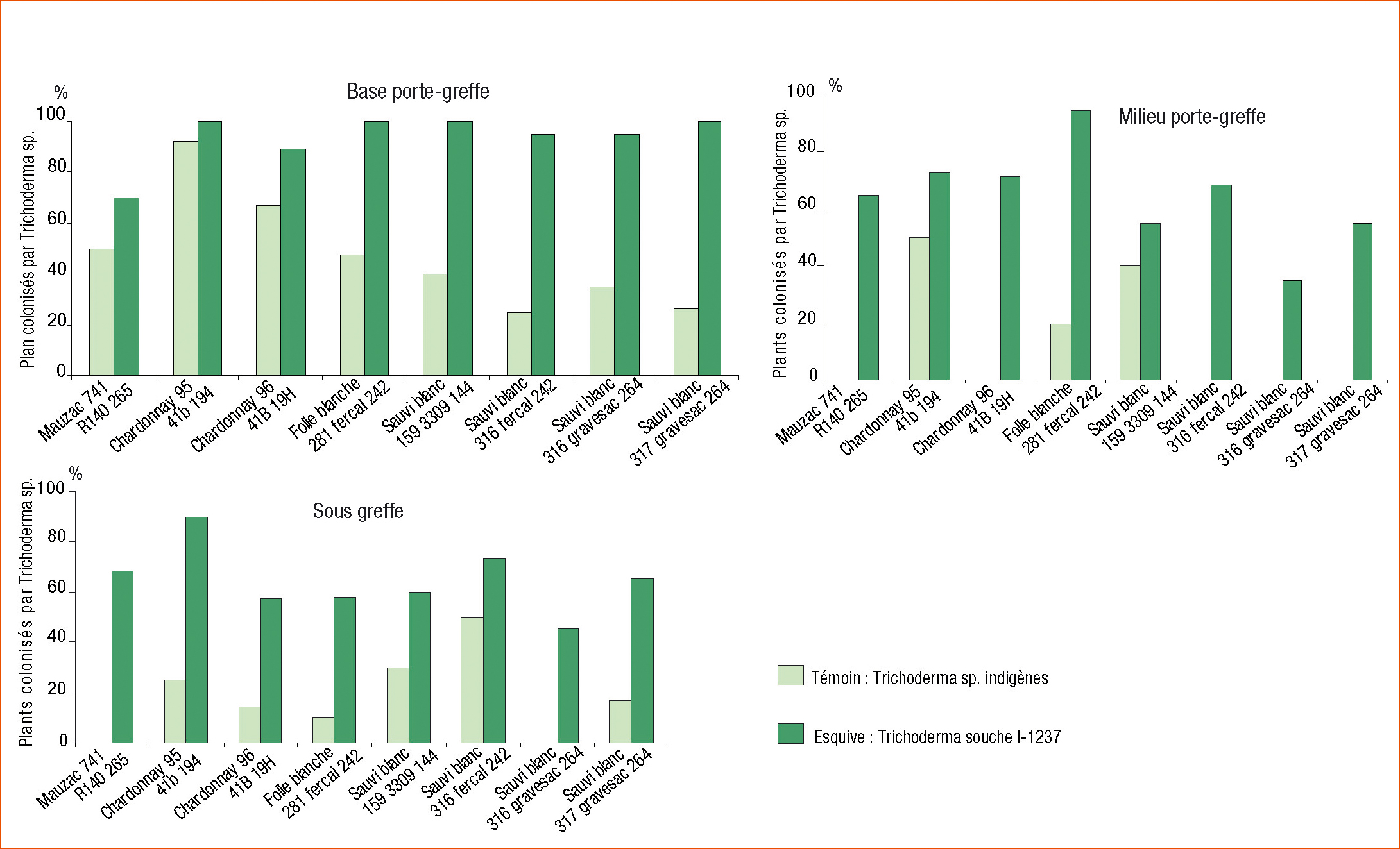
Dans les plants traités avec Esquive, la souche I-1237 est toujours retrouvée dans le porte-greffe au niveau des 3 régions analysées (Figure 2). Quel que soit l'assemblage on observe une fréquence élevée de plants colonisés par I-1237 : de 70 % à 100 % à la base, de 35 % à 95 % dans la région médiane et de 45 % à 90 % au dessous du greffon.
Les analyses des plants non traités (Témoin) montrent que le bois est colonisé par des isolats de Trichoderma sp. différents de la souche I-1237 présente dans Esquive (Figure 2). Cela montre qu'à l'état naturel, les Trichoderma sont présents dans les sols et les bois de vigne, au contraire de ce qui pu être publié à tort.
Cependant, ces Trichoderma indigènes ont une faible capacité à se développer et à persister dans le bois, comme le montrent les fréquences obtenues sous la greffe.
I-1237 DÉTECTÉE DANS UN ASSEMBLAGE DE VIGNE 15 MOIS APRÈS TRAITEMENT.
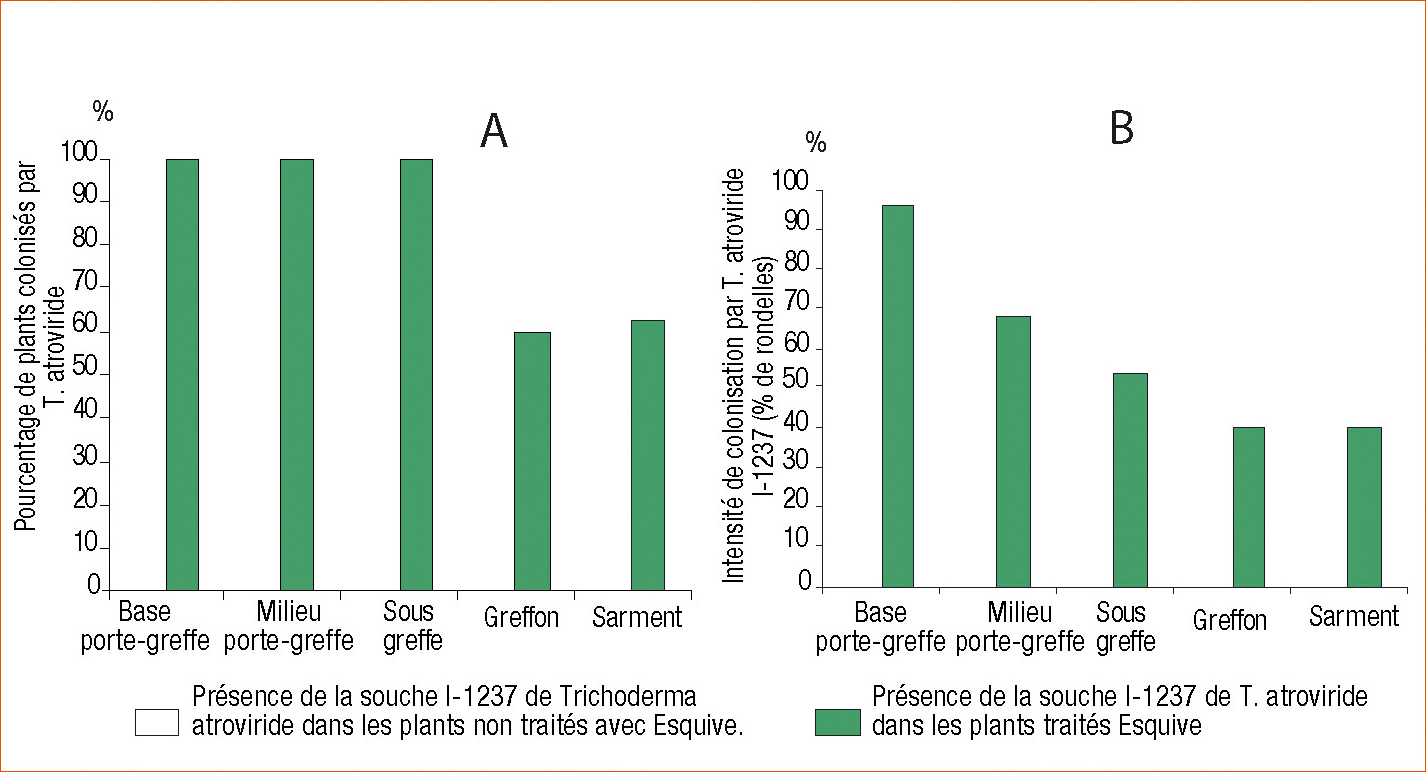
Les résultats obtenus en 2008 sur les plants inoculés en 2007 montrent clairement la capacité de la souche I-1237 à se maintenir durablement dans le bois de la vigne (Figure 3).
En effet, quinze mois après traitement, et ce quelle que soit la zone analysée (de la base du porte-greffe jusqu'au sarment), 100 % des plants sont colonisés par T. atroviride 1-1237 surtout au niveau du porte-greffe (Figure 3 A). De plus, les intensités de colonisation obtenues (de 40 % au niveau du sarment à 100 % au niveau du porte-greffe) indiquent une bonne installation de I-1237 dans chacune des zones (Figure 3 B). Ceci a permis de confirmer qu'I-1237 se développe dans les plants et persiste dans sa progression dans le sarment après le traitement par une suspension d'Esquive.
T. atroviride souche I-1237 : capacité à réduire le développement des champignons pathogènes
Il faut rappeler qu'il n'existe pas de méthode officielle pour les essais biologiques contre l'esca sur la vigne. Il a donc fallu faire preuve de pragmatisme pour réaliser les travaux tout en étant concordant avec les travaux réalisés ailleurs.
Protocole de l'essai
Dans le cadre de l'essai lancé en 2007, des jeunes plants de vigne ont été traités ou non avec la souche I-1237 (technologie d'inoculation par trempage déjà évoquée).
Ces plants préalablement inoculés ou non par le produit ont ensuite été inoculés avec l'un des 4 agents pathogènes à savoir : Botryosphaeria parva (origine ITV), B. obtusa (souche F 18-1 - origine ITV), Phaeoacremonium aleophilum (souche LR 23 - origine ITV), Phaeomoniella chlamydospora (souche 5028 - origine ITV).
Chaque champignon pathogène a été inoculé individuellement dans le porte-greffe sous forme de culture mycélienne dans un trou réalisé à 3 cm en dessous du greffon. La plaie d'inoculation est ensuite protégée avec un « pansement » (photo 1) et les plants de vigne des différentes modalités ont été mis en pot et cultivés en serre (photo 2).
Protocole des analyses de Trichoderma et des pathogènes
Le suivi de la souche I-1237 et des champignons pathogènes de la base du porte-greffe jusqu'au sarment a été réalisé selon le schéma précédemment décrit (Figure 1).
Pour chaque zone du plant, on détermine le nombre de rondelles colonisées par Trichoderma I-1237 et/ou par les pathogènes inoculés, entre 3 et 10 jours d'incubation des rondelles à 25 °C.
Une première analyse a été réalisée huit mois après inoculation d'Esquive et des champignons pathogènes, afin de confirmer leur développement. Puis une analyse a été réalisée 7 mois plus tard soit 15 mois après inoculation.
La colonisation des bois par T. atroviride I-1237 et par les champignons pathogènes est exprimée à la fois en pourcentage de plants colonisés (fréquence) et en intensité moyenne de colonisation (intensité) pour chacune des régions analysées. L'intensité moyenne de colonisation est le pourcentage de colonisation (rondelles positives) par plant ramené sur l'ensemble des plants analysés, soit 10 plants.
Résultats
Les résultats sont visibles figure 4 p. 38.
Développement des pathogènes en absence de T. atroviride I-1237
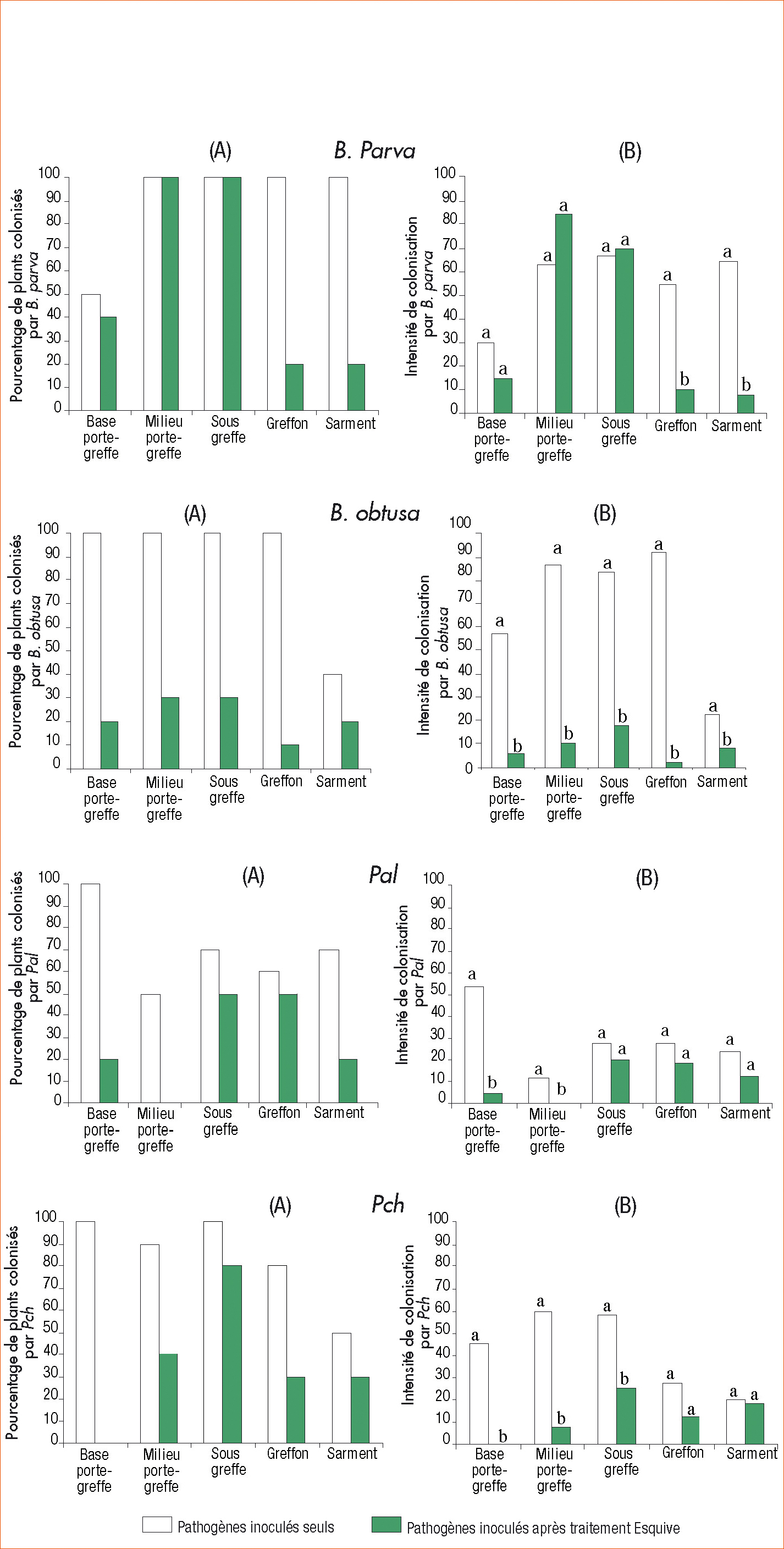
On note que les pathogènes B. parva et B. obtusa inoculés en dessous du greffon se développent intensément dans toutes les zones du plant ce qui témoigne de leur agressivité.
P. aleophilum et P. chlamydospora progressent moins intensément dans les bois au cours du temps. P. aleophilum colonise les bois avec des intensités ne dépassant pas 50 % en fonction de la zone considérée. P. chlamydospora présente une intensité de colonisation plus élevée dans le porte-greffe (40 % à 60 %) que dans le greffon et le sarment.
Développement des pathogènes en présence de T. atroviride I-1237. I
En présence d'Esquive, on note une réduction de la colonisation du bois (en terme de fréquence) par les 4 champignons pathogènes étudiés (Figure 4A).
Cette réduction est plus ou moins importante en fonction de la zone analysée. La souche I-1237 est plus efficace pour ralentir la progression de B. obtusa, B. parva et de P. aleophilum dans le bois : les réductions de fréquence peuvent atteindre 80 % ou 90 % par rapport au témoin non protégé. On note une bonne relation entre la fréquence et l'intensité de développement des pathogènes.
Chez les plants inoculés avec B. parva, le traitement réduit significativement l'intensité de colonisation du greffon et du sarment par l'agent pathogène. Ceci montre que le produit l'empêche de progresser dans les bois de l'année.
Cet effet bénéfique est encore plus marqué dans le cas de l'inoculation avec B. obtusa où la réduction d'intensité de colonisation par le pathogène est généralisée à tout le plant : porte-greffe, greffon et sarment.
Concernant P. aleophilum et P. chlamydospora, l'effet de la souche I-1237 est observé au niveau du porte-greffe, avec une réduction significative de l'intensité comprise entre 10 et 50 %.
Conclusion
Les résultats des essais conduits en France ces quatre dernières années sont prometteurs.
Les pathogènes colonisent moins
Ils montrent que l'inoculation des plants de vigne en pépinière avec la souche de T. atroviride I-1237 permet de réduire significativement la colonisation ultérieure par les agents pathogènes responsables des maladies du bois.
Ces résultats sont concordants avec ceux obtenus en Nouvelle Zélande et en Australie et encouragent à poursuivre nos efforts d'expérimentation pour démontrer l'efficacité de cette spécialité dans la lutte contre les maladies du bois de la vigne.
Produit à suivre et pathogènes à étudier
Compte tenu de l'étiologie de ces maladies, un suivi de longue durée permettra de mieux préciser les conditions et les doses d'application nécessaires à une efficacité maximale des traitements biologiques à base d'Esquive.
Il conviendra également d'assurer un suivi microbiologique annuel pour quantifier la présence à la fois des agents pathogènes et de la souche antagoniste dans les bois de la vigne. Cette approche de contrôle post application pourra être mise en place ainsi que le développement d'outils moléculaires qui pourraient avantageusement compléter les analyses microbiologiques traditionnelles basées sur des mises en culture.
L'acquisition de connaissances complémentaires sur la biologie des agents pathogènes et leur écologie dans les sols et les bois est également nécessaire pour préciser le cycle épidémiologique de ces maladies et ainsi pour mieux raisonner les méthodes de protection de la culture.
Quoiqu'il en soit, les résultats préliminaires obtenus avec la souche de Trichoderma atroviride I-1237 sont encourageants, ils vont dans le même sens que ceux obtenus dans d'autres pays et laissent entrevoir une réelle possibilité de lutte biologique efficace.
<p>* Agrauxine, adresse actuelle : INRA - UMR M.S.E. 17, rue Sully, 21000 Dijon.</p> <p>** Mercier Novatech, 85770 Le Gué-de-Velluire.</p> <p>N.B. Le « chapô » ci-dessus est de la rédaction de Phytoma.</p>
2 - Lutte biologique autorisée... contre le botrytis
Parmi les méthodes de protection des plantes contre les maladies alternatives à la lutte chimique, la lutte biologique faisant appel à des micro-organismes (bactéries ou champignons) antagonistes des agents pathogènes est encore peu utilisée. Sur vigne, quelques préparations sont homologuées dans différents pays.
En France, Sérénade, préparation à base de la bactérie B. subtilis, est autorisée pour lutter contre le botrytis comme aux USA et dans plusieurs pays européens. Deux autres produits sont autorisés contre le botrytis en Nouvelle Zélande et dans d'autres pays : BotryZen, à base d'Ulocladium oudemansii et Sentinel à base de Trichoderma atroviride.
Figure 2 -
Fréquence de colonisation du bois de la vigne par Trichoderma atroviride souche I-1237 ou par Trichoderma sp., 3 mois après traitement par une solution d'Esquive (PG : porte-greffe).
Figure 3 -
Fréquence (A) et intensité (B) de développement de la souche I-1237, 15 mois après traitement avec Esquive.
Figure 4 -
Fréquence (A) et intensité (B) de développement des différents champignons pathogènes du bois sur plants traditionnels traités ou non avec Esquive. Dans les graphes représentant les intensités, l'analyse statistique a été possible par région analysée : pour chacune, les valeurs suivies d'une même lettre ne sont pas significativement différentes.
Le Point de vue de
1 - Les maladies du bois de la vigne
Le terme générique de « maladies du bois » regroupe plusieurs maladies provoquées par divers champignons phytopathogènes : l'esca, l'eutypiose et le black dead arm (BDA).
Le champignon Eutypa lata (E.l.) est clairement associé à l'eutypiose et les symptômes causés par E. lata ont été largement décrits et sont facilement reconnaissables.
Les deux champignons Phaeomoniella chlamydospora (Pch) et Phaeoacremonium aleophilum (Pal) sont souvent « associés » à l'esca ; si l'on coupe un cep atteint, on observe sur une coupe transversale des ponctuations noires visibles pour le premier et des nécroses foncées pour le second.
Les champignons du genre Botryosphaeria (Bo) sont plutôt associés au BDA (Black Dead Arm). Ils sont souvent isolés au niveau de la bande brune présente sous l'écorce et caractéristique de cette maladie.
Fomitipora mediterranea (Fm) est responsable de la dégradation du bois en « amadou » (pourriture molle et sans consistance) trouvée dans le bois de certains ceps malades.

 Imprimer
Imprimer