En lisant « processus respiratoire », nous pensons à notre propre respiration. Mais ce processus visible a son prolongement au niveau cellulaire : la « respiration cellulaire ». C'est le même mécanisme chez tous les organismes dits eucaryotes (c'est-à-dire composés de cellules comportant des noyaux), y compris les champignons phytopathogènes. Certains fongicides attaquent ces champignons en perturbant leur respiration cellulaire. Pour cela, ils affectent une ou plusieurs étapes du processus respiratoire. Nous évoquons ici les fongicides multi-sites anciens, les unisites affectant la biodisponibilité de l'ATP et ceux de type SDHI. Un prochain article évoquera une autre grande catégorie d'unisites, les inhibiteurs du complexe III, ainsi que les phénomènes de MDR, multi-drug resistance. Tous deux complètent un article de Phytoma plus général sur les inhibiteurs respiratoires (Leroux & Delorme, 1997).
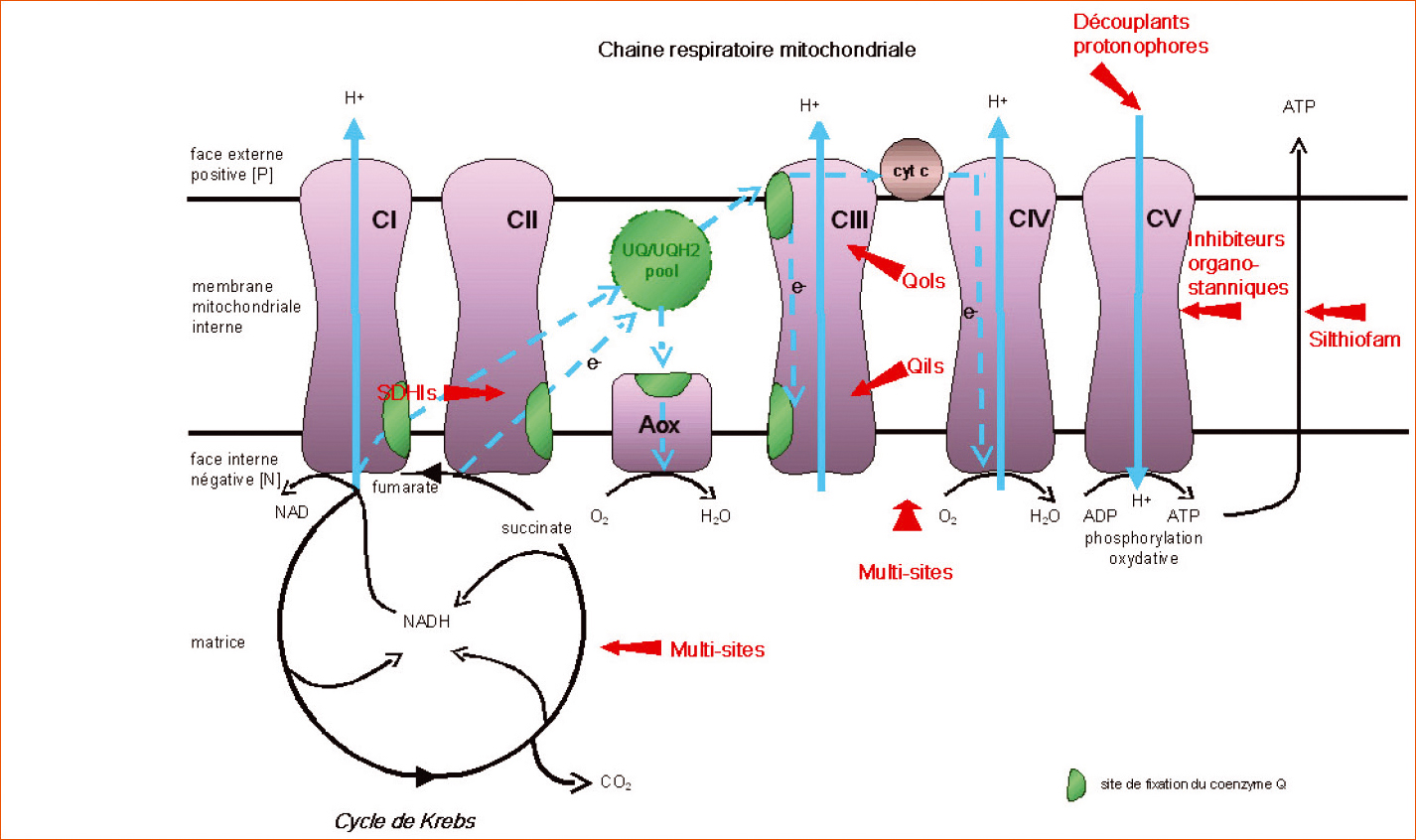
Au sein des cellules fongiques (et plus généralement chez celles des eucaryotes), les processus respiratoires, correspondant au catabolisme oxydatif de molécules organiques comme les lipides ou les glucides, génèrent de l'énergie sous forme d'ATP (Adenosine TriPhosphate). Les phases terminales s'opèrent au niveau des mitochondries via le cycle de Krebs et la chaîne respiratoire (Explications dans l'encadré p. 9). De nombreux fongicides agricoles affectent ces processus respiratoires. Ils entraînent donc une carence énergétique de cellules fongiques et en particulier des spores. Par voie de conséquence, ils présentent tous une activité préventive liée notamment à l'inhibition de la germination des spores de champignons ou l'immobilisation des zoospores des Oomycètes. Les plus anciennement utilisés sont des multisites ou des multicibles qui interagissent avec plusieurs enzymes et coenzymes respiratoires, ainsi que quelques fongicides qui interfèrent avec la formation ou le transport de l'ATP (Figure 1).
À l'inverse, d'autres substances actives, plus récentes, ont des effets spécifiques au niveau des complexes mitochondriaux II et III.
Cet article traite des fongicides multisites et des unisites inhibiteurs du complexe mitochondrial II, y compris les plus récents ou en cours de développement. Il précise lesquels sont concernés par les phénomènes de résistance.
Fongicides multisites
Les fongicides multisites les plus anciens sont des produits minéraux à base de cuivre et de soufre. Ce dernier, utilisé en poudrage ou en pulvérisation sous forme micronisée mouillable, est particulièrement efficace contre les oïdiums à des doses allant de 2 à 20 kg/ha. Quant aux produits cupriques, sous forme de sels peu hydrosolubles, ils présentent une bonne efficacité préventive contre les mildious à des doses comprises entre 1,5 et 3 kg de cuivre/ha, que ce soit sur vigne (photo en médaillon), tomate, pomme de terre... Ces fongicides minéraux occupent une place prépondérante en culture biologique, mais les risques environnementaux liés au cuivre risquent de remettre en question l'usage des fongicides cupriques.
Après la Seconde Guerre mondiale, la montée en puissance de la chimie organique de synthèse a généré plusieurs classes de fongicides multisites, notamment des dithiocarbamates (ex : manèbe, mancozèbe, métirame-zinc, thirame) et des N-chloroalkylmercaptans (ex : captane, folpel, tolylfluanide). Ils présentent un large spectre d'action incluant Ascomycètes, Basidiomycètes, Adélomycètes et Oomycètes et s'utilisent en pulvérisation foliaire (1 à 2 kg de matière active/ha) ainsi qu'en traitement de semences. D'autres substances comme le chlorothalonil (phtalonitrile), la doguadine et la guazatine (guanidines) se classent également parmi les multisites organiques.
Ces fongicides multisites présentent une grande diversité chimique mais ont en commun une forte réactivité avec de nombreux constituants cellulaires et en particulier ceux possédant des groupements thiols (SH).
Ainsi, au niveau des processus respiratoires, ils bloquent des enzymes de la glycolyse (ex : pyruvate deshydrogénase), du cycle de Krebs (ex : cétoglutarate deshydrogénase) et de la chaîne respiratoire.
Cette forte réactivité non sélective des fongicides multisites les expose à des effets indésirables sur divers organismes. Ceci est d'ailleurs à l'origine du retrait ancien (ex : organomercuriques) ou récent de plusieurs d'entre eux.
En revanche, ils présentent un aspect très positif vis-à-vis de la résistance puisque dans leur grande majorité, ils n'ont jamais été confrontés à ce phénomène en pratique. C'est pourquoi ils constituent, notamment en arboriculture et viticulture, des partenaires importants dans le cadre de stratégies anti-résistance impliquant l'utilisation de fongicides unisites à risque (ex : mildiou de la vigne).
Fongicides affectant la biodisponibilité de l'ATP
Dans le domaine phytosanitaire, les organostanniques qui sont des inhibiteurs de phosphorylation oxydative, ont été utilisés comme fongicides ou acaricides.
Ainsi, le fentine-acétate ou le fentine-hydroxyde sont des fongicides de surface actifs vis-à-vis d'Ascomycètes et d'Oomycètes. Le seul cas de résistance observé en pratique concernerait la cercosporiose de la betterave et résulterait d'une mutation dans un gène mitochondrial codant une des sous-unités de l'ATP synthase.
Parmi les découplants protonophores qui perméabilisent les membranes mitochondriales aux protons et par voie de conséquence empêchent le fonctionnement de l'ATP synthase, il existe deux fongicides agricoles. L'un est le dinocap, un ester phénolique spécifique des oïdiums dont le toxophore est un hydroxyle ; il n'a jamais été confronté à la résistance. Une nouvelle forme dénommée méthyl-dinocap va prochainement se substituer au dinocap.
L'autre fongicide découplant est le fluazinam, une pyridineamine dont le toxophore est une amine secondaire ; il agit préventivement contre divers Ascomycètes et Oomycètes. Aucune résistance n'a été rapportée en France vis-à-vis de ce fongicide, mais le phénomène a été signalé au Japon chez B. cinerea.
Le silthiofam est une silyamide qui possède une analogie structurale avec les carboxamides inhibitrices du complexe II. Toutefois, ce fongicide a la particularité d'être uniquement efficace vis-à-vis du piétin-échaudage du blé provoqué par Gaueumannomyces graminis var. tritici. Il n'a pas d'activité sur la variété avenae et, en laboratoire, certains isolats de la variété tritici semblent naturellement résistants. Il a été montré que le silthiofam empêchait le transfert de l'ATP des mitochondries vers le cytoplasme.
Inhibiteurs du complexe mitochondrial II ou SDHI
Structure et fonctionnement du complexe II
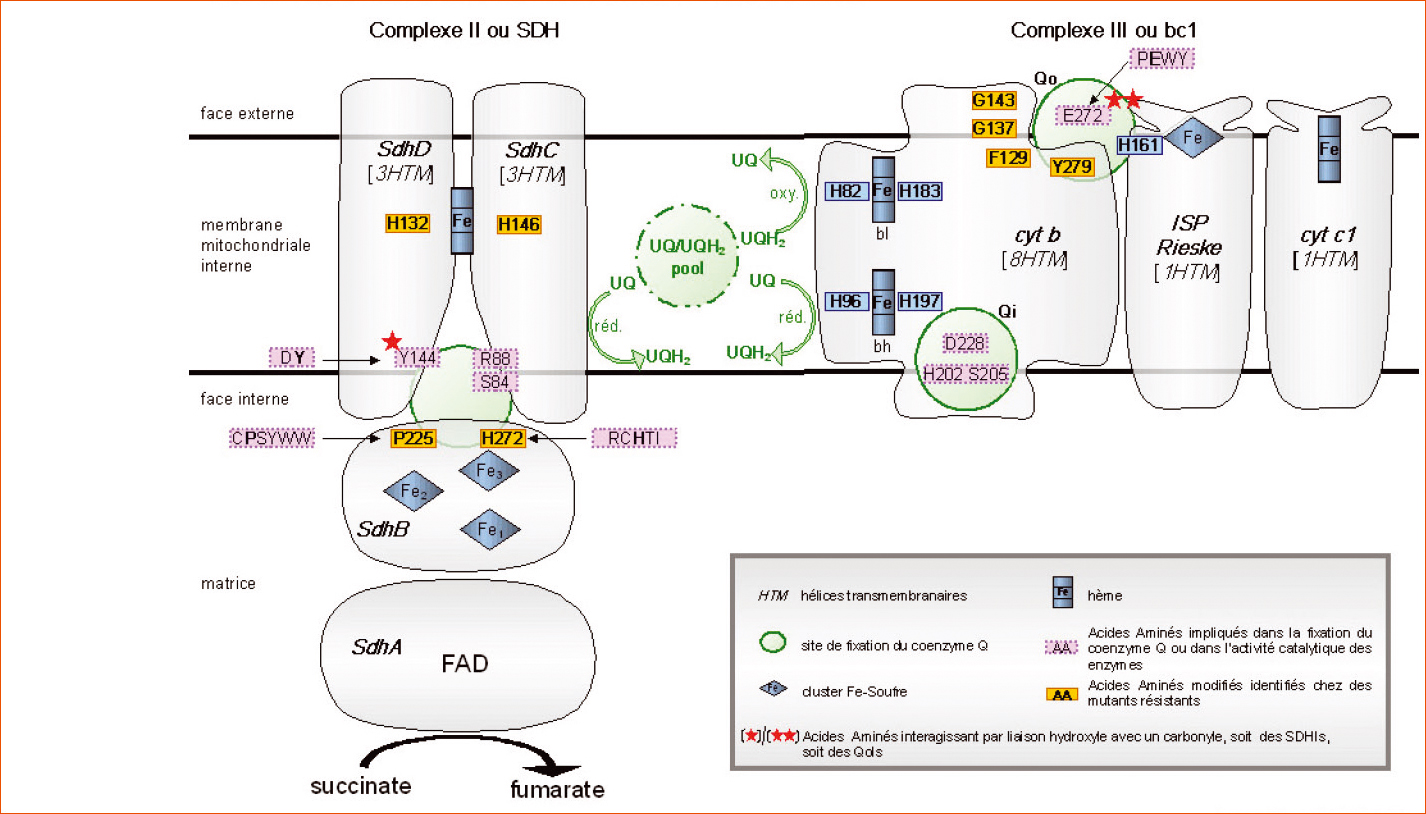
La succinate deshydrogénase ou succinateubiquinone réductase qui permet l'oxydation du succinate en fumarate, est la seule enzyme du cycle de Krebs liée à la membrane mitochondriale. Elle est composée de quatre protéines, toutes codées par des gènes nucléaires.
Premièrement, une flavoprotéine (FP ou SdhA), ayant le FAD (Flavine Adénosine Dinucléotide) comme cofacteur, est orientée vers la matrice mitochondriale et se lie au succinate pendant sa réduction. Une seconde protéine hydrophile, comportant 3 clusters fer-soufre participe à la fixation du coenzyme Q. Au sein de ces trois clusters désignés S1 [2Fe-2S], S2 [4Fe-2S] et S3 [3Fe-4S], les atomes de soufre sont issus de cystéines. Les électrons libérés lors de l'oxydation du succinate transitent successivement par la FAD puis les clusters S1, S2 et S3 avant de réduire l'ubiquinone (Figure 2).
Les deux autres protéines (SdhC et SdhD) qui sont hydrophobes et comportent chacune trois hélices transmembranaires, permettent d'ancrer le complexe II dans la membrane mitochondriale interne. Ces deux protéines d'ancrage intègrent un hème (comme il en existe au sein des cytochromes) à la fonction pas bien identifiée ; par ailleurs, elles contribuent à la fixation de l'ubiquinone pendant sa réduction.
Caractéristiques des fongicides SDHI
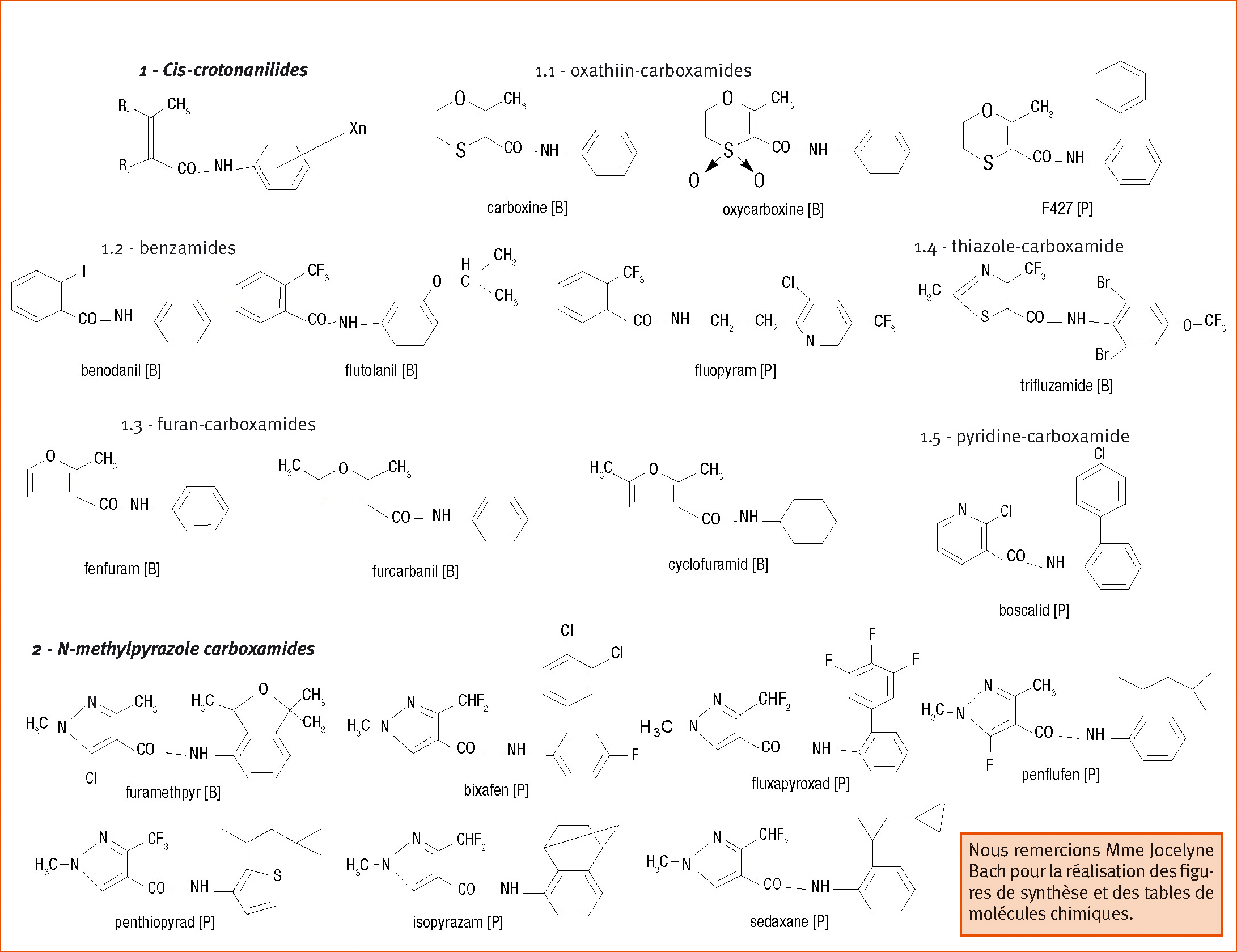
Les fongicides inhibant la succinate deshydrogénase, caractérisés par des structures chimiques voisines (Figure 3), ont été rassemblés sous le vocable de « carboxamides ».Plus récemment, les sociétés phytosanitaires proposent l'appellation « SDHI » (Succinate DesHydrogenase Inhibitors). Les premières matières actives mises au point dans les années 1960 ont été la carboxine et l'oxycarboxine. Ces oxathiines sont systémiques et actives exclusivement sur des Basidiomycètes incluant des charbons, rouilles et rhizoctones.
Cette dernière caractéristique est observée sur un grand nombre de carboxamides incluant des benzamides (ex : bénodanil, flutolanil, mépronil) ou comportant des hétérocycles (ex : fenfuram, furcarbanil, cyclofluramide, trifluzamide). Tous possèdent une structure de type « cis-crotonanilide » donc dérivent d'un acide carboxylique comportant une double liaison ab.
Les nombreuses études structurales conduites dans les années 1960-1980 indiquent que la présence de l'amide est essentielle, mais qu'en revanche, le cycle benzénique peut être remplacé par un cyclohexyle (ex : cyclofuramid) ou par des chaînes alkylées. Quant au méthyle présent sur le carbone b, il peut être remplacé par un éthyle, un iode (ex : bénodanil), un chlore ou un trifluorométhyle (ex : flutolanil). En outre, la présence de certains groupements sur un des carbones du noyau benzénique peut changer l'activité inhibitrice ou étendre le spectre d'action. Cette dernière propriété a été décrite dès la fin des années 1960 avec le 2'-phényl analogue de la carboxine (F427). Mais c'est seulement au début des années 2000 qu'est apparue une « cis-crotonanilide » à large spectre et activité : le boscalid. Le fluopyram, benzamide en cours d'expérimentation, appartient à la même classe (Figure 3).
En dehors de ces « cis-crotonanilides », plusieurs méthyl-pyrazole carboxamides ne comportant pas de double liaison entre le méthyle et le groupement carboxamide sont également des SDHI. Il s'agit d'une part du fluramethpyr, un anti-rhizoctone développé sur le riz au Japon, et d'autre part de fongicides à large spectre utilisables sur semence ou en cours de végétation chez des mono ou des dicotylédones contre des Basidiomycètes, des Adelomycètes et des Ascomycètes (bixafen, fluxapyroxad, isopyrazam, penthiopyrad, penflufen, sedaxane).
A notre connaissance, aucun SDHI efficace contre les Oomycètes n'est au point à ce jour.
Mode d'action des SDHI (notation des acides aminés selon B. cinerea)
Les travaux conduits sur la carboxine indiquent que cette carboxamide est capable d'inhiber à faible concentration le complexe II de Basidiomycètes mais aussi d'autres champignons ainsi que de mammifères ; elle est en revanche peu active sur celui des plantes.
Par ailleurs, cette inhibition ne s'observe pas sur la forme solubilisée de la SDH qui compte uniquement les sous-unités SdhA et SdhB et qui par ailleurs ne peut pas réduire l'ubiquinone. Cette observation suggère que l'interaction du coenzyme Q ou des carboxamides implique les sous-unités SdhB, SdhC et SdhD.
En fait, il s'avère que des acides aminés de chacune d'entre elles sont essentiels à l'activité catalytique. Il s'agit d'une part de la tyrosine SdhD Y144 et de la sérine SdhC S84 qui interagissent par liaison hydrogène avec les deux carbonyles de l'ubiquinone (l'arginine SdhC R88 serait également impliquée dans la fixation de l'ubiquinone). La sous-unité SdhB possède deux motifs conservés [CPSYWW] et [RCHTI] comportant chacun respectivement les clusters fer-soufre S2 et S3. Dans le premier motif, la proline P225 et les deux tryptophanes W228 et W229 sont impliqués dans la fixation hydrophobe de la chaîne de l'ubiquinone tandis que dans le second motif, l'histidine H272 interagit avec un groupement méthoxy.
À partir des investigations menées principalement avec la carboxine, il s'avère que les carboxamides se fixent dans la même région que l'ubiquinone. Pour toutes, leur groupement carbonyle (C=O) peut interférer par liaison hydrogène avec la tyrosine SdhD Y144. Quant aux interactions avec la sérine SdhC S84 et l'histidine SdhB H272, elles feraient intervenir pour la carboxine respectivement les atomes de soufre et d'oxygène de cette oxathiine.
Pour les carboxamides renfermant un hétérocycle sans oxygène, notamment un pyrazole, il est probable qu'un atome d'azote joue un rôle similaire à l'oxygène de l'oxathiine. Quant aux benzamides, des interactions par liaison hydrogène semblent improbables.
Le phényle ou les autres structures associées à l'atome d'azote des carboxamides contribuent par des interactions hydrophobes (impliquant probablement la zone PSYWW du SdhB) à leur fixation sur le complexe II.
Pour conclure, les fongicides SDHI occupent une zone délimitée par les protéines SdhB, SdhC et SdhD, partiellement incluse dans la poche de fixation de l'ubiquinone.
Résistance aux SDHI, état des lieux
Des mutants de laboratoire résistants aux carboxamides ont été obtenus chez plusieurs Basidiomycètes (dont Ustilago maydis agent du charbon à ustilago du maïs) et quelques Ascomycètes (Mycosphaerella graminicola agent de septoriose sur blé, Aspergillus nidulans, Aspergillus oryzae). La résistance au champ a été reportée pour les carboxamides anti-Basidiomycètes chez le charbon de l'orge (Ustilago nuda), la rouille blanche du chrysanthème (Puccinia horiana) et la rouille de l'œillet (Uromyces caryophyllinus).
Plus récemment, suite à l'utilisation du boscalid, des souches résistantes ont été décelées au champ chez onze champignons phytopathogènes. Pour 3 d'entre eux, Alternaria alternata, Corynespora cassiicola et Podosphaera xanthii, des pertes d'efficacité ont été reportées en pratique (site internet du FRAC).
À noter que chez A. alternata et B. cinerea, de nombreuses souches résistantes au boscalid sont également résistantes aux strobilurines. Dans le cas d'A. alternata, les souches doublement résistantes ont été collectées aux USA sur des pistachiers traités avec le mélange pyraclostrobine + boscalid et présentant de fortes infestations. Pour B. cinerea, de telles souches existent dans plusieurs vignobles français et européens.
Résistance aux SDHI : mécanismes impliqués
Concernant les mécanismes de résistance, tant chez les mutants de laboratoire que les souches collectées au champ, ils semblent essentiellement liés à des modifications qualitatives des sous-unités SdhB, SdhC et SdhD.
L'altération la plus fréquente concerne l'histidine H272 (ce codon de B. cinerea est en position 249 chez A. oryzae, 253 chez U. maydis, 267 chez M. graminicola, 277 chez A. alternata et 278 chez C. cassiicola) présente dans un motif très conservé du SdhB (RCHTI). Cette histidine peut être remplacée par une leucine, une tyrosine, une arginine ou une asparagine.
Ainsi, chez B. cinerea, la présence d'une leucine ou d'une tyrosine induit une résistance moyenne au boscalid, et celle d'une arginine induit une forte résistance. Par ailleurs, si en présence de leucine ou d'arginine il y a résistance croisée positive entre carboxamides, en revanche, avec la tyrosine, il y a sensibilité accrue vis-à-vis du groupe des benzamides. Ce phénomène avait déjà été observé chez une classe de souches d'U. nuda résistante à la carboxine.
Chez B. cinerea, des mutations ont également été observées au codon 225 du SdhB. Chez les souches sensibles, il y a une Proline qui fait partie d'un motif très conservé (CPSYWW) et elle peut être remplacée par une thréonine, une leucine ou une phénylalanine. Des souches collectées au vignoble présentant les changements P225Y/L sont respectivement moyennement et fortement résistantes au boscalid. Il y a résistance croisée avec toutes les carboxamides mais, pour certaines (dont la carboxine), des niveaux de résistance faibles.
Enfin, chez quelques souches collectées au champ ou induites en laboratoire, les changements portent sur les sous-unités SdhC et SdhD.
Pour SdhC, chez des mutants de laboratoire obtenus chez Coprinus cinereus (en présence de flutolanil) ou chez A. oryzae (en présence de carboxine), les substitutions SdhC N80K (codon 87 chez B. cinerea) et SdhC T90I (codon 90 chez B. cinerea) ont été respectivement relevées. Ces changements n'ont jamais été observés sur des souches collectées au champ, mais récemment, chez A. alternata, de nombreux isolats résistants au boscalid comportent la substitution SdhC H134R (codon 146 chez B. cinerea).
Pour la sous-unité SdhD chez A. oryzae, un mutant de laboratoire résistant à la carboxine comporte la substitution SdhD D124E (codon 143 chez B. cinerea). Ce même mécanisme a récemment été identifié chez des isolats d'A. alternata résistants au boscalid (codon 123 de ce champignon). Chez B. cinerea et S. sclerotiorum, des souches faiblement à moyennement résistantes aux carboxamides présentent le changement SdhD H132R ; ce dernier a également été décelé récemment chez A. alternata (sdhD H133R). à noter que d'après les travaux de cristallographie réalisés sur la SDH d'Escherichia coli, les deux histidines homologues SdhC H146R et SdhD H132R (codons de B. cinerea ; figure 2) fixent l'hème b au sein du complexe II et semblent essentielles à son bon fonctionnement. à signaler des études récentes chez C. cassiicola indiquant des résistances aux SDHI déterminées par les changements SdhC S73P ou SdhD S89P.
Actuellement, nous n'avons pas d'information sur la fitness des divers génotypes trouvés au champ et résistants aux carboxamides. Il est possible que certaines mutations affectent la fixation de l'ubiquinone et plus généralement le fonctionnement du complexe II. Le suivi des populations fongiques ainsi que des études biochimiques sont nécessaires pour mieux appréhender cette résistance à la fois multigénique et multiallélique.
Fin de l'épisode
En attendant l'article sur les inhibiteurs du complexe III et le phénomène de MDR (multi-drug resistance), ce « premier épisode » permet de comparer deux grandes catégories de fongicides affectant les processus respiratoires.
Il s'agit des fongicides multisites d'une part, et d'autre part de deux catégories d'unisites, ceux qui affectent la biodisponibilité de l'ATP et les SDHI inhibiteurs du complexe II. Ces fongicides associent la polyvalence à une forte action préventive mais se différencient par leur dose d'utilisation (avantage aux unisites avec environ 10 fois moins de matière active appliquée à l'hectare) et vis-à-vis de la résistance (avantage aux multisites qui lui échappent : à noter l'émergence de résistances multigéniques et multialléliques vis-à-vis des SDHI).
Quant aux conclusions générales à tirer sur les modes d'action, y compris les similitudes avec certains insecticides et acaricides, voire herbicides, nous les tirerons le mois prochain avec les perspectives que cela ouvre pour l'avenir.
<p>* INRA, UMR 1290 BIOGER-CPP. Bât 13. Avenue Lucien-Brétignières. BP 01. 78850 Thiverval-Grignon. walker@versailles.inra.fr</p>
Cycle de Krebs et chaîne respiratoire, de quoi s'agit-il ?
Le cycle de Krebs, qui se réalise au sein de la matrice mitochondriale, comporte huit étapes enzymatiques dont trois génèrent du NADH (forme réduite du NAD ou NicotinAmide Dinucléotide). Ce cofacteur et le succinate, un des intermédiaires du cycle de Krebs, vont ensuite être oxydés par l'intermédiaire de la chaîne respiratoire. Cette chaîne respiratoire comporte une série de transporteurs d'électrons susceptibles d'être sous forme oxydée ou réduite. Certains comme le coenzyme Q (dont les formes oxydées et réduites sont respectivement l'ubiquinone ou UQ et l'ubiquinol ou UQH2) ou le cytochrome c sont relativement mobiles, alors que d'autres sont inclus dans des complexes protéiques insérés dans la membrane mitochondriale interne.
Les quatre associations fonctionnelles composant cette chaîne respiratoire sont le NADH-ubiquinone réductase (complexe I), la succinate ubiquinone réductase ou succinate deshydrogénase (complexe II), l'ubiquinolcytochrome c réductase (complexe III ou bc1) et le cytochrome oxydase (complexe IV).
Enfin, un dernier complexe protéique membranaire correspond à l'ATP synthase (complexe V) qui fonctionne grâce à la translocation transmembranaire des protons induits par les complexes I, II et III (Figure 1).

 Imprimer
Imprimer