Le changement climatique risque de favoriser le développement d'agents pathogènes, et donc conduire à accentuer les pressions sélectives exercées par les fongicides. Ceci pourrait accélérer l'apparition de résistances à ces produits. En parallèle, les impératifs du plan Ecophyto 2018 poussent à réduire le nombre de traitements, donc à éviter toute application inutile et/ou surdosage du fait d'une résistance mal diagnostiquée.
Afin d'anticiper un tel scénario, nous développons depuis 2008 des outils moléculaires visant à suivre l'évolution de la résistance de l'oïdium de la vigne (Erysiphe necator) à deux catégories de fongicides très présents en viticulture : les DMI et les QoI.
Ce travail, issu d'une collaboration entre le laboratoire UMR SAVE de l'INRA-Bordeaux et l'ANSES de Lyon (unité RPP), permet aujourd'hui de cartographier l'état de la résistance de l'oïdium de la vigne dans le vignoble hexagonal.
Face aux interrogations actuelles
Pourquoi évaluer l'état des résistances
La résistance des champignons aux fongicides est un phénomène naturel inéluctable lié aux lois de l'évolution des organismes vivants soumis à des pressions de sélection. Depuis le Grenelle de l'environnement, avec la réduction des pesticides de 50 % d'ici 2018 demandée par le plan Ecophyto 2018, les phénomènes de résistance aux fongicides doivent être pris en compte dans le choix des programmes de traitements et des substances afin d'éviter tout surdosage ou traitement en excès (rattrapage après échec dû à une résistance...).
Or, depuis quelques années, les changements climatiques en cours et annoncés semblent favoriser le développement d'agents pathogènes tel qu'Erysiphe necator, responsable de l'oïdium de la vigne. Des cas de pertes d'efficacité des traitements semblent découler de pressions parasitaires plus fortes selon les régions considérées mais, aussi, des phénomènes de résistance d'E. necator aux fongicides qui semblent resurgir.
Qu'en est-il de ces résistances ? Augmentent-elles réellement ou s'agit-il de mauvaises applications de produits ?
Comment faire ? La PCR peut y aider
Un point sur l'état de résistance des populations d'oïdium de la vigne paraissait nécessaire. Pour ce faire, nous avons développé à l'INRA de Bordeaux des outils moléculaires permettant d'évaluer la fréquence de quelques allèles de résistance aux fongicides dans le vignoble français.
Cette étude, fruit d'une étroite collaboration entre l'INRA de Bordeaux et l'Anses de Lyon, permet aujourd'hui de disposer de données innovantes sur l'évolution de la résistance au cours des années 2008 à 2011.
Un peu d'histoire
1845, l'oïdium débarque en Europe
Ce champignon ascomycète (E. necator), introduit en Europe en 1845, provient des États-Unis. Dès 1850, le soufre a été le premier fongicide découvert pour lutter contre cet agent, puis des produits chimiques de synthèse ont été utilisés dès les années 1960 (dinocap, thiophanate-méthyl).
1975, les fongicides IDM arrivent au vignoble
À partir de 1975, sont apparues plusieurs familles chimiques possédant toutes le même mode d'action : les inhibiteurs de la biosynthèse des stérols qui inhibent la déméthylation d'une molécule de stérol au cours de la biosynthèse du méthylène-24-cholestérol chez E. necator ou de l'ergostérol chez d'autres champignons (DMI, DeMethylase Inhibitor).
1984, résistance de l'oïdium aux IDM
À partir de 1984, les premiers cas de résistance aux fongicides de type DMI sont décrits, d'abord au Portugal puis en France et dans le vignoble mondial (Corio-Costet, 2007).
C'est au laboratoire, en 1997, que l'un des mécanismes de résistance de l'oïdium de la vigne à ces fongicides, fut élucidé (Délye et al., 1997). En effet, il existait une corrélation entre la présence d'une mutation ponctuelle ou SNP (single nucleotide polymorphism) dans le gène du champignon codant pour une enzyme (eburicol-C14-déméthylase) cible des fongicides DMI, et une perte de sensibilité vis-à-vis de cette famille chimique. Un simple changement d'une base nucléotidique dans la séquence du gène a conduit à la modification d'un acide aminé constituant l'enzyme et à un changement de sensibilité aux fongicides (mutation Y136F )(Délye et al. 1997).
Cette résistance n'étant pas généralisée, les spécialités à base de DMI sont encore largement utilisées, depuis l'apparition des premiers cas de résistance, sans problèmes majeurs.
Années 90, arrivée des QoI
Dans les années 90, de nouvelles familles chimiques à large spectre et assurant une bonne protection, les QoI, ont été commercialisés pour lutter contre de nombreuses maladies. Ces molécules, par exemple les strobilurines, sont des inhibiteurs de la respiration mitochondriale et plus particulièrement d'une enzyme du complexe respiratoire III, le cytochrome b. Leur utilisation sur d'autres cultures ont conduit rapidement, en moins de deux ans, à l'apparition généralisée de phénomène de résistance.
2008, résistance aux QoI
Les premiers cas de résistance aux QoI dans le vignoble français ont été décrits dès 2003, mais sur le mildiou (Magnien et al., 2003). La résistance est liée à la présence d'une mutation ponctuelle dans la séquence nucléotidique du gène codant pour le cytochrome b (mutation G143A). Chez l'oïdium de la vigne, cette mutation G143A est responsable d'une résistance totale à tous les QoI (Baudoin et al., 2008 ; Dufour et al., 2011). Ses premières détections en France remontent à 2008 (cf. Note nationale résistance vigne 2011, Phytoma n° 643, p. 10).
Comment la résistance se maintient et se propage-t-elle?
Ce qui se passe en général
Une fois les souches ou populations résistantes sélectionnées par l'application des fongicides, les allèles de résistance peuvent se disperser dans le vignoble, soit par voie aérienne (reproduction asexuée) via le déplacement des spores (conidies) résistantes d'oïdium de proche en proche, soit par reproduction sexuée (recombinaison génétique, chasmothèce ou cleistothèce). Ainsi, le gène de résistance sera-t-il présent dans la descendance après un croisement entre des souches sensibles et résistantes.
À noter que si la résistance aux DMI est portée par des gènes nucléaires, celle conférant la résistance aux QoI est portée par un gène mitochondrial.
Cas de l'oïdium de la vigne
L'oïdium de la vigne présente une particularité : il existe deux groupes génétiques distincts qui possèdent des exigences écologiques différentes (Amrani et al., 2006 ; Délye et al., 1997).
Des travaux antérieurs réalisés au laboratoire révèlent également que les souches appartenant au groupe A, beaucoup plus présentes dans les vignobles du pourtour méditerranéen, sont plus sensibles aux fongicides que les souches du groupe B, présentes sur l'ensemble du territoire viticole français, lesquelles hivernent majoritairement sous la forme d'organes de reproduction sexuée (chasmothèces).
Cependant nous disposons de très peu de données sur la propagation de la résistance une fois sélectionnée.
Quelques outils moléculaires pour faciliter le suivi…
Pourquoi utiliser la PCR
De façon générale, les tests biologiques et la perte d'efficacité des traitements demeurent la preuve absolue d'un état de résistance ; mais, chez l'oïdium de la vigne qui est un parasite obligatoire (impossible donc à cultiver in vitro), les tests biologiques sont fastidieux et non quantitatifs.
D'où l'intérêt de les compléter par des outils moléculaires, parfois complexes à mettre au point mais très faciles d'usage. Nous avons donc développé un outil de PCR (polymerase chain reaction) quantitative en temps réel (qPCR) pour détecter et quantifier rapidement (Dufour et al., 2011):
• la mutation Y136F dans le gène du cytochrome P450 (gène Cyp 51) responsable de la déméthylation des stérols, participant à la résistance aux fongicides DMI,
• la mutation G143A dans le gène du cytochrome b impliqué dans la respiration mitochondriale, conférant la résistance aux QoI.
Plus de 250 échantillons en 4 ans
À partir d'amorces spécifiques de l'oïdium de la vigne et des différents gènes étudiés, il est donc possible d'évaluer la distribution de la résistance aux fongicides DMI et QoI.
Plus de 250 échantillons ont été analysés en quatre ans pour la présence des différents allèles dans le vignoble. Les échantillons (cépages Merlot, Cabernet-Sauvignon, Gros Manseng, Muscadelle, Mauzac, Chardonnay, Centennial, Négrette, Carignan, Gamay) proviennent soit de vignobles commerciaux, soit de parcelles de suivis d'érosion de l'efficacité des molécules. Chaque échantillon regroupe plusieurs prélèvements de feuilles ou grappes d'une même parcelle, réalisés entre juin et fin octobre.
Méthode utilisée, la PCR quantitative
La méthode de diagnostic permet d'évaluer quantitativement la proportion de chaque type d'allèle dans les échantillons. La spécificité d'amplification est obtenue en plaçant l'extrémité 3' d'une des amorces directement sur la mutation, d'où amplification unique de l'allèle spécifique. Ce dernier est alors quantifié comme une quantité relative en utilisant un allèle commun aux deux groupes de sensibilité aux fongicides.
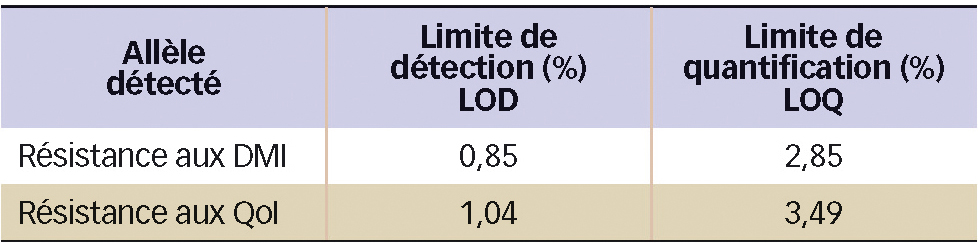
Les réactions sont réalisées en présence d'un agent chimique, qui, en se fixant sur les acides nucléiques de l'ADN double brin, devient fluorescent. Au cours de l'amplification dans un thermocycleur à température pré-déterminée, la fluorescence est enregistrée, et les courbes obtenues illustrent le niveau de fluorescence en fonction du nombre de cycles d'amplification réalisé. Ces courbes sont mises en relation avec celles obtenues lors de l'amplification de l'allèle commun. Cela permet de quantifier la présence de l'allèle recherché et d'en déterminer les limites de détection et de quantification pour chaque type d'allèles (tableau 1) (Dufour et al., 2011).
La méthode a plusieurs avantages : elle est quantitative, rapide, multi échantillons, plus sensible que les PCR classiques (nested-PCR, PCR-AFLP, CAPS) et de bonne reproductibilité.
évolution de la résistance de 2008 à 2011
Augmentation globale…
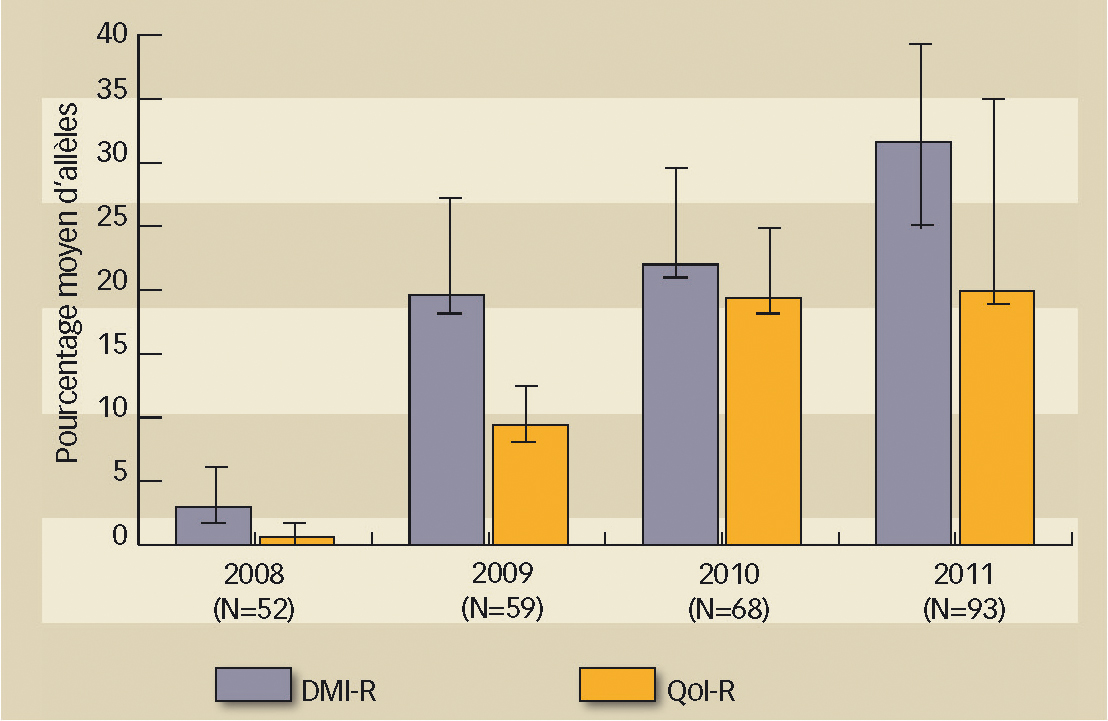
De 2008 à 2011, sur l'ensemble des échantillons récoltés en France, globalement la présence de l'allèle de résistance aux DMI augmente régulièrement. Quant à l'allèle de résistance aux fongicides QoI, il a fortement augmenté entre 2008 et 2009 mais semble se stabiliser entre 2010 et 2011 (figure 1).
… Quoique… DMI, gare à la « spécificité régionale »
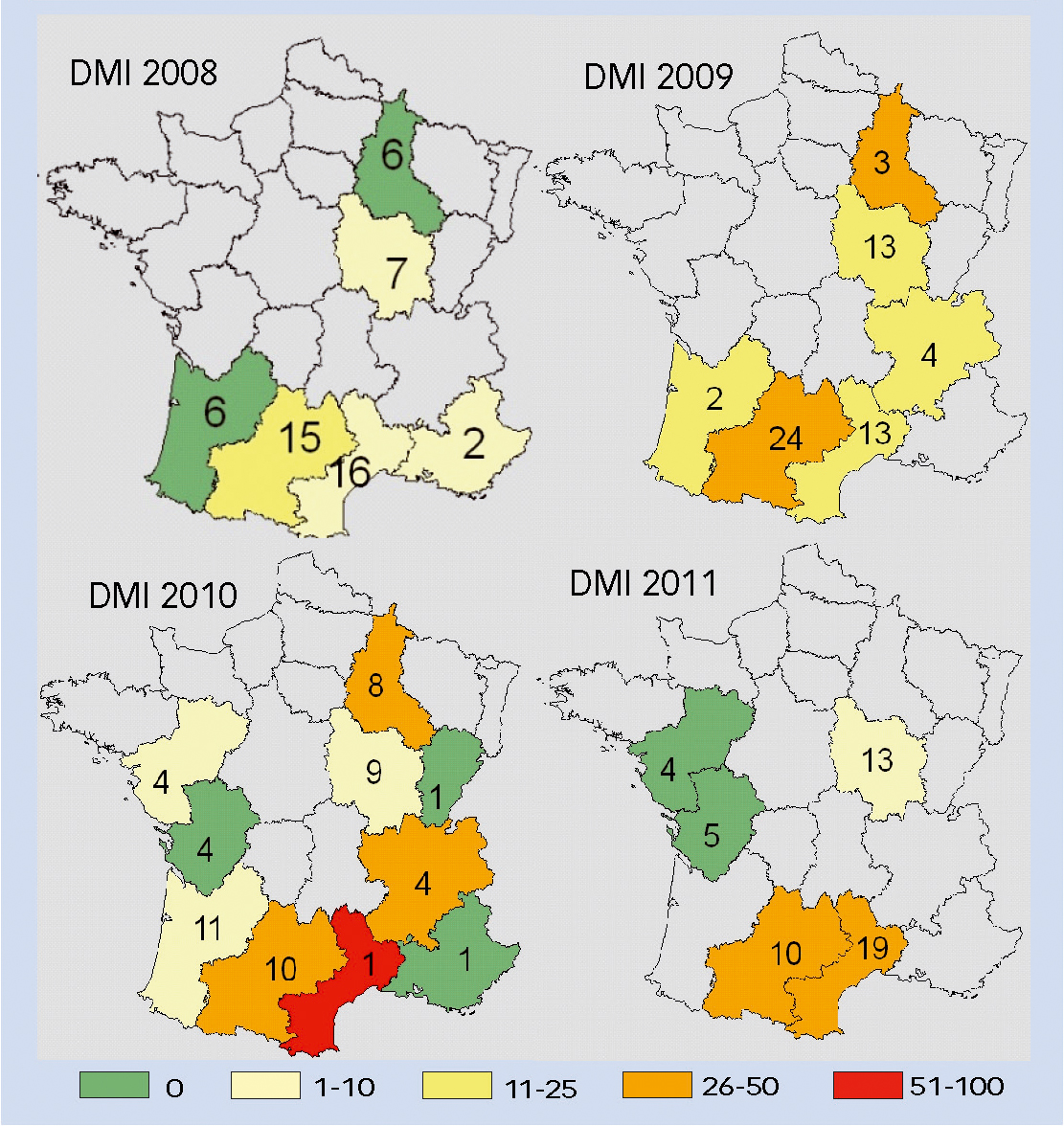
Mais ces tendances masquent de fortes disparités régionales. Ainsi pour les DMI, l'analyse région par région (figure 2) révèle que si, globalement, le pourcentage moyen d'allèle résistant augmente bien de 2008 à 2010, le nombre de régions touchées par la résistance demeure similaire entre 2009 et 2010 (respectivement 6 et 7 régions). En 2011, seules 5 régions ont été suivies : la hausse de fréquence moyenne d'allèle résistant reflète cet échantillonnage restreint. En effet, la quasi totalité des échantillons viennent des régions Midi-Pyrénées et Languedoc-Roussillon, où la résistance était bien implantée et où, en fait, elle ne semble pas avoir augmenté ! Un biais probable.
QoI, vraie augmentation
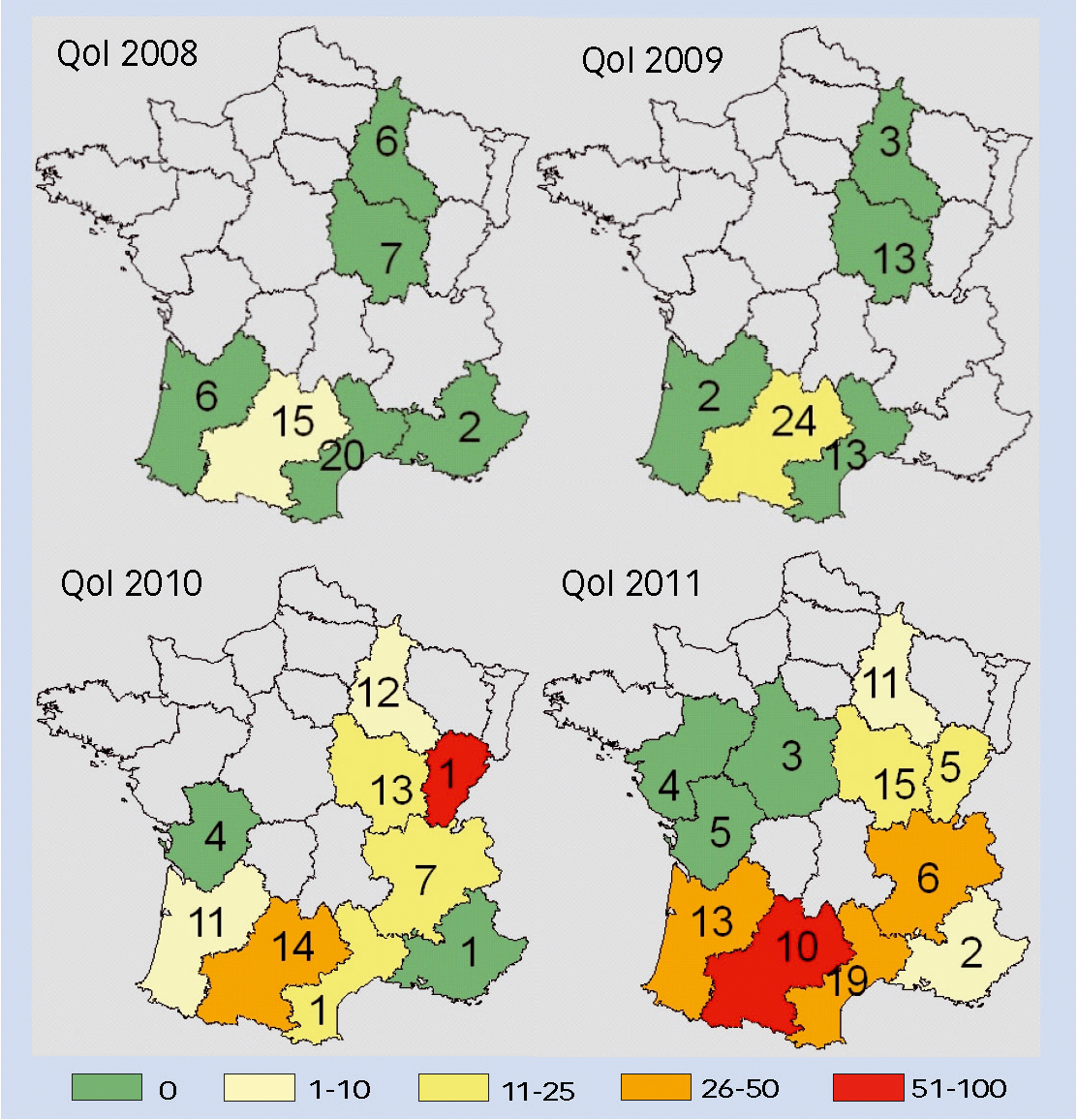
Concernant les QoI, le nombre de régions concernées par la résistance à ces fongicides a fortement augmenté de 2008 à 2011 (2 régions en 2008 vs 8 en 2011) (figure 3).
Dans quatre régions, le pourcentage moyen d'allèle de résistance a notablement progressé en 2011 : Aquitaine, Languedoc-Roussillon, Rhônes-Alpes et Midi-Pyrénées.
Quelle évolution en parcelles résistantes ?
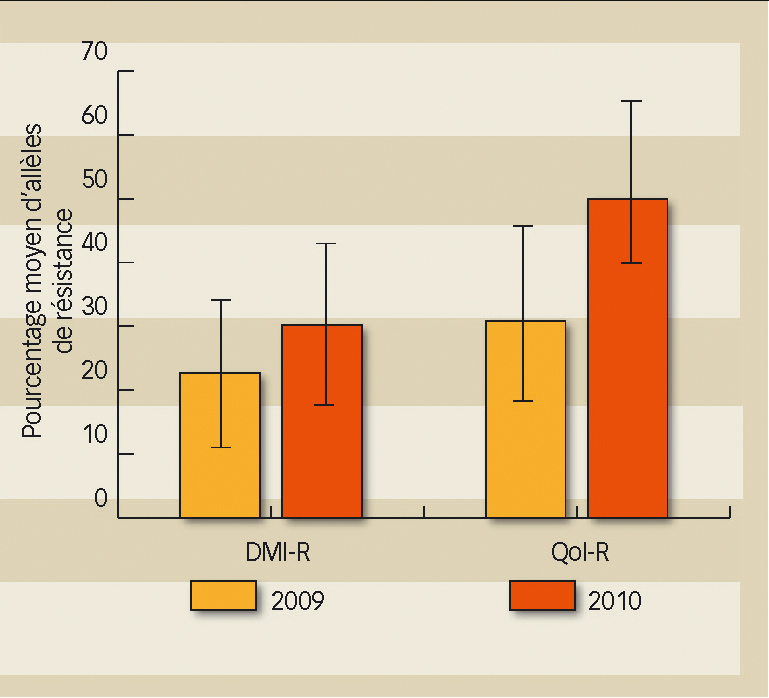
9 parcelles de Languedoc-Roussillon et Bourgogne ont fait l'objet de prélèvements en 2009 puis 2010.
Globalement (figure 4), les résultats ne montrent pas d'évolution significative du pourcentage moyen d'allèle de résistance aux DMI et aux QoI au seuil de 5 % (P ≤ 0,05) dans les parcelles où la résistance est installée. En revanche, au seuil de 8 %, on note une augmentation significative de la résistance aux fongicides QoI (P =0,078). Mais il existe une forte disparité entre parcelles, certainement à relier aux traitements et à la pression de sélection. Tous les cas d'évolution de résistance sont observées (augmentation, stabilité, voire diminution).
Parcelles à deux allèles détectés !
Il est important de noter que plus de 10 % des parcelles suivies en 2010 se sont avérées posséder les allèles de résistance vis-à-vis des deux familles de fongicides (DMI et QoI).
En 2011, certaines parcelles d'essai « érosion d'efficacité » situées en Midi-Pyrénées (prélèvements réalisés en septembre) sont dans la même situation.
Que conclure et que faire ?
La PCR peut aider à suivre les résistances et établir des seuils « taux de résistance/perte d'efficacité »
Bien qu'il existe aujourd'hui d'autres matières actives antioïdium que les QoI et les DMI, ces deux familles sont présentes en 2011 dans 71 % des spécialités autorisées sur le marché français. Il faut donc être prudent quant à leur utilisation, selon la situation de la parcelle.
La méthode d'analyse développée peut s'avérer un outil de choix pour suivre l'évolution de la résistance au cours des millésimes. L'outil permet, pour la première fois, de suivre in natura, la propagation de la résistance au sein des populations d'oïdium de la vigne.
Rappelons que détection ne rime pas forcément avec perte d'efficacité. Toutefois, si les seuils de résistance à partir desquels une perte d'efficacité apparaît ne sont pas clairement connus, il est dorénavant possible de les déterminer à l'aide de ces outils moléculaires et de corréler la présence des allèles à des pertes d'efficacité. Notons déjà que la situation des parcelles dans lesquelles plus de 50 % d'allèles de résistance sont détectés ne présage rien de bien favorable pour le futur si les pressions de sélection exercées par les fongicides DMI et QoI perdurent.
Limiter les traitements « à risque »
Connaître l'état de résistance d'une parcelle devrait permettre de mieux gérer les intrants pesticides et limiter la pression exercée par les fongicides DMI et QoI. Ainsi, selon le « profil oïdieux » d'une parcelle, on réalisera des traitements plus adéquats afin de limiter ceux à risque et obtenir un raisin de qualité. Ce constat sur la résistance montre qu'il faut être attentif et appliquer les préconisations décrites dans la « note nationale oïdium de la vigne » (http://draaf.rhone-alpes. agriculture.gouv.fr/Note-Nationale-Mildiouet-Oidium) afin d'éviter les problèmes de résistance. Certaines règles simples sont à respecter comme d'alterner sur une même campagne des spécialités possédant des modes d'action biochimiques différents. En cas de résistance suspectée ou avérée, le nombre de traitements annuels des spécialités concernées doit impérativement être limité. Enfin, en toute situation, il faut soigner sa pulvérisation et bien respecter les doses d'homologation.
<p><b>Remerciements</b> : À J. Grosman et C. Magnien pour leur soutien, à tous les acteurs des SRAL et des FREDON ainsi qu'à P. Cartolaro (INRA-Bordeaux) qui ont permis les campagnes d'échantillonnage de l'oïdium de la vigne. Également des remerciements particuliers à Dula Bencené (Hongrie) qui nous a fourni les premières souches résistantes aux QoI.</p>
Fig. 1 : Augmentation globale de la résistance.
Évolution moyenne, dans l'ensemble des régions viticoles, des allèles de résistances aux fongicides DMI et QoI de 2008 à 2011.
Tableau 1 - Limites de détection (LOD) et de quantification (LOQ) obtenues pour chaque allèle détecté, exprimées en pourcentage de présence de l'allèle dans un échantillon.
Fig. 2 : Résistance aux DMI.
Répartition et quantification des allèles de résistance aux DMI en fonction des régions, exprimés en % moyen d'allèle de résistance aux DMI dans les échantillons de chaque région de 2008 à 2011. Les nombres indiqués dans les régions indiquent le nombre de parcelles analysés, correspondant à plusieurs échantillons.
Fig. 3 : Résistance aux QoI, une augmentation
Répartition et quantification des allèles de résistance aux QoI en fonction des régions, exprimées en % moyen d'allèle de résistance aux QoI dans les échantillons de chaque région de 2008 à 2011. Les nombres indiqués dans les régions indiquent le nombre de parcelles analysées, correspondant à plusieurs échantillons.

 Imprimer
Imprimer