Symptômes caractéristiques... 1 - Suintements sur le tronc. 2 - Début d'un suintement. 3 - Fissures sur le tronc. 4 - Coupe d'une charpentière atteinte : les tissus sous-corticaux nécrosés sont visibles. 5 - Autre exemple de suintement sur le tronc. Photos : S. Quennesson, FREDON NPDC - ph. S. Quennesson, FREDON NPDC - ph. S. Quennesson, FREDON NPDC
En Europe du Nord-Ouest, une maladie bactérienne affecte des dizaines de milliers de marronniers. Dite chancre bactérien du marronnier, dépérissement bactérien ou chancre suintant, elle provoque d'importants dommages dans les paysages urbains et ruraux ainsi que les espaces forestiers. La progression de cette affection décelée au tournant du siècle inquiète les producteurs et gestionnaires d'arbres. Faisons le point.
Une maladie émergente
Années 2000
La maladie, caractérisée par la présence de suintements et de chancres sur le tronc et les branches des marronniers, et qui peut entraîner leur dépérissement généralisé menant certains sujets à la mort en 2 à 5 ans, était inconnue ou passée inaperçue jusqu'au début des années 2000. En France, le premier foyer a été détecté en 2001 dans le Nord-Pas-de-Calais.
Actuellement
Aujourd'hui, les observations réalisées par les gestionnaires de jardins et espaces verts publics membres de l'AFDJEVP, association appelée désormais Hortis(1), montrent la dispersion de cette affection à Lille, Croix, Tourcoing, Roubaix, Armentières, Gravelines, Grande-Synthe, Douai, Loos-en-Gohelle...
Au-delà du Nord-Pas-de-Calais, des symptômes de chancres suintants sont signalés par le réseau des FREDON(2) notamment dans les régions Picardie, Ile-de-France, Basse-Normandie et Champagne-Ardenne.
Et ailleurs dans le monde
Dans les pays voisins, des cas similaires à ceux des marronniers en France se sont manifestés au cours des années 2000, en Belgique, aux Pays-Bas, en Grande-Bretagne et en Allemagne. La maladie est aujourd'hui également présente en Irlande et Norvège.
À noter : l'épidémie est localisée principalement dans des régions soumises à des conditions climatiques relativement douces et humides.
La cause principale identifiée
Pseudomonas syringae incriminée
Un champignon du genre Phytophthora avait tout d'abord été suspecté. Mais cette hypothèse a été réfutée depuis l'isolement de la bactérie Pseudomonas syringae pathovar aesculi associée aux cas de chancres suintants.
P. syringae est une espèce bactérienne comprenant plus de 50 pathovars qui peuvent infecter une large gamme de plantes, principalement des espèces herbacées mais aussi quelques plantes ligneuses.
Le pathovar aesculi, spécifique du marronnier
Parmi les pathovars capables de provoquer des lésions sur le tronc et les branches des arbres, on retrouve P. syringae pv aesculi qui se développe spécifiquement sur le marronnier, mais aussi, par exemple, P. syringae pv morsprunorum sur arbres fruitiers et P. syringae pv actinidiae, bactériose émergente sur le kiwi (Actinidia spp.)
Avant sa récente manifestation en Europe, le pathovar aesculi n'avait été signalé que dans le nord de l'Inde (1969), la bactérie ne causant alors que des lésions foliaires mineures sur le marronnier Aesculus indica. Les souches européennes ne sont que très légèrement différentes du type indien.
P. syringae pv aesculi n'est pas un organisme nuisible réglementé dans l'Union Européenne. Mais, vu la sévérité de ses attaques et la vitesse de sa propagation, l'OEPP(3) l'a inclus depuis 2009 dans la liste d'alerte qui permet à l'organisation d'attirer l'attention de ses pays membres sur le risque potentiel lié à certains bioagresseurs.
La maladie représente en effet un danger, notamment pour le marronnier blanc Aesculus hippocastanum. Or cette espèce, introduite en France vers 1615 en provenance des Balkans, constitue aujourd'hui une part importante de notre patrimoine arboré.
Actions entreprises pour mieux connaître cette maladie
Programmes de recherche
Pour acquérir les connaissances indispensables à la gestion de cet agent pathogène émergent, différents suivis et programmes de recherche sur la symptomatologie, l'épidémiologie et les méthodes de lutte ont été mis en place.
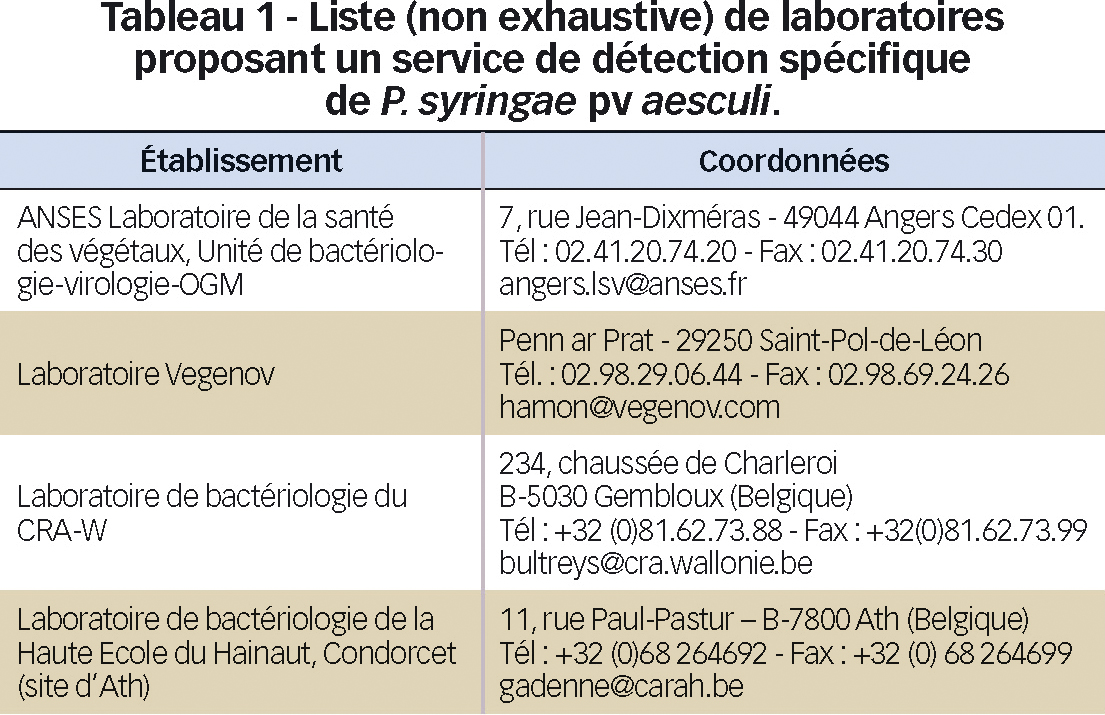
Aux Pays-Bas, les recherches sont menées au sein du Wageningen University and Research Centre. Au Royaume-Uni, plusieurs structures interviennent, notamment des universités et la Commission nationale sur les forêts (UK Forestry Commission - Forest Research). En Belgique, ce sont le CRA-W de Gembloux et la Haute école Condorcet d'Ath.
Par ailleurs, des laboratoires spécialisés en bactériologie ont étudié les méthodes de détection de P. syringae pv aesculi et proposent des analyses adaptées au marronnier.
En France, inventaires et suivis
En France, des inventaires et suivis spécifiques de plantations sont réalisés par les collectivités, comme à Paris, Lille ou Roubaix, parfois avec l'appui de bureaux d'études spécialisés en arboriculture ornementale.
Les inventaires permettent de répertorier les arbres malades, de juger des possibilités de maintien en place des sujets ou parfois de la nécessité d'abattage en cas de danger potentiel dû à un dépérissement trop avancé.
Les suivis permettent aussi de mieux appréhender la variabilité des symptômes caractéristiques et de tenter d'identifier les facteurs possibles favorisant le développement et la dispersion de la maladie.
Le rôle des FREDON : surveillance biologique du territoire, études et diffusion des connaissances
De leur côté, les FREDON réalisent une surveillance de la progression de ce dépérissement bactérien à l'échelle des régions françaises métropolitaines.
Les réseaux régionaux de surveillance biologique du territoire (SBT), conduits en collaboration avec des professionnels volontaires, donnent lieu à l'édition d'informations dans les Bulletins de santé du végétal (BSV).
Ces réseaux permettent de détecter au plus tôt les symptômes et, le cas échéant, de révéler la présence de la bactérie par des analyses en laboratoire.
En complément, certaines FREDON apportent un appui à la profession par la mise à disposition d'outils d'aide au suivi et par la diffusion des connaissances concernant l'épidémiologie et les méthodes de lutte.
Dans le Nord-Pas-de-Calais, cette action fait partie du programme de la Station d'études sur les luttes biologique, intégrée et raisonnée de la FREDON.
Elle est menée grâce au financement du Conseil Régional. Dans ce cadre, une fiche d'aide à l'observation a été publiée en 2008. Cette fiche est en cours de réactualisation.
Enquête Plante et Cité de 2012
Enfin, Plante et Cité a réalisé en 2012 une enquête auprès d'un panel de collectivités françaises, afin de collecter des informations sur les caractéristiques environnementales et culturales des arbres au sein des foyers recensés.
Les connaissances ainsi acquises sur l'épidémiologie de la bactérie devraient permettre d'améliorer la prophylaxie et d'élaborer des plans de gestion adaptés.
Des symptômes divers
Des suintements
La maladie est caractérisée par la formation de suintements et de chancres sur le tronc et les branches.
Les lésions débutent au niveau des tissus sous-corticaux et vont jusqu'au cambium (ph. 4) ; la zone sous-corticale correspond aux tissus vivants de l'écorce interne (tissus conducteurs du phloème). En revanche, le bois (ou xylème) n'est pas atteint. Ces premières attaques peuvent passer inaperçues un certain temps. Une fois que les tissus internes ont été touchés et partiellement détruits, les premiers symptômes externes se manifestent sous forme de gouttes de liquide collant exsudées à partir des zones attaquées (ph. 2). Ces suintements peuvent devenir abondants et prendre la forme de coulures très visibles, de couleur rouille, jaune marron ou presque noir (photos 1 et 5). D'abord liquides ou gommeux, ils finissent par sécher et former une croûte friable.
Ils apparaissent souvent au printemps et à l'automne. Au cours de ces périodes, la végétation est active et l'humidité souvent élevée, ce qui pourrait favoriser l'activité de la bactérie. Des suintements ont également pu être observés en été.
Des fissures d'écorce
Au niveau de l'écorce, les tissus atteints se dessèchent. L'écorce peut alors se fissurer suite à la croissance de l'arbre, donnant naissance à des fissures longitudinales caractéristiques (ph. 3). Elle peut aussi finir par se décoller.
Les fissures peuvent apparaître dès la première année suivant l'infection ou bien dans les années suivantes, en fonction de différents paramètres (état général de l'arbre, importance de l'infection, climat, etc.). Elles semblent plus fréquentes sur les sujets relativement jeunes, à fort développement du diamètre du tronc et des branches. En revanche, les gros arbres, à croissance plus lente, peuvent développer tardivement des fissures et il est plus difficile d'y détecter précocement une attaque. Leur examen attentif est donc recommandé.
Blocage de la circulation de la sève élaborée
Les tissus touchés et morts bloquent la circulation de la sève élaborée, de façon partielle ou totale (en cas d'encerclement du tronc ou d'une branche).
Il s'ensuit des symptômes au niveau de la couronne : jaunissement du feuillage, chute prématurée de feuilles et éventuellement mort de l'arbre (photo page 40). Chez les sujets atteints d'un dépérissement chronique, les feuilles peuvent aussi être plus petites, minces et molles que celles des arbres sains.
Évaluer la gravité de la maladie et la stabilité de l'arbre
Pourquoi il faut observer l'ensemble de l'arbre
Pour détecter la maladie ou évaluer sa gravité, il faut observer le tronc mais aussi les branches car la bactérie peut commencer son développement à différents niveaux y compris sur la couronne. Un même arbre peut présenter en même temps différents types de symptômes, diversement avancés selon les endroits. Plus l'intensité des symptômes avancés est importante, plus l'arbre est en danger. En général, les surfaces sous-corticales atteintes, visibles après écorçage, sont bien supérieures à ce que laisse présager l'observation externe.
Sur quels critères se baser pour décider d'abattre, ou non, un arbre
En présence de dommages dus au chancre bactérien, la difficulté consiste à décider des mesures à prendre. L'abattage n'est pas systématique. Selon les préconisations de la Commission des Forêts britannique, les arbres présentant des suintements légers à modérés et une couronne vigoureuse peuvent être laissés en place et maintenus sous surveillance. Certains de ces sujets peuvent vivre encore plusieurs années si la maladie progresse très lentement ou cesse sa progression.
En revanche, si les lésions sont étendues et ceinturent entièrement le tronc, l'arbre est condamné et devra être abattu.
Penser à la taille des branches dangereuses
De même, les branches principales affectées et présentant un dépérissement doivent être supprimées.
En effet, même si la maladie ne dégrade pas directement le xylème, tronc et branches sont susceptibles de se fracturer suite à l'attaque secondaire de micro-organismes fragilisant le bois. Les fissurations de l'écorce sont des ouvertures facilitant l'infection par des champignons lignivores. Notons d'ailleurs que le bois de marronnier se distingue par la vitesse avec laquelle il perd ses qualités mécaniques.
Les marronniers malades maintenus en place doivent donc être surveillés, parfois en complétant les observations externes par des tests de résistance du bois (sondage au tomographe ou au pénétromètre).
Des carpophores apparaissent parfois à la surface de l'écorce morte, faisant saillie à partir des craquelures. L'identification du champignon à partir de ces organes permet de mieux connaître sa virulence potentielle.
Le chancre bactérien peut entraîner indirectement un risque pour la sécurité d'un site. Il convient pour le gestionnaire d'être vigilant et réactif.
Confirmation de la présence de la bactérie
L'analyse en laboratoire, pourquoi ?
Les symptômes caractéristiques de P. syringae pv aesculi peuvent être facilement confondus avec ceux d'autres maladies ou problèmes abiotiques. Ainsi, les attaques d'armillaire, de Phytophthora ou de Fusarium peuvent entraîner des suintements sur le tronc. L'échaudure ou nécrose corticale orientée, due à un stress climatique, entraîne des fissures et décollements de l'écorce, essentiellement sur la partie du tronc orientée au sud-ouest.
Pour mener à bien l'évaluation des arbres, il est donc indispensable de réaliser le bon diagnostic. Pour cela, un prélèvement et une analyse de laboratoire sont parfois nécessaires.
Aujourd'hui, plusieurs laboratoires proposent un service de détection spécifique de P. syringae pv aesculi (Tableau 1).
Prise d'échantillons pour analyse, choix de la zone de prélèvement
La prise d'échantillons est une étape essentielle. L'objectif est de prélever des tissus végétaux contenant la bactérie vivante. Pour cela, les tissus très abîmés ou secs correspondant à d'anciennes nécroses ne sont pas propices. En effet, des chercheurs néerlandais ont suivi le développement de la bactérie après inoculation artificielle : au niveau du point d'infection initial, les tissus secs ne contenaient plus l'agent pathogène, alors qu'en marge de l'infection la bactérie a pu être facilement réisolée à partir des tissus végétaux vivants.
Sur les plantations, l'échantillon sera donc prélevé dans une zone du « front de nécrose » (ph. 3). P. syringae pv aesculi se localisant au niveau du liber et du cambium, il est important que ces zones fassent partie du prélèvement. Celui-ci doit intervenir au niveau d'une lésion jeune suintante présentant un écoulement frais.
Mode opératoire
L'écorce superficielle est pelée à l'aide d'un ciseau à bois ou d'une varlope pour observer les tissus sous-jacents. Après écorçage, la limite entre la zone saine de l'écorce interne, de couleur claire, et la zone nécrosée, de couleur brune, est clairement visible (ph. 3). Le prélèvement doit être fait au niveau de cette limite. Il correspond à un rectangle de 2,5 cm X 5 cm, longeant le front de nécrose, et allant en profondeur jusqu'au bois.
Lorsque cela est possible, le nombre et la taille des prélèvements (jusqu'à 5 x 10 cm) seront augmentés pour améliorer les chances d'isoler la bactérie.
Technique peu intrusive à l'étude
Pour éviter de créer une blessure importante sur l'arbre, une technique peu intrusive est étudiée par le laboratoire de la Haute Ecole Condorcet d'Ath (Belgique).
Il s'agit de réaliser un carottage à l'aide d'une tarière de Pressler de 0,5 cm de diamètre (ph. 1). Après avoir enlevé l'écorce externe, la tarière est enfoncée sur 1 à 2 cm de profondeur.
Pour augmenter la probabilité de détecter la bactérie, le prélèvement peut être répété sur 2 ou 3 zones.
Important : désinfecter les outils
Pour éviter les risques de transmission de la maladie d'un arbre à l'autre, le Laboratoire de la santé des végétaux de l'ANSES(4) conseille de désinfecter les outils entre deux prélèvements à l'aide d'eau de Javel diluée à 2° chlorométrique, avec un temps d'action de 3-4 minutes, puis de les rincer à l'eau et de les essuyer.
Une autre technique, utilisée par le CRA-W, consiste à désinfecter les outils à la chaleur de la flamme d'une lampe à souder durant 5 à 10 secondes.
Et ensuite ? La PCR, bien sûr !
La méthode d'identification la plus employée est l'amplification génique par PCR, réalisée sur des colonies de bactéries préalablement isolées sur milieu de culture, voire parfois directement à partir de l'échantillon prélevé. Seules des analyses de ce type permettent une identification précise jusqu'au pathovar.
Que sait-on de l'épidémiologie ?
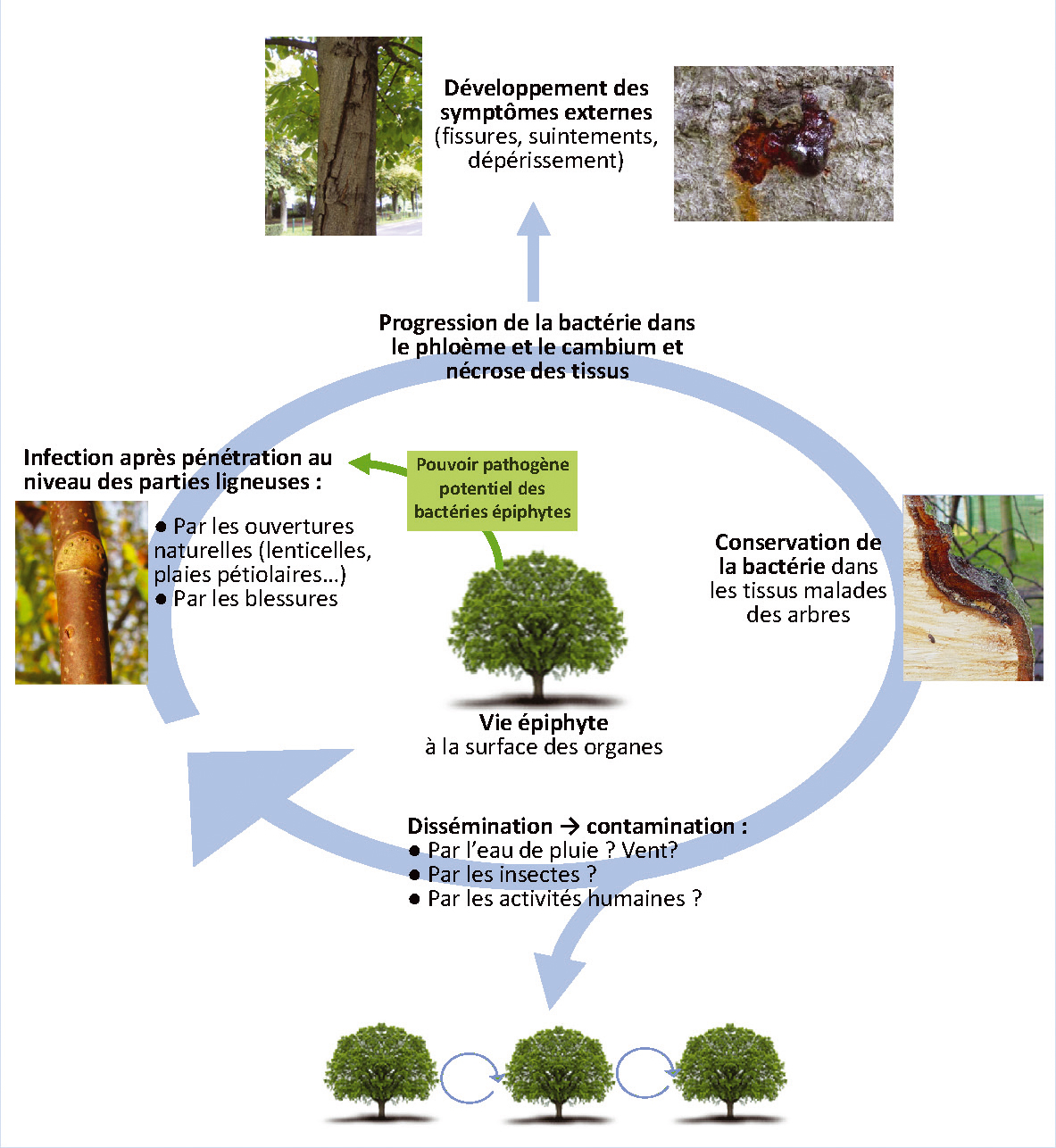
Bactérie épiphyte, c'est-à-dire vivant sur les plantes sans causer de symptômes...
Parallèlement à son comportement pathogène, P. syringae est capable d'assurer des cycles de vie non infectieux, en se maintenant à la surface des plantes. On parle de cycles épiphytes, au cours desquels la bactérie peut vivre, se nourrir et se multiplier, en utilisant son hôte végétal comme simple support et sans provoquer de symptômes apparents.
Sur marronnier, des chercheurs ont ainsi montré que la bactérie pouvait être présente à la surface d'arbres d'apparence saine au niveau des feuilles, fleurs, branches et fruits, sans avoir d'action néfaste mais en gardant son pouvoir pathogène potentiel.
... Mais pathogène si elle pénètre dans les tissus ligneux
En effet, si elle pénètre dans les tissus ligneux, elle est capable de provoquer des dépérissements caractéristiques, ce qu'ont montré des tests d'inoculation artificielle sur plantules.
D'une manière générale, la pénétration des bactéries dans les plantes se produit souvent par des ouvertures naturelles ou bien par des blessures causées par les frottements, la grêle, l'élagage, le gel, le vent, les animaux...
Il lui faut des portes ouvertes
Dans le cas de P. syringae pv aesculi sur marronnier, des observations sur des sujets infectés naturellement par l'agent pathogène ont montré que les premières lésions sont centrées principalement au niveau des lenticelles, des plaies pétiolaires et des striures de l'écorce aux points d'insertion des branches. Ces zones représentent de nombreuses portes d'entrée naturelles possibles.
Certains auteurs évoquent aussi les fissures liées à la croissance en épaisseur du tronc comme voies de pénétration potentielle. Par ailleurs, les chercheurs ont montré que des blessures mineures infligées à de jeunes marronniers, comme une simple piqûre d'aiguille ou une abrasion de l'écorce, sont suffisantes pour permettre l'entrée de la bactérie et l'infection des plantes.
Mode d'infection et de progression de la bactérie dans un arbre atteint
Ainsi, contrairement à certaines souches de P. syringae affectant les arbres, la bactérie spécifique du marronnier européen ne semble pas infecter les plantes par les feuilles et autres parties molles, mais elle envahit directement les parties ligneuses des troncs et branches d'âge varié.
La bactérie peut certainement infecter le marronnier à différentes saisons. Mais la fin de l'été et l'automne sont probablement particulièrement favorables, notamment lors de la chute des feuilles. L'agent pathogène crée les premières nécroses dans le phloème et le cambium durant l'arrêt de végétation en hiver, comme l'ont montré des chercheurs britanniques grâce à des observations morphologiques et histologiques réalisées de 2003 à 2009 sur des branches et des arbres entiers infectés naturellement.
Par ailleurs, des tests en conditions d'infection artificielle réalisés par le CRA-W de Gembloux sur de jeunes marronniers ont montré que la propagation bactérienne dans les tissus des arbres était 7 fois plus importante à la fin de l'hiver et au début du printemps qu'au printemps et en été.
L'agent pathogène peut rester actif dans les lésions, au niveau du front de nécrose, pendant plusieurs années. Ceci représente une possibilité d'infection systémique au cours des années suivant la colonisation initiale (transport de la bactérie au sein de l'arbre par les vaisseaux conducteurs).
Effectivement, la morphologie des chancres, en forme de spirales et suivant la direction des tissus vasculaires, suggère que P. syringae pv aesculi est dispersé par le phloème voire par le xylème. Cependant, ce dernier ne subissant pas de nécroses, son rôle n'est pas éclairci bien que la bactérie ait pu y être détectée.
Vecteurs de dispersion : les hypothèses
L'eau, les insectes...
Concernant la dispersion de la bactérie d'un marronnier à l'autre, il serait intéressant de connaître le rôle possible de l'eau, des insectes et des activités humaines.
Les hypothèses de travail sont basées sur les connaissances concernant P. syringae sur d'autres espèces végétales.
Ainsi, les souches de l'espèce P. syringae sont connues pour être dispersées par les éclaboussures de pluie en conditions venteuses. P. syringae pv aesculi a d'ailleurs été détectée dans les eaux de pluie aux alentours d'arbres malades. Par ailleurs, une étude a montré qu'elle peut survivre plusieurs mois sur des feuilles tombées et des morceaux de bois. Mais la nature précise du substrat de conservation (tissus végétaux vivants ou morts) n'est pas identifiée.
Les insectes visitant les fleurs de marronniers contaminées pourraient être d'autres vecteurs potentiels.
Et le matériel végétal ?
Enfin, de nombreuses bactéries pathogènes des arbres se conservent dans les chancres sur les parties ligneuses des plantes. Les États-Unis ont d'ailleurs pris des mesures de précautions pour éviter l'introduction de la maladie par des plants contaminés, en interdisant l'importation de plants de marronniers en provenance de tout pays excepté le Canada.
Les semences ne sont pas concernées par cette interdiction. Les chercheurs européens étudiant les graines de marronniers n'ont pas signalé à ce jour y avoir trouvé la bactérie en interne.
Penser aux outils
Outre les vecteurs naturels, les outils peuvent aussi participer à la dispersion de la maladie à l'occasion de travaux réalisés à proximité des arbres et d'opérations d'entretien (taille, etc.)
Influence des facteurs environnementaux
Mais qu'est-ce qui a changé ?
Jusqu'à une période récente, P. syringae était probablement présente sur nos marronniers sans y provoquer de symptômes notoires. On peut donc s'interroger sur les causes du changement opéré depuis une dizaine d'années avec la multiplication des cas de chancres suintants dus à la bactérie.
Des stress biotiques ou abiotiques ont-ils affaibli les marronniers, les rendant plus sensibles à ce Pseudomonas ? Ou bien s'agit-il d'un changement touchant l'agent pathogène lui-même, comme l'émergence d'une souche plus agressive ?
Études diverses, corrélations difficiles
Pour étudier l'influence des facteurs environnementaux, des suivis ont été mis en place aux Pays-Bas et en Grande Bretagne sur de larges échantillons de marronniers situés dans des habitats différents.
Les résultats ont montré une très grande variabilité de degré d'infestation et une difficile corrélation entre l'intensité de la maladie et les facteurs liés à l'environnement (sécheresse, dommages dus au sel, attaque par la maladie des taches rouges, attaques de mineuse, conditions de sol...). En revanche, il semblerait que les arbres présentent davantage de symptômes en ville et milieu rural qu'en milieu forestier.
Dans le Nord-Pas-de-Calais, un programme d'études mené par la Direction des parcs et jardins de la ville de Lille, la Haute Ecole Condorcet d'Ath et le bureau d'études Aliwen, avec la contribution de la FREDON, cherche à établir une corrélation entre le niveau d'infestation et les facteurs environnementaux et culturaux : mode de taille, proximité de voies de circulation, présence d'un milieu minéralisé autour des plantations.
Les premiers résultats montrent qu'il est difficile d'établir des corrélations.
Tout près, les travaux réalisés par le CRA-W à Bruxelles et en Wallonie, avec un financement de la Région Bruxelles-Capitale, vont également dans ce sens.
La protection contre la maladie : solutions actuelles et perspectives
Pour les futures plantations
Le choix des espèces et variétés à utiliser pour de nouvelles plantations d'Aesculus est une piste prioritaire pour limiter la multiplication des cas de chancres bactériens dans l'avenir. Les observations de terrain indiquent en effet que le marronnier blanc A. hippocastanum est très sensible à la maladie, en particulier la variété 'Baumanii'. Quant à la variété rouge A. x carnea 'briotti' qui paraît, selon certains observateurs, moins sensible, elle ne semble cependant pas être épargnée par la bactérie.
Il serait intéressant d'étudier l'intérêt potentiel des marronniers rouges greffés de pied par rapport aux sujets greffés en tête sur A. hippocastanum.
À partir des observations de terrain, il est parfois difficile de mettre en évidence les sensibilités spécifiques. Ainsi, sur la base d'un échantillonnage mis en place à Lille, il n'a pas été possible de montrer une corrélation statistique entre l'espèce et la sensibilité plus ou moins accrue vis-à-vis de la bactérie.
Pour les chercheurs, il est important d'étudier les différences de sensibilité interspécifiques, mais aussi les éventuelles différences intraspécifiques au sein de l'espèce A. hippocastanum, car celle-ci reste la plus fréquente et recherchée dans nos paysages. Des tests de laboratoire ont montré qu'A. x mutabilis, A. flava, A. parviflora et A. pavia semblent moins ou pas du tout sensibles par rapport au marronnier blanc. D'autres références devront encore être apportées pour permettre aux professionnels de faire les bons choix.
Pour les arbres en place, recherches en cours sur des substances protectrices et sur la chaleur
Les gestionnaires du paysage ont aussi besoin de solutions pour gérer les plantations actuelles. Des programmes d'expérimentation ont été menés pour juger de l'intérêt de certaines substances pour retarder le processus de la maladie sur les arbres atteints.
Les chercheurs ont testé l'acide ascorbique, la cystéine, l'acide citrique et le fluorure de sodium (NaF) pour vérifier leur effet inhibiteur sur la manifestation des symptômes, avec des résultats variables. Des études utilisant des substances d'origine naturelle sont également projetées.
Aux Pays-Bas, une technique de traitement à la chaleur (39 °C) a donné des résultats expérimentaux intéressants, mais elle doit être transposée en conditions de terrain pour être validée.
Essentielle prophylaxie
Aujourd'hui, les mesures prophylactiques restent essentielles pour protéger les plantations.
Selon la Commission des forêts de Grande-Bretagne, il est possible que la suppression des arbres malades réduise le risque d'infection des sujets sains dans une plantation comprenant seulement quelques sujets infectés. Cependant, cela reste incertain, vu la possibilité de vie épiphyte (sans symptôme) de la bactérie sur les parties aériennes des arbres sains.
Certains conseils peuvent être donnés :
– Supprimer l'écorce lésée ne constitue probablement pas une bonne solution car cela crée des blessures et peut favoriser la pénétration et/ou la dispersion de l'agent pathogène.
– Pour éviter la dissémination, il convient de désinfecter les outils lors du passage d'un arbre à l'autre.
– Lors d'interventions sur une plantation, il est préférable de commencer par les marronniers les moins atteints.
– Après abattage d'un arbre malade, le bois doit être évacué vers un site de destruction et éliminé rapidement (brûlage ou compostage). Si c'est impossible rapidement, les rondins peuvent être stockés avant destruction, mais sur un site éloigné des autres arbres.
– Enfin, sur les sites où la maladie est absente, il est préférable d'éviter de planter de jeunes marronniers pour éviter l'introduction de la bactérie pathogène ; en revanche sur les sites infectés, des espèces ou variétés peu sensibles seront plantées de préférence en remplacement d'arbres abattus.
Conclusion
La situation inquiétante du marronnier souligne l'intérêt des programmes de recherche visant à mieux comprendre la maladie et trouver des solutions préventives et curatives.
En attendant que ces solutions soient approfondies, la surveillance, l'évaluation et la gestion des plantations existantes sont nécessaires sur le terrain pour éviter les risques liés au dépérissement des arbres et aux possibilités de rupture de branches. Pour cela, de solides outils d'observation, de reconnaissance des symptômes, d'identification de la bactérie et d'évaluation du niveau d'attaque sont nécessaires.
La suppression des branches ou arbres devenus dangereux et la mise en place de mesures prophylactiques sont actuellement les principales pistes de gestion des arbres malades en espaces verts. Pour les nouvelles plantations, le choix d'espèces ou de variétés moins sensibles est essentiel mais des références manquent encore à ce jour. Au-delà des actions déjà entreprises, il est donc important de poursuivre la mobilisation des moyens et des compétences. Et ceci, que ce soit au niveau des structures de recherche ou à celui des pépiniéristes, arboristes et collectivités pour une multiplication des données de terrain venant compléter les résultats obtenus par les chercheurs.
<p>(1) Cette Association française des directeurs de jardins et espaces verts publics a changé son nom en Hortis, lors de son Assemblée générale des 11 et 12 octobre 2012.</p> <p>(2) Fédération régionale de défense contre les organismes nuisibles.</p> <p>(3) Organisation européenne et méditerranéenne pour la protection des plantes.</p> <p>(4) Agence nationale de sécurité sanitaire de l'alimentation, de l'environnement et du travail.</p>

 Imprimer
Imprimer