En Afrique, en Europe du Sud et au Moyen-Orient, le genre Spodoptera était jusqu'à présent représenté par huit espèces, dont trois d'importance économique : S. exempta, S. exigua et S. littoralis (Brown et Dewhurst, 1975). S. frugiperda s'ajoute à ce trio de ravageurs.
Le contexte
Alerte en 2016, puis identification
Début 2016, des agriculteurs de plusieurs pays d'Afrique de l'Ouest et du Centre ont été confrontés à un ravageur au comportement inhabituel dans les cultures de maïs. Des noctuelles du genre Spodoptera déjà présentes en Afrique ont d'abord été mises en cause. Mais le développement soudain de fortes populations de façon concomitante dans plusieurs pays a poussé les acteurs du milieu professionnel à vérifier précisément l'identité de l'insecte.
Ce contrôle a révélé l'établissement d'une noctuelle américaine au comportement invasif, Spodoptera frugiperda (J. E. Smith) (Goergen et al., 2016), dite chenille légionnaire ou légionnaire d'automne.
Il s'agit de la première incursion en dehors du continent américain de cette noctuelle réglementée par l'Union européenne, bien que des interceptions aient lieu régulièrement aux points d'entrée communautaires européens. Par exemple, il y a eu cinq interceptions en provenance du Suriname et du Pérou depuis début 2017 et une interception en provenance de Zambie en juin 2017 (Commission européenne 2017).
Origine et distribution
L'Amérique et ses îles
Cette noctuelle est originaire du Nouveau Monde où son aire de distribution permanente s'étend de l'Argentine au sud des États-Unis (Figure 1). Ses grandes capacités de déplacement permettent d'observer, en cas de conditions climatiques saisonnières propices, des migrations annuelles vers les États du nord des États-Unis et le Canada, à l'exception des États du nord-ouest américain et canadien. Elle est présente en Guyane, Martinique et Guadeloupe.
Sur le continent africain depuis 2016
Depuis son identification en Afrique début 2016, elle a été signalée dans une grande partie de l'Afrique subsaharienne.
En juillet 2017, elle était signalée en Afrique du Sud, au Bénin, au Botswana, au Burkina Faso, au Cameroun, en Éthiopie, au Cap-Vert, en Gambie, en Guinée, au Ghana, au Kenya, au Malawi, au Mali, au Mozambique, en Namibie, au Niger, au Nigeria, en Ouganda, en République centrafricaine, en République démocratique du Congo, à São Tomé-et-Principe, au Sénégal, au Swaziland, au Tchad, au Togo, en Zambie et au Zimbabwe (EPPO Glob. Database, 2017, Goergen com. pers.).
Cette expansion très rapide à travers le continent africain peut s'expliquer par les capacités particulières de dispersion de S. frugiperda. Celles-ci ne laissent que peu de doutes sur une proche colonisation de l'ensemble de l'Afrique subsaharienne.
Les plantes-hôtes
Cette espèce semble extrêmement polyphage. Ses hôtes majeurs sont le maïs (Zea mays), la canne à sucre (Saccharum officinarum), le sorgho (Sorghum bicolor), le riz (Oryza sativa), et au Brésil, le cotonnier (Gossypium hirsutum). Elle a une vingtaine d'hôtes mineurs, l'oignon (Allium cepa), l'arachide (Arachis hypogaea), les poivrons et piments (Capsicum annuum), le chrysanthème des fleuristes (Dendranthema x grandiflorum), les oeillets (Dianthus caryophyllus), la patate douce (Ipomoea batatas), la luzerne (Medicago sativa), le tabac (Nicotiana tabacum), les Pelargonium, le haricot (Phaseolus vulgaris), la tomate (Solanum lycopersicum), l'aubergine (Solanum melongena), et d'autres Brassicaceae, Cucurbitaceae et Poaceae.
Le site PlantWise cite davantage de plantes sans préciser si l'insecte peut y accomplir son cycle. Habituellement, les chenilles ont une préférence pour le végétal sur laquelle la prise alimentaire a débuté, donc dans la majorité des cas la plante support de la ponte.
Caractéristiques morphologiques
Les oeufs
De forme oblongue, les oeufs mesurent environ 0,4 mm de long sur 0,3 mm de large. Ils sont pondus et collés à la surface des feuilles en une masse de 100 à 300 oeufs, parfois davantage, 1 000 semble la capacité de ponte d'une femelle. La femelle recouvre la ponte d'écailles prélevées sur son abdomen, formant ainsi un feutrage protégeant les oeufs.
Les chenilles
Il y a cinq stades larvaires sous climat tropical, c'est-à-dire sous des températures supérieures à 25 °C, mais ils sont six, voire davantage, lorsque les températures sont inférieures à 25 °C.
Ils se différencient par la largeur de la capsule céphalique, de 0,35 mm pour le stade néonate et jusqu'à 2,6 mm pour le dernier stade. La taille varie de 1,7 mm pour le stade 1 à 17,2 et 34,2 mm pour les deux derniers stades.
La longueur de la chenille double à peu près entre chaque stade larvaire. La chenille néonate est verdâtre avec la tête noire. Les stades suivants deviennent de plus en plus bruns et des bandes sublatérales blanches plus ou moins nettes se forment. La tête devient rouge-brun tachetée de blanc.
Les trois premiers stades larvaires ne sont pas discernables des autres espèces du genre. En revanche, les stades suivants présentent des caractères morphologiques qui les différencient.
Les chenilles ne présentent pas de taches noires sur la face dorsale mais des pinaculas(1) noirs ornementés de soies. Les pinaculas des deux derniers segments abdominaux sont larges, disposés en carré sur le huitième segment abdominal et en trapèze sur le neuvième. La texture du corps est granuleuse. Au dernier stade, la tête montre un dessin en « Y » inversé. La couleur de la tête et celle du corps sont des caractères trop variables pour être pertinents (EPPO, 2015).
Les chrysalides
Brunes, plus ou moins luisantes, les chrysalides des noctuelles sont longues de 14 à 20 mm pour 4,5 mm d'épaisseur. Elles sont généralement protégées par un cocon formé de soie sécrétée par la chenille amalgamé à des éléments du sol.
Normalement enfoncée dans le sol, la chrysalide peut toutefois rester en surface quand le sol n'est pas suffisamment meuble. Aucune identification morphologique fiable autre que la différenciation des sexes sur les trois derniers segments abdominaux ne peut être réalisée à ce stade de développement. Des identifications moléculaires sont nécessaires.
Les adultes
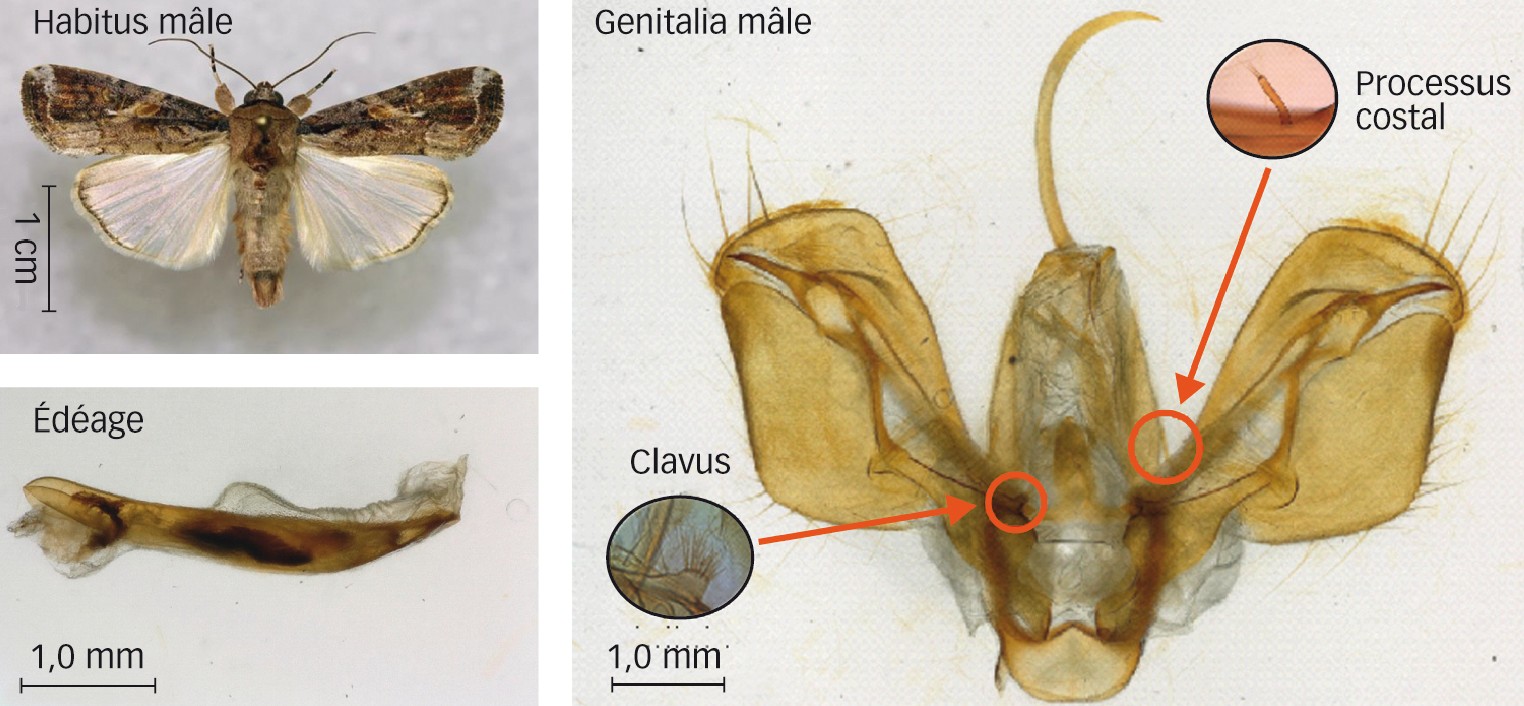
La noctuelle typique est d'un gris brun, de 32 à 40 mm d'envergure. Chez la femelle, les ailes antérieures sont variables, généralement d'un gris brun plus marquées de taches indistinctes blanchâtres. Plus constantes chez le mâle, elles sont plus sombres et présentent des taches de forme plus ou moins triangulaires à l'apex de l'aile et en partie médiane côté externe.
Les adultes de S. frugiperda peuvent être facilement confondus avec ceux de S. exempta ou de S. littoralis. Mais l'observation de la taille, de l'ornementation des ailes (quand elles sont en bon état), associées aux caractères morphologiques des génitalias mâles permet de les différencier (voir encadré page suivante). L'observation de ce dernier caractère reste le moyen le plus pertinent pour les identifier en l'absence d'alternative moléculaire (barcoding).
Les trois espèces d'importance économique présentes en Afrique et Europe du Sud peuvent s'en différencier par leur taille, mais surtout par deux éléments constitutifs des génitalias des mâles, le clavus et le processus costal.
Biologie et nuisibilité
Cycle de développement
Le cycle de développement de cette noctuelle dépend des conditions climatiques, et surtout du niveau des températures. Le développement embryonnaire se déroule en 3/4 jours. Le développement post-embryonnaire peut s'échelonner sur deux à quatre semaines et le stade nymphal sur sept à dix jours. Il n'y a pas de diapause chez cette espèce.
Dégâts et symptômes
Tous les stades de développement du maïs peuvent être attaqués mais les dégâts les plus sévères sont observés sur les jeunes plants. Les symptômes sont variables selon le stade de développement de la chenille.
Après l'éclosion, les jeunes chenilles râpent l'épiderme des feuilles, en laissant des fenêtres claires, symptômes qui peuvent être confondus avec ceux de chenilles foreuses de tiges. Les dégâts foliaires deviennent plus importants au fur et à mesure de la croissance des chenilles.
Au troisième stade, les chenilles se dispersent ou bien s'entredévorent, si bien que l'on peut se trouver alors avec un seul individu par plant de maïs, avec des excréments bien visibles dans le cornet foliaire. Les dégâts sur les épis de maïs peuvent être importants.
Les Américains évaluent les pertes monétaires en centaines de millions de dollars [300 à 500 par an pour les États-Unis (Mitchell, 1979), avec des pertes de rendements estimées de 5,4 % à 73 % (Cruz et Turpin, 1983 ; Hruska et Gould, 1997).
Risque d'introduction
En Europe et dans les DROM
Les premiers travaux sur des populations du Nigeria et de São Tomé-et-Principe suggèrent des voies d'introduction multiples (Goergen et al., 2016). Le risque apparaît le plus élevé pour les DROM de l'océan Indien, les îles de La Réunion et Mayotte. Le désert du Sahara et la mer Méditerranée constituent une barrière naturelle qui semble difficile à franchir mais le commerce international entre l'Afrique et l'Europe constitue une voie d'entrée à surveiller.
Comparaison climatique
L'absence de données biologiques précises dans son aire d'invasion ne permet pas la mise en oeuvre d'une modélisation bioclimatique sophistiquée. Une approche plus pragmatique a été retenue en utilisant la classification climatique de Köppen-Geiger (Hijmans et al., 2005).
À partir de 115 données de localisation issues de recherches bibliographiques, il a été possible d'affecter chacune à un type climatique et d'évaluer ainsi le risque d'établissement de S. frugiperda dans le Bassin méditerranéen (Figure 2). Les autres critères de risque (disponibilité des plantes-hôtes, pratiques agricoles, etc.) ne sont pas pris en compte.
Le climat qui apparaît le plus favorable pour S. frugiperda est de type tropical à saison sèche en période froide. Ce climat est considéré comme à risque très élevé d'établissement. Il n'est pas représenté dans le Bassin méditerranéen (absence de la couleur rouge sur la carte de la Figure 2), mais le papillon se développe également fréquemment en climat tempéré humide avec ou sans saison sèche en hiver, sous condition qu'il y ait des étés chauds. Le risque d'établissement y est alors potentiellement élevé (couleur orange sur la carte).
Plus rarement, des signalements sont notés pour des climats tropicaux humides ou équatoriaux ainsi que pour des climats à étés tempérés (risque notable : couleur jaune). Des cas encore plus sporadiques se trouvent en climats arides ou sous des climats tempérés sans saison sèche, ils sont classés à risque faible (représentés en couleur vert clair dans la Figure 2).
Dans un scénario où Spodoptera frugiperda franchirait la barrière du Sahara, alors le Bassin méditerranéen serait à risque notable d'établissement, du Maroc à la Tunisie ainsi que du Portugal à la Grèce. La France serait concernée dans une certaine mesure pour sa partie la plus méditerranéenne.
Cependant, compte tenu des capacités migratoires de l'insecte, il n'est pas exclu, en analogie à la situation observée dans le Nouveau Monde, d'assister dans le futur à des migrations annuelles régulières bien plus au nord dès que les températures le permettent.
Cette espèce remonte toutes les années jusqu'aux frontières du Canada, causant des dégâts dans des régions pourtant fortement enneigées durant l'hiver.
Difficultés de maîtrise des populations
Des résistances aux insecticides
Face aux deux stratégies de lutte passant par l'utilisation de pesticides de synthèse ou de plantes génétiquement modifiées (maïs Bt) en Amérique du Nord, l'insecte a développé de nombreuses résistances.
L'existence de différentes populations ou souches a été mise en évidence aux États-Unis avec une souche « C » préférentiellement présente sur maïs et cotonnier et une souche « R » dominante sur riz, mil et graminées sauvages (Pashley, 1988).
La présence de ces deux dernières sur le continent africain a été récemment mise en évidence (Nagoshi et al., 2017). Des différences peuvent exister entre ces souches quant à leur sensibilité aux insecticides (Busato et al., 2006) ou dans les cas des plantes génétiquement modifiées, aux toxines de Bacillus thuringiensis (Adamczyk et al., 1997).
Plan d'action à l'étude
Actuellement, pour le continent africain, un plan d'action mobilisant les partenaires nationaux et internationaux est à l'étude sous la coordination de la FAO. En dehors de la coordination, il prévoit des activités réparties selon quatre axes :
- le développement d'un système de surveillance et d'alerte précoce ;
- l'évaluation de l'impact ;
- la mise en oeuvre d'une stratégie de lutte intégrée basée sur des recommandations de mesures de contrôle de l'insecte comprenant des interventions reposant sur des seuils de décision, avec différentes options de pesticides et de biopesticides, la lutte biologique, des mesures de lutte culturale et mécanique, la résistance variétale ;
- la communication et le renforcement des capacités (formations).
Au niveau réglementaire, S. frugiperda est un insecte réglementé en Europe, présent sur la liste I/A1 de l'UE et A1 de l'OEPP, A1 en Russie, Turquie et Ukraine.
Conclusion
Une vigilance particulière est à déployer vis-à-vis de cette espèce réglementée, notamment dans le sud de l'Europe (Jeger et al., 2017). Si l'espèce passait la barrière du Sahara et s'établissait en Afrique du Nord, des remontées de populations estivales vers l'Europe pourraient avoir lieu avec un impact possible dans les régions productrices de maïs et de riz.
Certes, cette hypothèse est tempérée par le fait que ces populations ne deviendraient abondantes qu'à la fin de l'été et en automne (« légionnaire d'automne ») sans possibilité de résister à l'hiver. Mais elles pourraient occasionner des dégâts.
(1) Papille élargie en plaque portant des soies.
Fig. 1 : Distribution permanente actuelle de Spodoptera frugiperda
Des adultes peuvent migrer dans d'autres zones sans que l'espèce s'y établisse.

 Imprimer
Imprimer