Ci-contre, aspect des dépérissements de jeunes vignes qui ont déclenché le travail rapporté ici : 1 - Défoliation de rameaux. 2 - Décolorations foliaires. 3 - Apoplexie. En médaillon en haut, l'aboutissement du test de pathogénie.

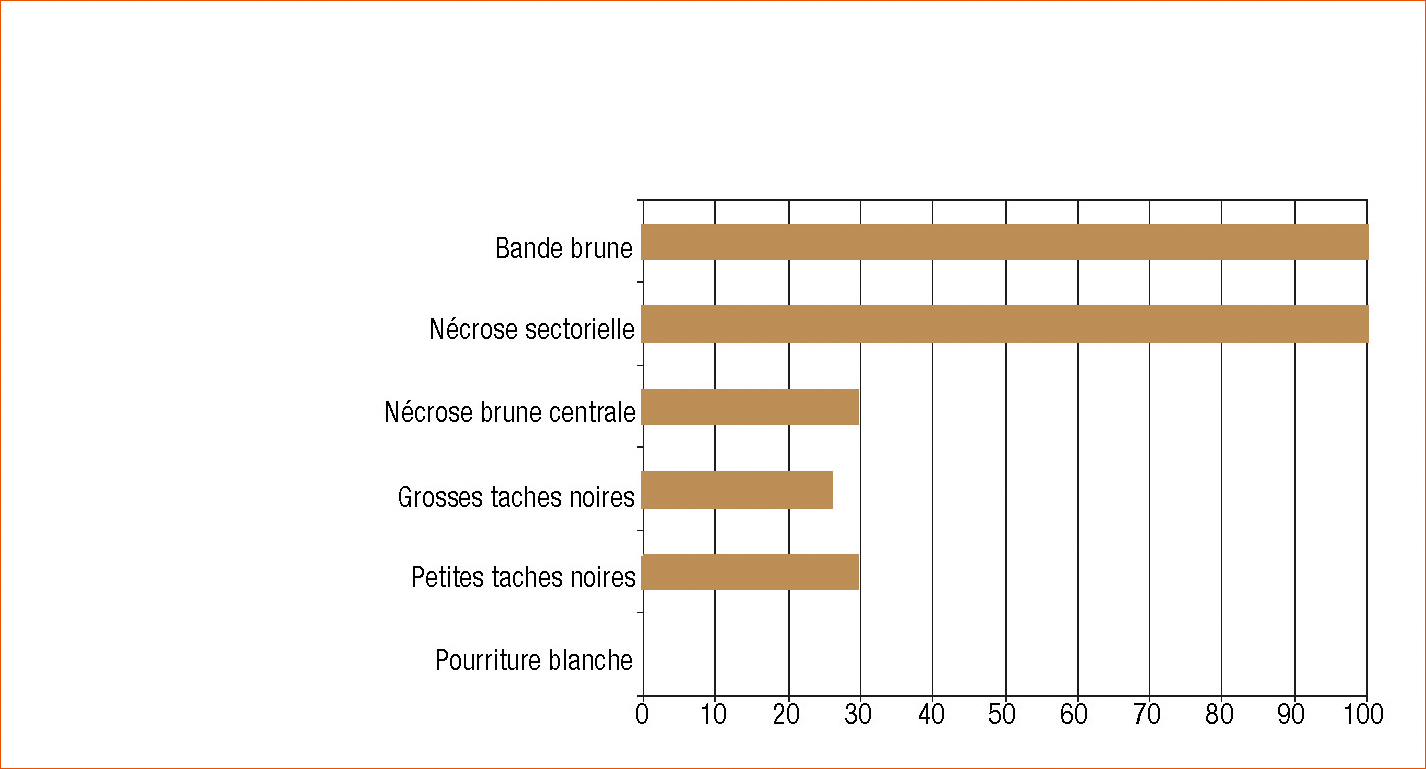
Ici, coupes transversale de ceps touchés : 5 - Nécrose en position sectorielle de couleur gris-brun, symptôme là encore trouvé sur tous les ceps. L'ellipse montre de grosses ponctuations noires. 6 - Nécrose en position centrale. Les flèches noires indiquent la bande brune et la flèche blanche le phloème. (Sur toutes les photos). 7- Nécrose très développée au niveau de la soudure La flèche noire indique la bande brune.
Non loin d'Aix-en-Provence, de jeunes vignes âgées de deux à six ans se sont mises à dépérir. Il s'agissait apparemment d'une maladie du bois, mais laquelle ? Pour le savoir, il fallait examiner les symptômes, isoler le ou les champignons présents dans le bois mais aussi effectuer des tests de pathogénie. Ces tests consistent à vérifier si un champignon isolé est vraiment pathogène (pouvant induire des symptômes à lui seul) et pas un simple opportuniste incapable de causer la maladie mais s'installant dans des bois affaiblis par d'autres agents. Le travail a été fait. Bilan : un champignon particulier est présent dans plus de 90 % des bois malades, il est connu comme pathogène sur d'autres végétaux que la vigne et comme lié au syndrome du black dead arm (BDA) sur vigne adulte, et il s'est effectivement montré pathogène sur jeunes vignes. Démonstration.
En France, les maladies du bois qui affectent les jeunes plantations sont peu connues. Seule la maladie du pied noir a été observée, surtout dans le vignoble champenois ou cognaçais. Elle est due au champignon Neonectria liriodendri.
Récemment, dans le vignoble des Côtes de Provence Sainte-Victoire ou des Côteaux d'Aix-en-Provence, des dépérissements ont été observés sur des jeunes plantations âgées entre 2 et 6 ans en provoquant d'importants dommages. De jeunes parcelles peuvent être touchées jusqu'à 30 %. Notre objectif est d'identifier les causes de ce dépérissement.
Symptomatologie
Les photos 1, 2 et 3 montrent ces dépérissements. Ils sont caractérisés le plus souvent par une défoliation des rameaux (ph. 1) qui peuvent se dessécher totalement ou partiellement par la suite. Pour les rameaux moins atteints, les feuilles peuvent montrer des décolorations (ph. 2). Dans les cas les plus sévères, la végétation se dessèche complètement (ph. 3) conduisant à la mort du greffon. Des redémarrages de la végétation sont parfois observés au niveau du porte-greffe.
Nous avons réalisé des coupes du bois de ces vignes (Figure 1). Les symptômes observés sont surtout des bandes brunes situées sous l'écorce (photos 4 à 7) et des nécroses sectorielles de couleur brun-gris (ph. 5), surtout développées au niveau du point de greffe notamment pour les cas les plus graves (ph. 7). L'observation microscopique montre que le bois de printemps nouvellement formé est caractérisé par un grand nombre de vaisseaux bouchés par des gommes et des thylles (ph. 8).
Analyses microbiologiques
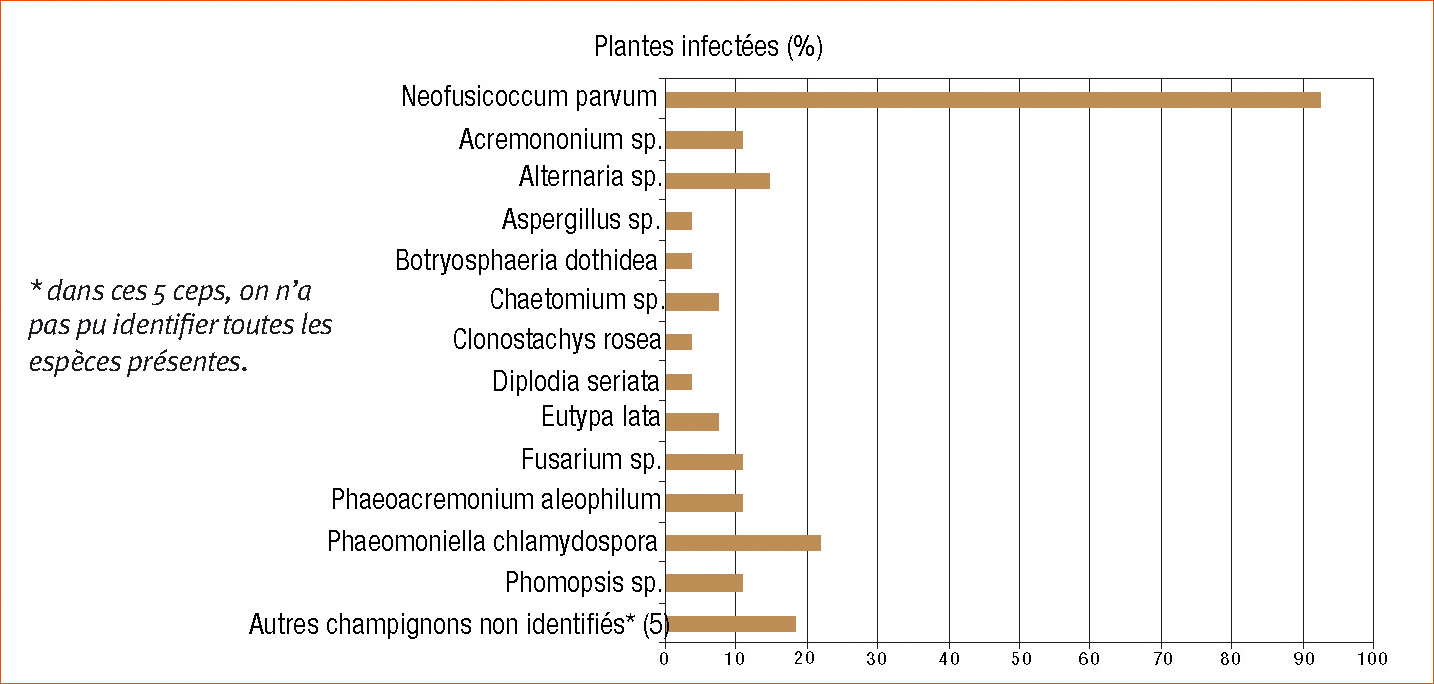
Les analyses microbiologiques réalisées selon la méthode de Larignon et Dubos (1997) ont été conduites sur 27 plantes prélevées sur huit parcelles (4 parcelles de Grenache/R110, 1 de Cinsault/R110, 1 de Syrah/3309, 1 de Grenache/R140, et 1 de Sauvignon/Fercal).
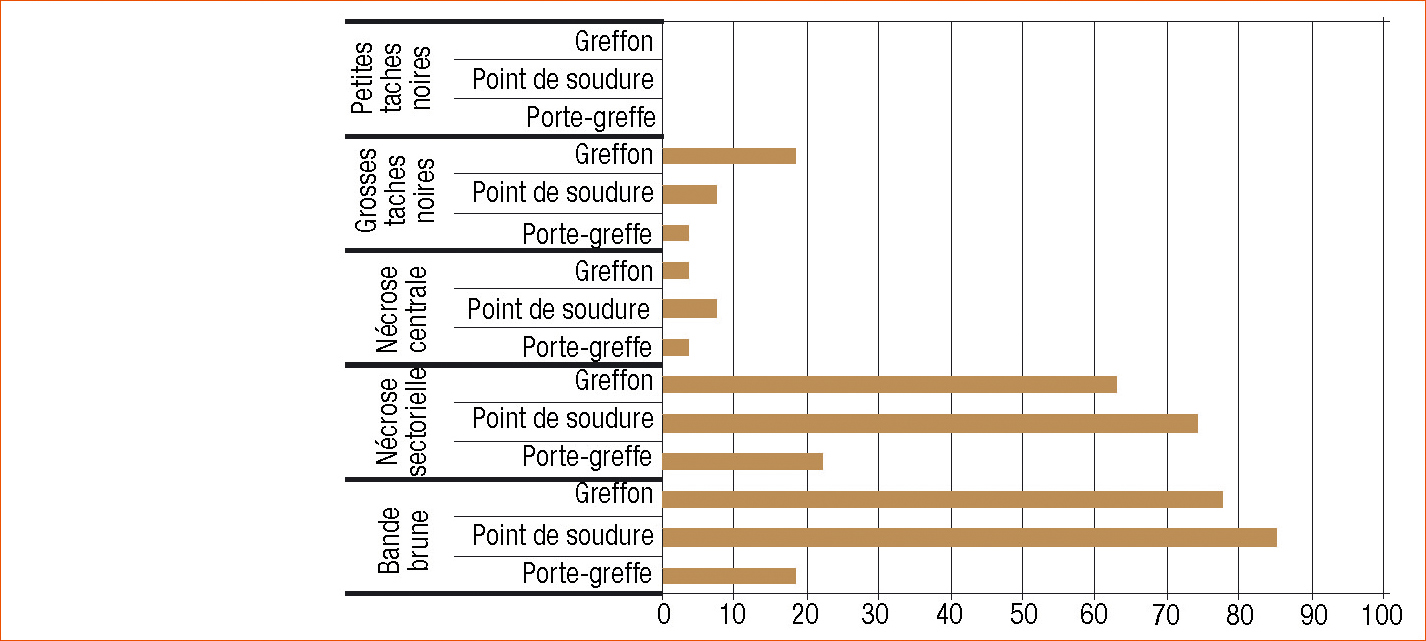
Ces analyses montrent surtout la présence du champignon Neofusicoccum parvum (Figure 2). Il est trouvé dans 92,6 % des plantes analysées (25 ceps sur 27). Il est surtout localisé dans des nécroses sectorielles et des bandes brunes au niveau du greffon et du point de greffe (Figure 3). D'autres champignons sont trouvés mais à des fréquences relativement faibles (Figure 2) : Acremonium sp. (11 %), Alternaria sp. (14,8 %), Aspergillus sp. (3,7 %), Botryosphaeria dothidea (3,7 %), Chaetomium sp. (7,4 %), Clonostachys rosea (3,7 %), Diplodia seriata (3,7 %), Eutypa lata (7,4 %), Fusarium sp. (11 %), Phaeoacremonium aleophilum (11 %), Phaeomoniella chlamydospora (22 %), Phomopsis sp. (11 %) et 5 espèces non identifiées (3,7 % chacune).
Tests de pathogénie
Les tests de pathogénie ont été réalisés sur des boutures de Sauvignon à deux yeux. Le mycélium de Neofusicoccum parvum (isolat Montagne Sainte-Victoire) a été déposé sur la surface des boutures et sur les plaies d'éborgnage et de débitage.
Ce matériel végétal ainsi préparé a été mis à stratifier dans des récipients contenant de l'eau durant deux semaines à une température de 28 °C et à humidité saturante. Après cette période, les boutures ont été plantées dans des pots et conservées jusqu'à la manifestation de symptômes sur la partie herbacée.
Sur les 20 plantes élevées en pot après quatre mois de culture, 13 ont présenté des desséchements de la végétation (ph. 9). Ces plantes présentent d'importantes nécroses dans le bois (ph. médaillon p. 44) dans lesquelles le champignon a été retrouvé. Sa capacité à provoquer des nécroses dans le bois ou sur la partie herbacée chez la vigne a été constatée par d'autres auteurs (Larignon et al., 2001 ; van Niekerk et al., 2004 ; Rego et al., 2008 ; Lavaux et al., 2009 ; Urbez-Torres et Gubler, 2009). Ce champignon est également décrit comme pathogène chez un grand nombre de plantes : le manguier (Javier-Alva et al., 2009), l'avocatier (Zea-Bonilla et al., 2007 ; McDonald et al., 2009), l'eugénie (Ploetz et al., 2009), le myrtillier (Espinoza et al., 2009), etc.
Cohérence
De ces études (analyses microbiologiques, tests de pathogénie), nous pouvons dire que N. parvum est responsable du dépérissement observé dans le vignoble des Côtes de Provence Sainte-Victoire ou des Côteaux d'Aix-en-Provence. Les symptômes décrits (défoliation de rameaux et leur partiel ou total dessèchement, décolorations sur les feuilles, bandes brunes, nécroses en position sectorielle de couleur grise) sont identiques à ceux du black dead arm observé sur les vignes adultes (Larignon et Dubos, 2001), auquel ce champignon a été déjà associé (Larignon et al., 2001).
La forte similitude des symptômes et la présence du même microorganisme suggèrent de façon cohérente que le dépérissement observé chez les jeunes plantes pourrait être le même que celui observé chez les plantes adultes.
Remerciements : Cette étude a été réalisée grâce à la participation financière de France AgriMer et du CASDAR. Nous remercions M. Jean-Jacques Balikian de l'Association des Vignerons de la Sainte-Victoire, M. Didier Richy de la Chambre d'agriculture des Bouches-du-Rhône, M. Clément des pépiniéristes Vitipro et Mme Geneviève Guignot, expert agricole et foncier de Carpentras, pour leur participation à cette étude.
<p>* Institut de la vigne et du vin. Pôle Rhône-Méditerranée. Domaine de Donadille. 30230 Rodilhan. philippe.larignon@vignevin.com</p>
Figure 1 - Les différentes nécroses rencontrées chez les plantes en voie de dépérissement.
Neofusicoccum parvum, autrement dit « Botryosphaeria » parva, carte d'identité
Position systématique
Embranchement : Ascomycètes
Classe : Dothideomycètes.
Ordre : Botryosphaeriales.
Famille : Botryosphaeriacées.
Forme téléomorphe : 'Botryosphaeria' parva
Pennycook & Samuels (Pennycook & Samuels, 1985).
Forme anamorphe : Neofusicoccum parvum. (Pennycook & Samuels) Crous, Slippers & A.J.L. Phillips, com. nov. (Crous et al., 2006).
Localisation géographique
Il est rencontré sur tous les continents : Afrique (Afrique du Sud, Cameroun, éthiopie, Ouganda, Zimbabwe...), Amérique (Brésil, Chili, États-Unis, Pérou, Uruguay, Venezuela...), Asie (Indonésie, Japon...), Europe (Espagne, France, Grèce, Italie, Portugal...), Océanie (Australie, Hawaï, Nouvelle-Zélande...).
Plantes hôtes
Il a été décrit chez un grand nombre de plantes appartenant à des familles très variées : Actinidiacées (Actinidia deliciosa), Anacardiacées (Mangifera indica), Araucariacées (Araucaria sp.), Arécacées (Trachycarpus fortunei), Combretacées (Terminalia catappa), Ebénacées (Diospyros kaki), Ericacées (Vaccinium spp.), Fagacées (Quercus suber), Grossulariacées (Ribes sp.), Lauracées (Persea americana), Liliacées (Lilium lancifolium), Melastomatacées (Tibouchina lepidota), Myrtacées (Syzygium cordatum et S. paniculatum, Eucalyptus spp., Psidium guajava), Rosacées (Malus spp., Pyrus communis), Salicacées (Populus nigra), Taxodiacées (Sequoiadendron giganteum), Vitacées (Vitis vinifera).
Chez la vigne, il est trouvé dans les tissus ligneux prélevés sur des ceps atteints de black dead arm, plus particulièrement dans des nécroses sectorielles de couleur brun gris et au niveau de la bande brune.
Il peut être rencontré également au niveau des écorces mais leur localisation précise n'est pas connue.
Biologie et cycle biologique
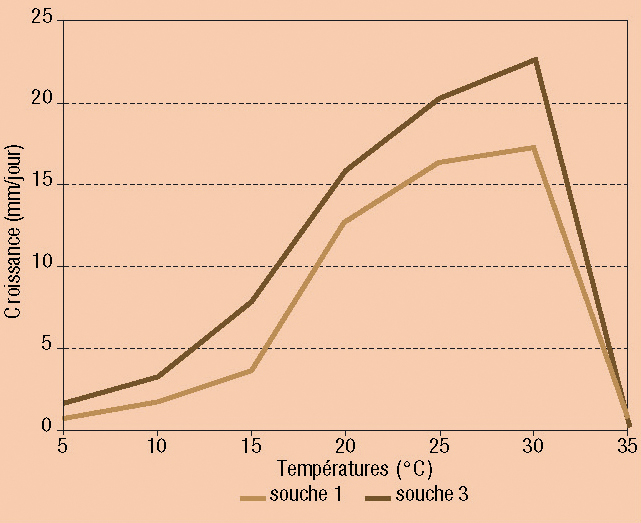
• Croissance mycélienne optimale à 30 °C (Figure ci-dessous).
• Propagation par le matériel végétal en pépinières (Larignon et al., 2008) et contamination des greffes-boutures lors de la phase de stratification.
• Dissémination aérienne (Kuntzmann et al., 2009).
• Voie de pénétration dans la plante non identifiée.
 Imprimer
Imprimer