Commercialisée en France depuis 2003, la zoxamide, associée au mancozèbe, est un outil intéressant dans les programmes de lutte contre les mildious notamment de la vigne et de la pomme de terre. Sur vigne, appliquée au cours des premiers traitements, en encadrement de floraison ou pendant le grossissement des grains, ce fongicide permet le contrôle du mildiou à tous les stades du développement de la vigne. Au long de ces 8 années d'utilisation, nos connaissances sur cette substance active ont évolué. D'une part, des travaux complémentaires ont été menés pour visualiser son mode d'action. D'autre part, l'évolution de la sensibilité des populations de Plasmopara viticola à son encontre a été suivie. État des lieux.
La zoxamide a été introduite en protection des plantes en France pour la première fois en 2003. Elle a un mode d'action unique contre les mildious, tant celui de la vigne dû à Plasmopara viticola que celui de la pomme de terre dû à Phytophthora infestans.
État des connaissances
Le mode d'action, du point de vue « macroscopique »...
D'un point de vue « macroscopique », elle inhibe la division cellulaire, l'élongation du tube germinatif, la pénétration dans la feuille et la croissance du mycélium (Duriatti Andrea et al., 2003). Elle inhibe également le développement des sporocystes, la sporulation, la libération et la mobilité des zoospores (J. Edmonds, Gowan, communication personnelle).
L'association avec le mancozèbe, lequel inhibe la germination des spores, a démontré une excellente complémentarité (Duriatti Andrea et al., 2003), et mieux : une synergie se manifeste entre les deux fongicides, vérifiée par le calcul (formule de Colby).
... microscopique et biochimique
Du point de vue de la microscopie cellulaire, la zoxamide bloque la division des noyaux. En effet, son mode d'action biochimique est de créer une liaison de covalence qui la fixe sur une protéine, la béta-tubuline. Cela provoque une rupture des microtubules du cytosquelette (J. Edmonds, comm. pers.). Le fuseau achromatique ne peut pas se former complètement. Il est à noter que les protéines chargées d'assurer la mobilité des flagelles sont de même nature que la tubuline du fuseau. Ce mécanisme d'action est unique contre les oomycètes.
Une originalité reconnue
De fait, dans la classification FRAC(1), son mode d'action unisite appartient au groupe B, celui des substances agissant sur la mitose et la division cellulaire.
Point important, elle est l'unique représentant du sous-groupe B3, assemblage des microtubules pendant la mitose (FRAC Code List 2010). Elle présente ainsi un risque très faible de résistance croisée avec les autres substances fongicides, en particulier celles efficaces contre le mildiou.
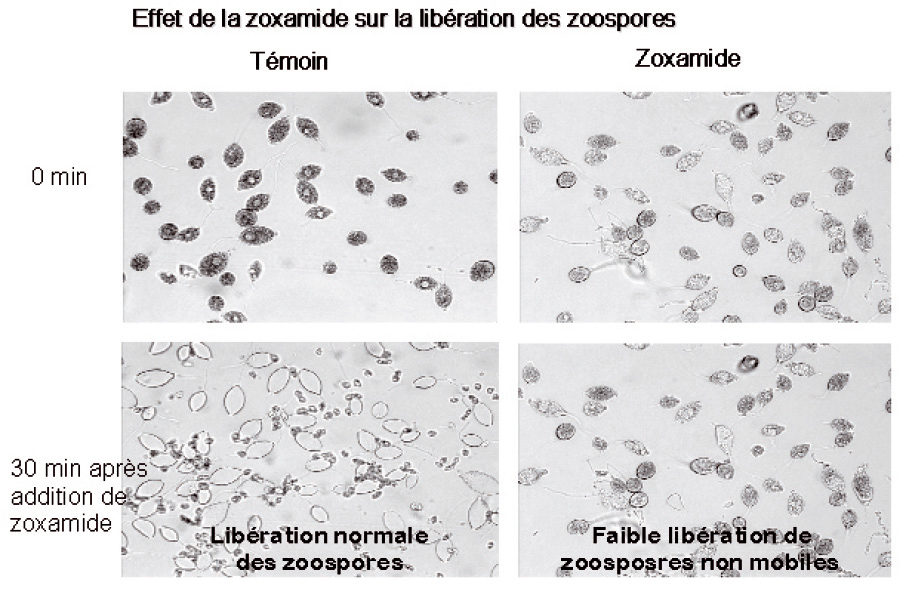
S'il est facile de constater la libération des zoospores en microscopie classique (Figure 1) d'autres méthodes permettent de mieux visualiser le mode d'action des fongicides. C'est le cas en particulier de l'épifluorescence.
Visualisation du mode d'action « macro » : ce qu'est l'épifluorescence
Principe général
La méthode repose sur l'utilisation de molécules fluorescentes capables d'interagir avec les cellules vivantes. Elles peuvent se fixer spécifiquement sur certaines structures cellulaires comme les parois ou les noyaux, ou bien être modifiées ou déplacées par le métabolisme cellulaire. Ces molécules, les fluorochromes, émettent un rayonnement fluorescent lorsqu'elles sont soumises à un éclairage particulier (excitation) fourni par une lampe au mercure. Elles réalisent ainsi un marquage, non seulement de différentes structures, mais encore de l'état métabolique des cellules. Par exemple on peut voir, non seulement si des zoospores ont été libérées des sporocystes, mais encore si elles sont, ou non, bien vivantes.
Chaque fluorochrome se caractérise par une fluorescence dans une longueur d'onde donnée, donc une couleur donnée, ce qui permet de combiner plusieurs fluorochromes. Dans les travaux suivants, les marqueurs ont été choisis de façon soit à observer l'activité et la mortalité cellulaire, soit mettre en évidence l'activité cellulaire et visualiser les noyaux.
Voir la vie et la mort des cellules
D'une part trois fluorochromes différents sont utilisés pour mettre en évidence l'activité et la mortalité cellulaires :
– un fluorochrome vert, non fluorescent à l'état naturel, est capté par toutes les cellules puis relargué dans le milieu par celles non viables. Le métabolisme cellulaire cytoplasmique (estérases) le transforme en élément fluorescent vert. Ainsi seules les cellules ayant une activité métabolique sont colorées en vert (Ormerod, 1990) ;
– un fluorochrome rouge marque l'ADN (noyaux) et l'ARN (noyaux et cytoplasme), mais ne pénètre dans les cellules que si leurs membranes sont perméables de façon passive, signe de mortalité cellulaire (Haugland, 1996) ;
– un fluorochrome bleu marque les membranes cellulaires et les septa grâce à son affinité pour la chitine et la cellulose. Il permet de visualiser les structures cellulaires.
Voir l'activité cellulaire et les noyaux
D'autre part deux fluorochromes sont utilisés pour mettre en évidence l'activité cellulaire et visualiser les noyaux :
– le fluorochrome vert utilisé précédemment,
– un deuxième fluorochrome bleu, qui marque exclusivement l'ADN, est capté par toutes les cellules et colore uniquement les noyaux.
Ces travaux de visualisation par épifluorescence ont été réalisés par le laboratoire Biotransfer.
Visualiser l'action sur P. viticola après contamination au laboratoire
Système « host free » : de la libération des zoospores jusqu'à la germination
La technique « host free » (sans hôte) permet d'observer le comportement des zoospores de mildiou pendant environ 24 heures en l'absence de support végétal (Rieman et al., 2002 ; Kiefer et al., 2002).
Les sporocystes sont détachés de la surface des feuilles et mis dans un milieu essentiellement aqueux. Après incubation de 3 heures à 19 °C à l'obscurité, nécessaire pour que les sporocystes soient capables de libérer les zoospores, la zoxamide est ajoutée au milieu en proportion correspondant à la dose appliquée à l'ha dans le cadre de l'autorisation d'usage, soit 0,625 l/ha de formulation a 200 g/l (0,15 g/l de zoxamide dilue dans 10 ml d'eau distillée).
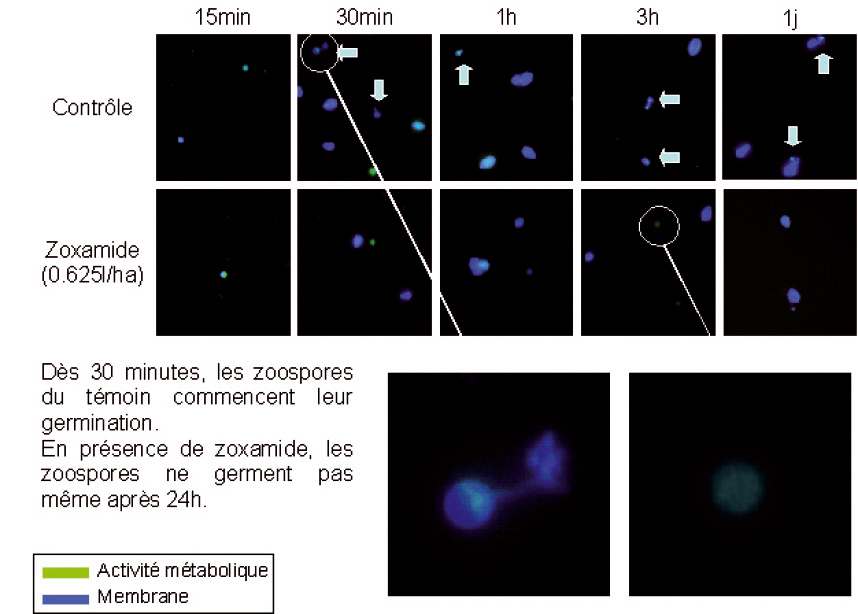
Des prelevements sont réalisés à différents temps (15 mn, 30 mn, 1 heure, 3 heures et 24 heures après traitement), les marquages sont réalisés et l'observation faite par microscopie à épifluorescence.
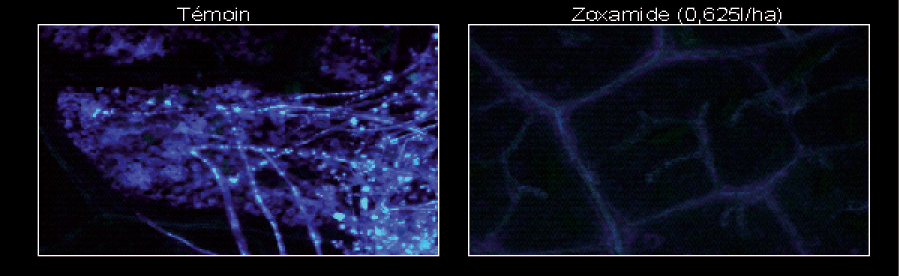
Au bout de 30 mn, de nombreuses zoospores ont été libérées dans les temoins, tres peu dans les echantillons traités, ce qu'on peut voir en microscopie classique (Figure 1).
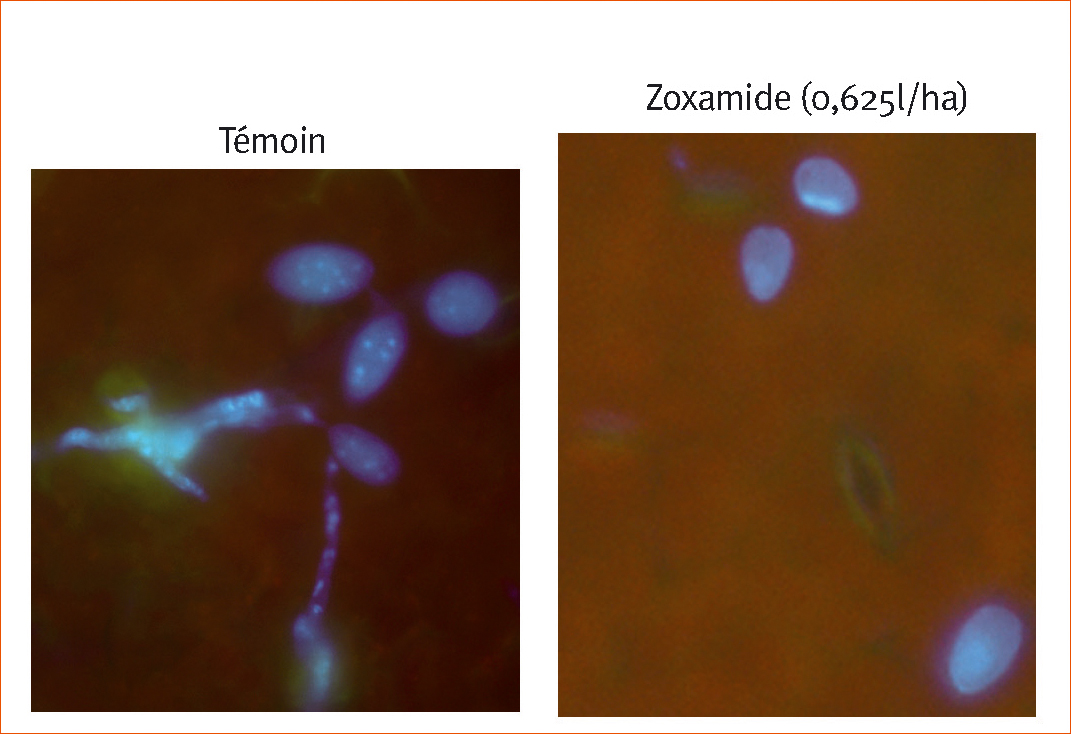
À ce moment-là, les zoospores ont commence leur germination dans les témoins mais pas en présence de zoxamide (Figure 2). Ces zoospores traitées n'ont toujours pas germe après 24 heures. En outre, leur activité metabolique diminue rapidement et a totalement disparu au bout de trois heures, alors qu'elle persiste dans le témoin.
Sur des implants de feuilles en condition de survie au laboratoire
Pour pouvoir visualiser le développement du mildiou sur son hôte, des ronds sont decoupes a l'emporte-piece dans des feuilles de vigne prélevées sur des pieds indemnes de maladie et non traités. Ils sont mis en armoire climatique dans des boîtes de Petri et maintenus en survie. Puis, ces implants foliaires sont traités a la zoxamide dans la proportion qui correspond a la dose appliquée a l'hectare dans le cadre de l'autorisation d'usage. Les solutions sont appliquées par pulvérisation de 700 ƒÊ de solution par boîte de Petri de 100 mm. Le temoin est pulvérisé avec la même quantité d'eau distillée stérile.
Les feuilles sont ensuite séchées sous hotte avant incubation en chambre climatique (Calaora Viviane et al., AFPP, 2006).
Les implants traités et ceux du témoin sont ensuite inocules par des microgouttelettes d'une suspension de P. viticola. Les marquages et observations sont realises soit 3 jours après traitement, soit 7 jours après.
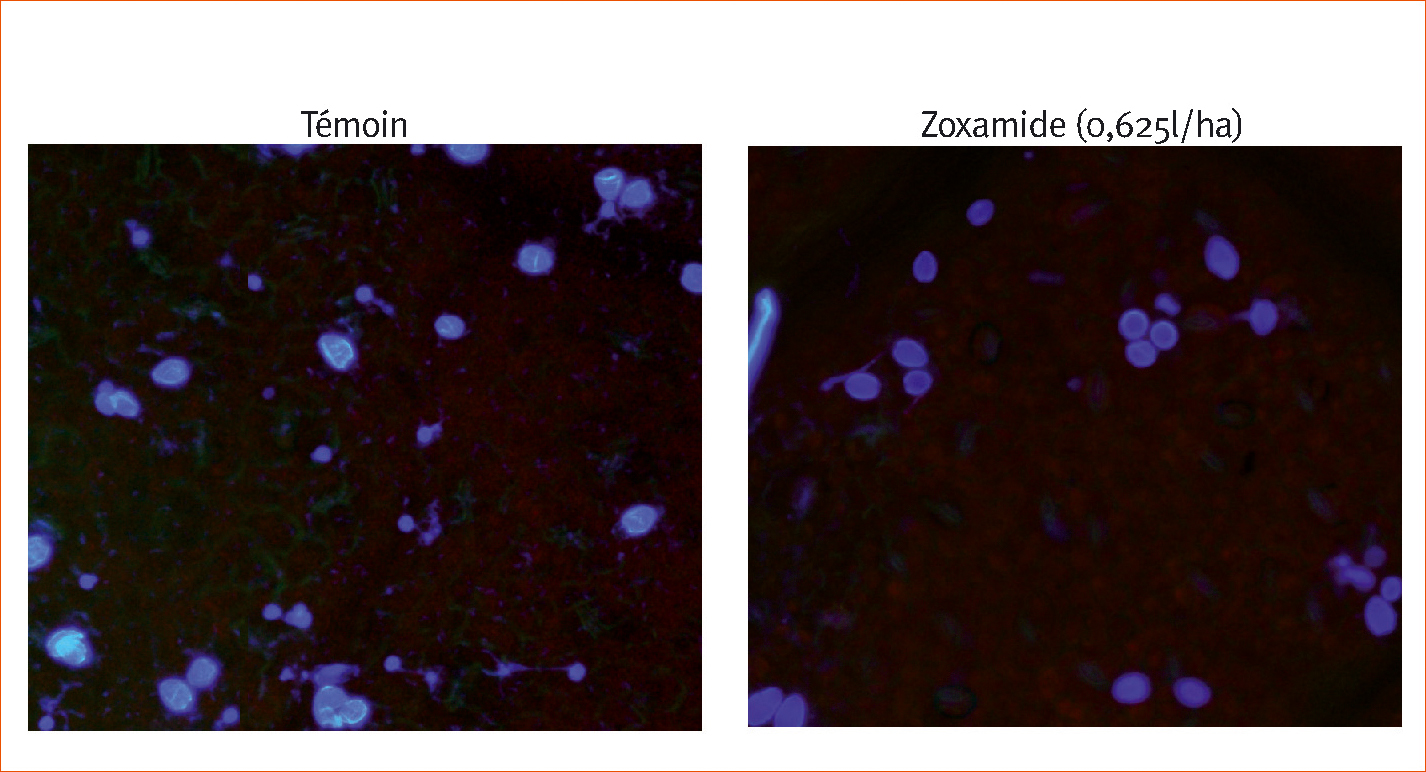
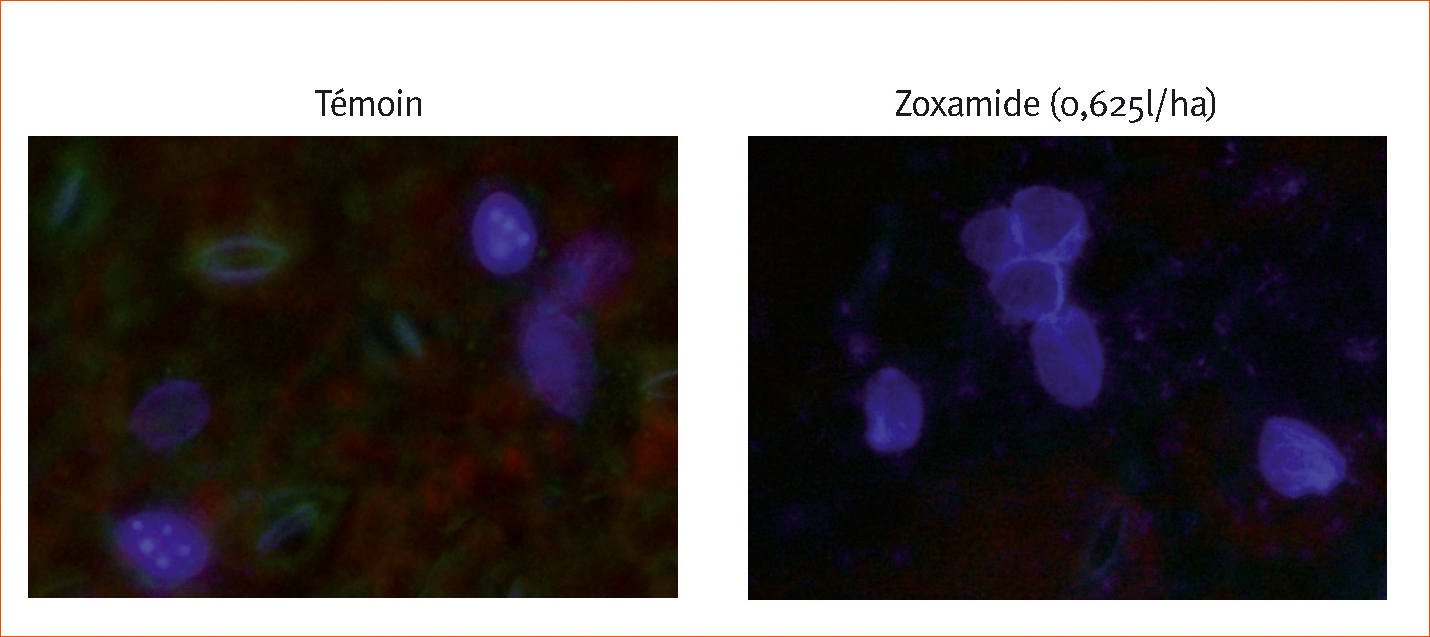
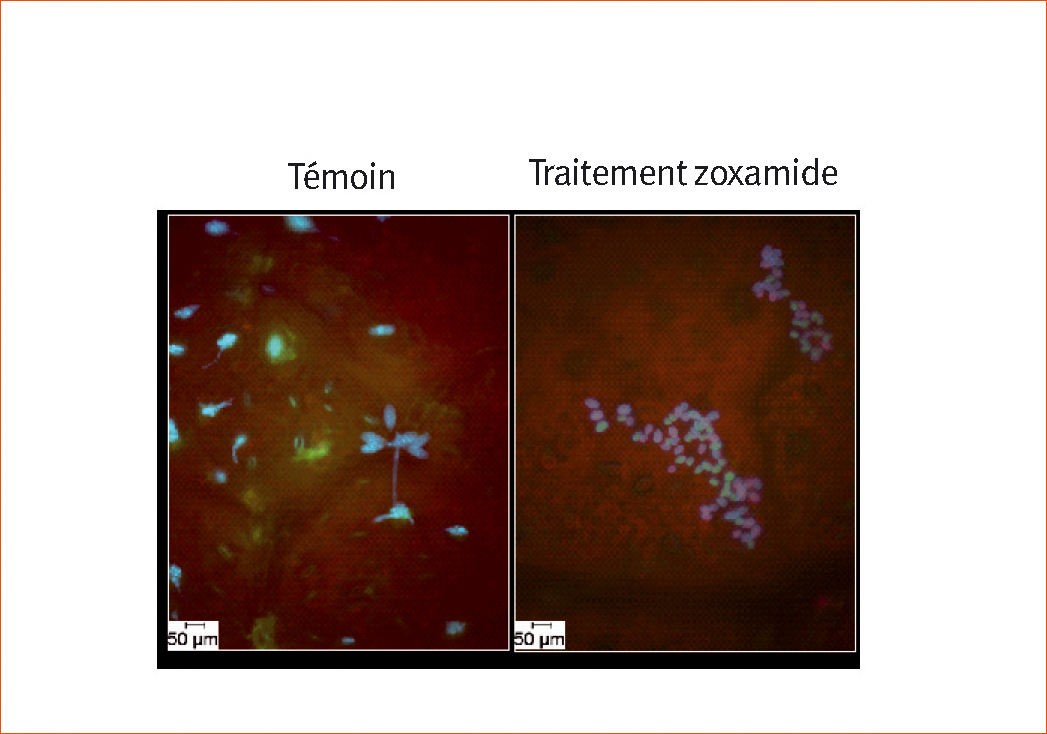
Trois jours après inoculation (Figures 3 et 4), de nombreuses zoospores ont développé leur tube germinatif dans le temoin non traite et les sporocystes contiennent des zoospores dont les noyaux sont « normaux ». En revanche, dans les implants traités avec de la zoxamide, il n'y a pas de zoospores hors de sporocystes, ces derniers sont vides ou bien contiennent des zoospores a noyaux « anormaux ».
Sept jours après inoculation (Figure 5), le developpement du mycelium intra-tissulaire s'est poursuivi dans les temoins, suivi d'une sortie massive des sporocystophores (sporulation du mildiou). Cette observation a été permise par une perméabilisation et une clarification de la feuille (Hood & al., 1996). Mais sur les implants traités avec de la zoxamide, il n'y a pas de developpement de mycelium intra-tissulaire ni de sortie de sporocystophores.
Visualiser l'action après contamination à la vigne
Étude de cas sur des feuilles prélevées en condition naturelle
Des feuilles et des grappes sont prélevées sur des vignes conduites en essais contaminés et brumises conformément a la méthode CEB n°7. Ces organes ont été traités 24 heures avant la contamination avec de la zoxamide à la dose de 0,625 l/ha. Pour les feuilles, la contamination a eu lieu le 28 mai, les feuilles ont été reçues au laboratoire le 8 juin et les observations ont été réalisées le 9 juin, soit 12 jours après contamination (Figures 6 et 7).
On observe dans les temoins une sortie des hyphes par les stomates, ainsi que les premiers sporocystophores avec les sporocystes. Ces derniers contiennent des zoospores a noyaux « normaux ». Sur les feuilles traitées à la zoxamide, les sporocystes sont détachés mais il n'y a aucun developpement du mildiou.
Le marquage d'activite metabolique (vert) et de mortalité (rouge) révèle qu'un grand nombre de sporocystes sont morts mais certains restent vivants. Leur absence de developpement est due au blocage de la contamination du 28 mai par la zoxamide appliquée auparavant. Leurs zoospores ont des noyaux anormaux.
Et sur grappes
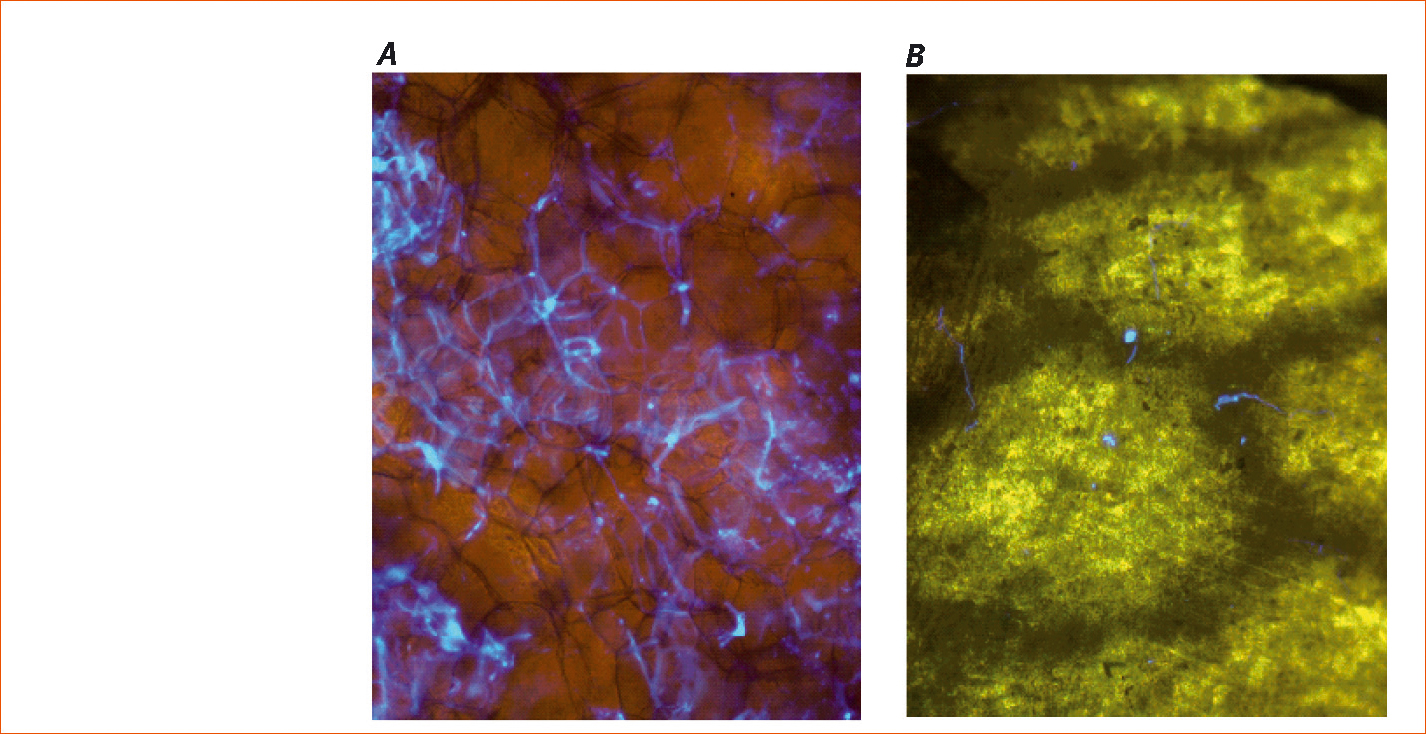
Sur grappes, dans les mêmes conditions, les observations montrent le developpement du mycelium de mildiou a l'intérieur même des grains de raisin dans le temoin et une absence de colonisation des baies dans les parcelles traitées a la zoxamide (Figure 8 A et B).
Conclusion sur l'épifluorescence
L'epifluorescence mise au service de l'observation du mode d'action des fongicides permet de mettre en évidence, dans des cellules vivantes, que la zoxamide bloque ou limite tres fortement la liberation des zoospores.
En bloquant ou en limitant les divisions cellulaires dans les sporocystes, ceux-ci contiennent peu ou pas de zoospores viables. La plupart sont vides ou contiennent des zoospores dont les noyaux sont anormaux. Le mycélium intracellulaire ne peut pas se former ou se développer et les organes traités ne comportent pas ou peu de sporocystophores. En présence de zoxamide, les zoospores ne germent pas même après 24 heures, et il n'y a pas de contamination des organes traités.
Ainsi, la microscopie à épifluorescence a permis de visualiser l'action préventive de la zoxamide et son action sur les fructifications de mildiou de la vigne.
Situation de la sensibilité du mildiou de la vigne à la zoxamide
Résultats chez Gowan et chez Dow AgroScience
La ligne de base (baseline) de sensibilité des populations de mildiou à la zoxamide a été mise au point à l'INRA de Bordeaux à partir de 203 souches prélevées dans les principales zones viticoles européennes. La technique utilisée est l'addition de zoxamide dans une suspension de zoospores. Cette ligne de base, validée par Hervé Stéva, donne une valeur CI50 (concentration inhibitrice de 50 % des populations) moyenne de 0,48 mg/l de zoxamide, avec en moyenne un CI90 (concentration inhibitrice de 90 % des populations) inférieure à 4 mg/l.
La méthodologie a ensuite évolué et elle a été adaptée à une application de zoxamide sur disques foliaires. C'est la seconde méthode qui est utilisée pour faire le suivi des sensibilités de populations dans les parcelles viticoles. Les deux doses testées sont 10 mg/l, dose contrôlant toutes les souches ayant servi à établir la ligne de base, et 3 mg/l, dose qui permet de contrôler la plupart des souches.
Ce suivi post autorisation a débuté en 2003. Il s'organise autour de deux axes :
– d'une part, et prioritairement, le suivi de la sensibilité des souches de mildiou dans les parcelles ayant été l'objet de réclamations de la part des viticulteurs,
– d'autre part le suivi au hasard dans les essais ; vu le faible nombre de réclamations viticulteurs, ce sont les populations issues de ces parcelles d'expérimentation qui constituent la grande majorité des échantillons.
Ce suivi a porté sur 166 situations en Europe dont 117 en France.
Le résultat est que, quelles que soient les années et les situations, les populations ont toujours été contrôlées par des doses de 10 mg/l.
De plus, la proportion de celles contrôlées par la dose de 3 mg/l n'évolue pas en tendance.
De la même façon, il n'a pas été détecté de dérive de sensibilité au mildiou de la pomme de terre ni à celui de l'endive.
Ce suivi montre une absence de dérive de sensibilité des populations de mildiou à la zoxamide entre 2003 et 2005.
Résultats du ministère de l'agriculture (DGAL)
Dans le cadre de son plan de surveillance des résistances, la DGAL (Direction générale de l'alimentation) suit un certain nombre de molécules dont la zoxamide depuis 2005. À ce jour aucune dérive de sensibilité n'a été détectée (Jacques Grosman, communication personnelle).
Conclusion
La zoxamide est une molécule unique et originale dans la lutte contre le mildiou de la vigne. Utilisée préventivement, cette substance bloque ou limite très fortement la libération des zoospores. Les sporocystes contiennent peu ou pas de zoospores viables, leurs noyaux sont anormaux. Le mycélium intracellulaire ne peut pas se former ou se développer dans les organes traités. Les zoospores ne germent pas même après 24 heures, et il n'y a pas de contamination des organes traités. Ainsi la zoxamide agit sur les contaminations mais aussi sur les fructifications de P. viticola.
Dotée d'un mode d'action unisite original, qui n'est partagé avec aucun autre fongicide utilisé contre cette maladie, la zoxamide n'a pas sélectionné à ce jour de population connue de mildiou de la vigne montrant une dérive de sensibilité.
Elle est présente dans Roxam Combi, Electis Pro et Unikat, associations de zoxamide et de mancozèbe autorisées sur vigne contre le mildiou, le black-rot, l'excoriose et le brenner (rougeot parasitaire) à la dose de 2 kg/ha. On la trouve aussi dans Ozys pour la lutte contre le mildiou de l'endive et dans Aderio contre celui de la pomme de terre.
<p>* Philagro France, responsable projets. pascal.armengaud@philagro.fr.</p> <p>** Laboratoire Biotransfer, directeur de recherche.</p> <p>*** Gowan, responsable France.</p> <p>(1) Fungicide Resistance Action Committee, Comité d'action contre la résistance aux fongicides. Ce groupe international fondé par l'industrie fait référence en matière de classification des modes d'action des fongicides.</p>
Figure 1 - Effet de la zoxamide sur la libération des zoospores, vue en microscopie classique. On voit bien les zoospores libérées mais, pour savoir si elles ont ou non une activité métabolique, il faudra faire appel à la microscopie à épifluorescence.
 Imprimer
Imprimer