Le fenhexamid est un fongicide de la classe des hydroxyanilides, inhibant la biosynthèse des stérols (IBS). Cette molécule à spectre étroit a été introduite il y a un peu plus de 10 ans en France comme anti-botrytis spécifique. Elle se distingue des autres classes d'IBS (azoles, imidazoles, amines) par l'étape biochimique de biosynthèse inhibée : la C4-déméthylation des stérols, jusque là non ciblée par les IBS commercialisés. Le fenhexamid est utilisé avec succès depuis une décennie dans les programmes de traitement contre la pourriture grise. Plusieurs phénotypes résistants à ce fongicide ont pourtant été détectés au laboratoire à partir d'échantillons prélevés au vignoble. Quels mécanismes sont en cause ? Pourquoi ont-ils peu d'effets en pratique ? Comment les surveiller ? Comment les gérer ? Réponses.
Ces dernières années, une réflexion et des travaux de recherche ont été menés sur le fenhexamid au laboratoire, afin d'apporter des éléments de réponses aux interrogations suivantes :
• Comment caractériser les résistances ?
• Quels mécanismes moléculaires sous-jacents sont-ils mis en jeu par le botrytis pour induire la résistance au fenhexamid ?
• Ces résistances peuvent-elles avoir un impact sur l'efficacité de ce fongicide ?
• Comment suivre en temps réel l'évolution de ces résistances au sein des populations naturelles de Botrytis cinerea ?
• Comment évolueront-elles sous l'effet des stratégies anti-résistances actuelles ?
Autant de questions cruciales, discutées ci-après.
Pour situer le fenhexamid
La pourriture grise de la vigne : une maladie causée par un complexe d'espèces
Les avancées moléculaires des vingt dernières années ont permis d'identifier 30 espèces du genre Botrytis. Parmi elles, B. cinerea est associée spécifiquement à la pourriture grise de la vigne (photo) et de divers fruits et légumes.
Des analyses phylogénétiques récentes faites sur des isolats issus du vignoble mais aussi d'autres plantes hôtes et basées sur le polymorphisme de nombreux gènes, ont démontré la nécessité de scinder en deux l'espèce B. cinerea. On a pu distinguer deux entités distinctes vivant en sympatrie, c'est-à-dire dans la même aire géographique, et dans notre cas sur le même hôte, nommées groupe I et groupe II, et incapables de se croiser en laboratoire.
Le groupe II représente l'espèce B. cinerea sensu stricto, telle que définie en 1945 par Whetzel. La nouvelle espèce du groupe I fut récemment nommée Botrytis pseudocinerea.
B. pseudocinerea, bien que possédant un fort polymorphisme génétique, est indifférenciable morphologiquement de B. cinerea sensu stricto ; seule sa sensibilité à plusieurs familles de fongicides dont le fenhexamid révèle la distinction au niveau phénotypique (Fournier et al., 2005 ; Leroux et al., 2006 ; Walker et al., 2011).
Les fongicides disponibles
Actuellement les stratégies à 2 ou 3 traitements contre la pourriture grise sont recommandées dans les vignobles à forte pression de maladie (Champagne, Bourgogne ; Note Nationale Botrytis 2011). Dans le contexte général de la réduction des intrants chimiques en agriculture (Plan Écophyto), il est probable que le nombre d'applications soit limité. Avant l'entrée sur le marché du fenhexamid en 2000, le panel de fongicides autorisés en France comprenait des anilinopyrimidines, des benzimidazoles, des dithiocarbamates, des dicarboximides, des phénylpyrroles et des pyridinamines. Ce panel s'est récemment enrichi d'un SDHI (inhibiteur de la succinate deshydrogenase) avec l'homologation du boscalid en 2003 (Leroux 2004).
Le fenhexamid, fongicide au mode d'action singulier
Le fenhexamid (structure chimique figure 1) présente une double originalité : c'est l'unique IBS (inhibiteur de biosynthèse des stérols) autorisé en France contre la pourriture grise sur vigne, et il inhibe une étape de la biosynthèse des stérols différente de celles inhibées par les autres types d'IBS.
L'ergostérol, stérol majeur des champignons, est un composant essentiel des membranes fongiques. Il permet de maintenir une rigidité et une perméabilité des membranes facilitant l'adaptation de l'organisme aux différents environnements qu'il peut rencontrer. Tous les stérols, tous règnes confondus, partagent une structure commune leur conférant un caractère amphiphile, et comprenant une région hydrophobe (composée d'un noyau tétracyclique sur lequel sont greffés un groupement méthyle en C10 et C13 et une chaîne latérale carbonée en C17) et une région hydrophile avec un groupement hydroxyle en position C3.
Contrairement aux IDM (inhibiteurs de la déméthylation des stérols ; triazoles, imidazoles et triazolinethiones) qui ciblent la 14α-déméthylase (syn. Cyp51), ou les amines ciblant préférentiellement la Δ14-réductase et/ou la Δ8-Δ7-isomérase, le fenhexamid bloque, lors de la C4-déméthylation des stérols, la 3- cétoréduction, dont la fonction est assurée par l'enzyme 3-cétoréductase (syn. Erg27).
Le mode d'action du fenhexamid a été découvert en 2001 par l'analyse de la composition en stérols de souches de B. cinerea traitées au fenhexamid (Debieu et al., 2001). Comme cette étape de biosynthèse est présente chez tous les Eumycètes, on pourrait s'attendre à ce que des inhibiteurs de cette enzyme conduisent à des fongicides à large spectre, comme les IDM.
Cependant, l'analyse de la séquence codante de cette enzyme chez B. cinerea et chez Sclerotinia sclerotiorum montre qu'il existe beaucoup de différences avec celles des espèces insensibles au fenhexamid. Ceci suggère une structure particulière de la 3-cétoréductase chez B. cinerea et les espèces proches (S. sclerotiorum, Monilia spp.), pouvant être responsable d'une forte affinité du fenhexamid vis-à-vis de l'enzyme.
Plusieurs phénotypes résistants au fenhexamid
L'inné et l'acquis, ce qu'on savait
De façon générale, il est possible de distinguer deux types de résistance aux pesticides.
La première, dite « acquise », correspond à la sélection, au sein de populations naturelles globalement sensibles, d'isolats résistants suite à la pression exercée par un inhibiteur.
L'autre est la résistance dite « innée », « intrinsèque » ou « naturelle ». Elle concerne une espèce entière, d'emblée insensible à un pesticide qui ne peut être utilisé pour le contrôle de l'espèce (Leroux et Gardan, 2003).
Les deux définitions ne doivent pas être confondues, bien que les mêmes mécanismes moléculaires puissent conférer les deux types de résistance.
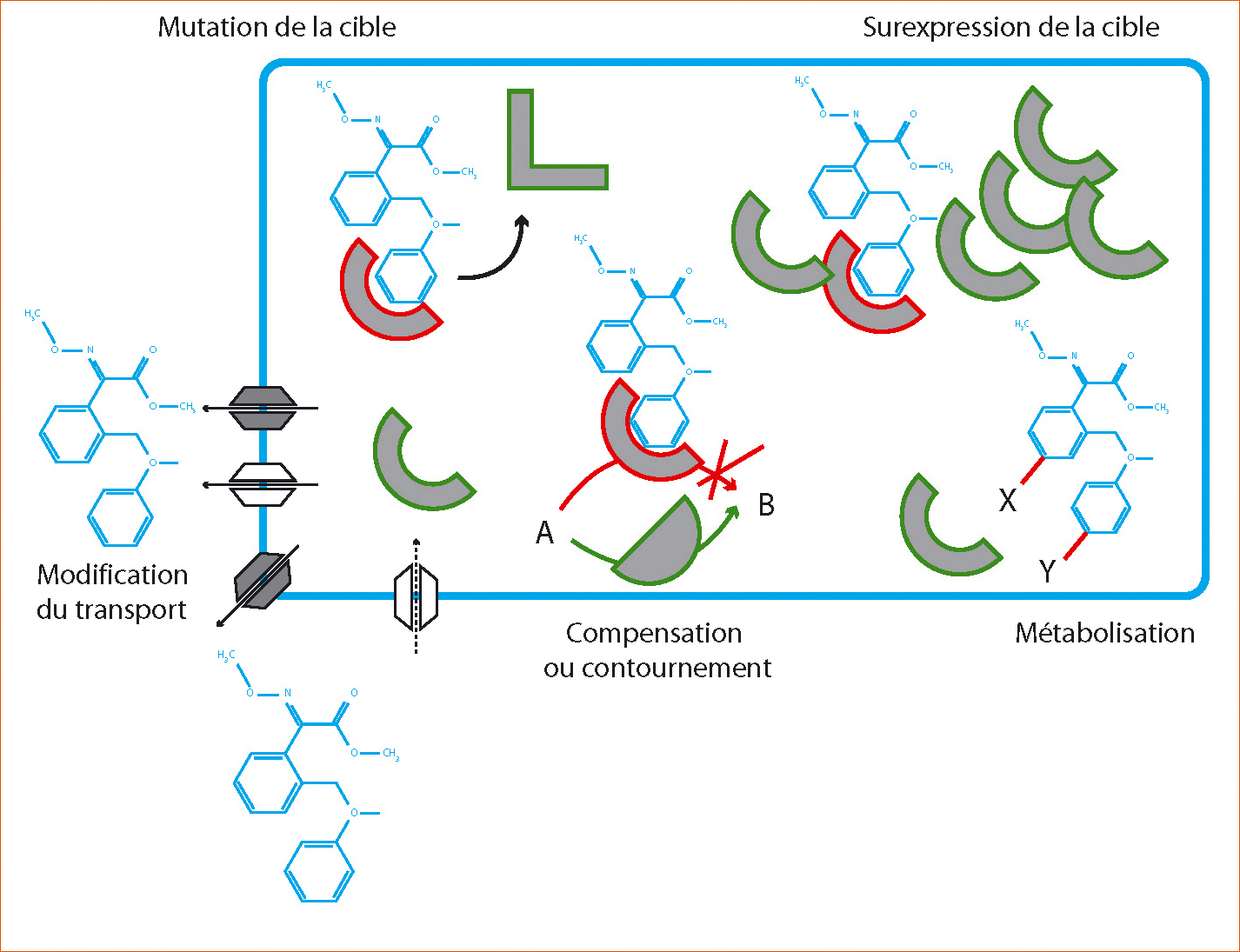
Ces mécanismes peuvent impliquer : l'insensibilité, l'absence ou la surexpression de la cible potentielle, la réduction de pénétration ou l'excrétion accrue des pesticides, des systèmes de contournement, de stockage, de séquestration ou la métabolisation du pesticide.
Pour la résistance innée, il s'agit de pré-adaptation de l'espèce entière. Ce n'est pas le fruit d'un événement évolutif récent mais le résultat d'un processus adaptatif ancien, parfois antérieur à la spéciation et sans lien direct avec le pesticide concerné.
Quand l'acquis se révèle inné…
Chez certains champignons phytopathogènes, cette différenciation entre résistance « acquise » et « innée » est parfois problématique et peut contribuer à la caractérisation de nouvelles espèces.
Ainsi on croyait déceler une résistance acquise par sélection de certaines souches, mais il s'agit en fait de résistance innée d'une espèce différente qui se révèle à cette occasion. C'est par exemple le cas de l'agent du piétin-verse. Il est maintenant séparé en deux espèces : Oculimacula yallundae et O. acuformis, cette dernière naturellement résistante aux IBS de type triazole.
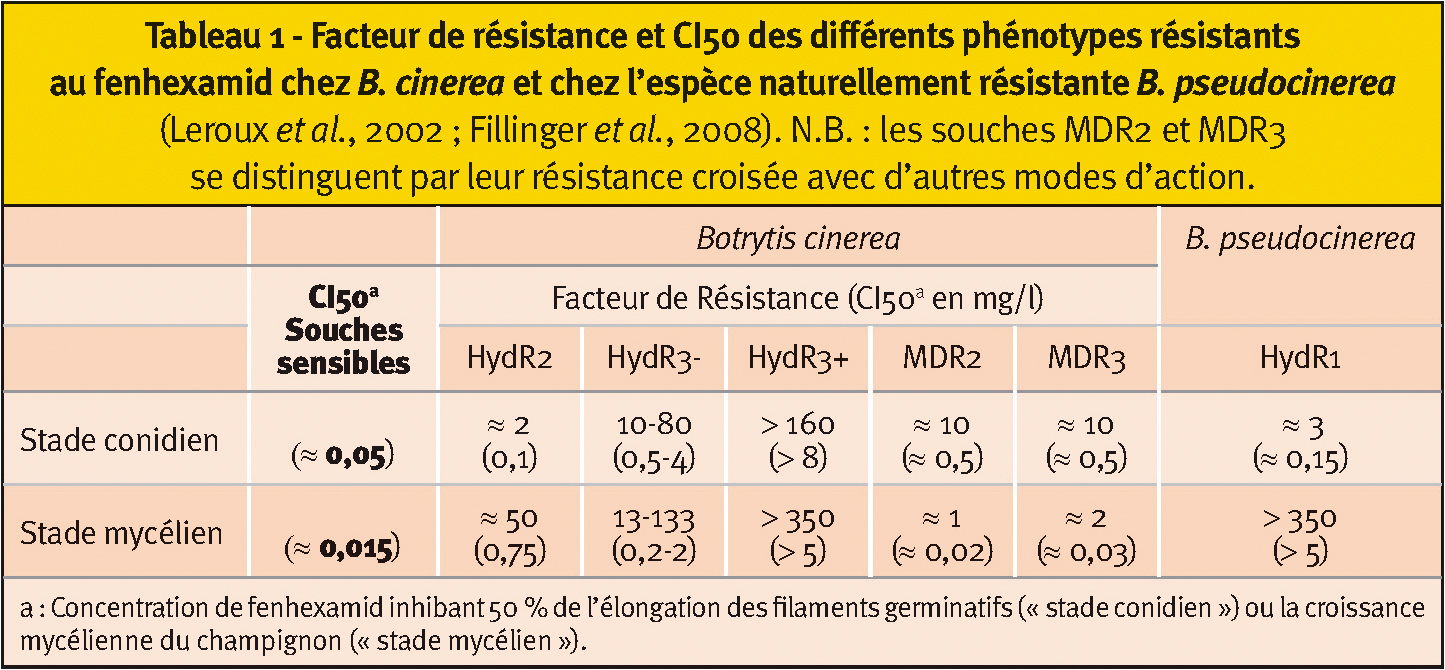
De même concernant la pourriture grise, les souches résistantes au fenhexamid initialement nommées HydR1 (Tableau 1), détectées avant l'introduction du fenhexamid, correspondent à la nouvelle espèce récemment décrite. B. pseudocinerea, naturellement résistante au fenhexamid. Par ailleurs ce phénotype présente une sensibilité accrue à d'autres fongicides incluant des IBS (IDM ou les amines fenpropimorphe, fenpropidine et spiroxamine), et des inhibiteurs de la succinate déshydrogénase (SDHI).
Et la vraie résistance acquise ?
Concernant cette fois-ci la résistance acquise au fenhexamid, il a été possible de caractériser quatre catégories d'isolats résistant au fenhexamid à partir de souches de B. cinerea prélevées dans des vignobles : MDR2, MDR3, HydR2 et HydR3 (Leroux et al., 2002).
Les phénotypes MDR2 et MDR3 présentent chez B. cinerea une résistance faible (facteurs de résistance inférieurs à 15) (Tableau 1). Ces phénotypes, particulièrement implantés en Champagne, possèdent des résistances faibles à modérées envers beaucoup de matières actives (anilinopyrimidines, SDHI, dicarboximides, benzimidazoles), engendrées par la surexpression de transporteurs membranaires permettant l'excrétion de ces molécules à l'extérieur des hyphes mycéliens (Krestschmer et al., 2009 ; Leroux et Walker, 2009). Ces résistances ne sont donc pas spécifiques au fenhexamid.
Pour le phénotype HydR2 (B. cinerea), la résistance n'est exprimée qu'au stade de la croissance mycélienne. Les rares souches HydR2 disponibles ont été détectées en Allemagne (et au Japon sur culture de fraises) mais jamais à notre connaissance dans les vignobles français.
Quant aux souches HydR3 (B. cinerea), qui expriment la résistance à la fois au niveau du stade conidien et mycélien, elles sont régulièrement détectées dans les vignobles français depuis 2003 (Tableau 1). Cette classe a pu être subdivisée en deux catégories (HydR3- et HydR3+), en fonction des facteurs de résistance, modérés pour HydR3- et élevés pour HydR3+.
Mécanismes moléculaires conférant la résistance spécifique au fenhexamid
Chez les HydR3- et HydR3+
Comme pour la majorité des cas de résistance aux fongicides, l'hypothèse d'une modification de la cible du fenhexamid a été vérifiée prioritairement (Figure 2).
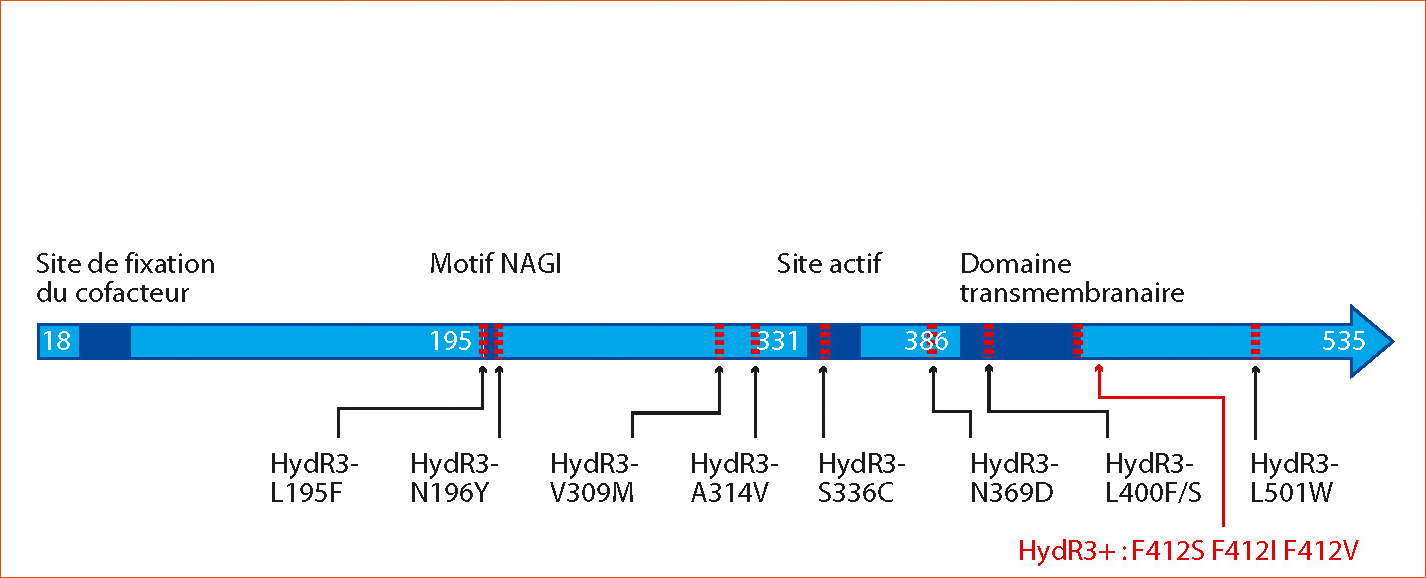
Le séquençage du gène erg27 codant pour la cible du fenhexamid chez des souches françaises a permis l'identification de mutations, au nombre de huit, réparties sur la protéine de manière unique ou double chez le phénotype HydR3- (L195F, N196Y, V309M, A314V, S336C, N369D, L400F/S, et L501W). Les isolats HydR3+ possèdent un unique changement à la position F412 (F412S, F412I ou F412V) (Figure 3) (Albertini et Leroux, 2004 ; Fillinger et al., 2008).
L'impact de ces mutations dans la résistance a été mesuré par la création de souches isogéniques, c'est-à-dire que l'allèle codant la 3-cétoréductase d'une souche sensible au fenhexamid a été remplacé par un allèle résistant. Il a été mesuré des facteurs de résistances similaires à ceux des souches résistantes isolées du vignoble : les mutants isogéniques ayant intégré les allèles mutés de type HydR3- L195F et V309M présentent des résistances caractérisées par des Cl 50 de l'ordre de 0,5 à 1,5 mg/l selon le stade biologique ; les mutants isogéniques portant les trois types de mutations HydR3+ (F412S, F412I et F412V) montrent une résistance plus forte (Cl 50 ≥ 5 mg/l) aux stades conidien et mycélien.
Ces résultats confirment le lien direct entre l'acquisition de ces polymorphismes génétiques et la résistance spécifique au fenhexamid chez B. cinerea (Billard et al. (a), sous presse).
Chez B. pseudocinerea, originale métabolisation
Contrairement aux phénotypes de résistance HydR2, HydR3- et HydR3+, les souches de B. pseudocinerea (HydR1) n'ont pas été sélectionnées suite à l'usage du fenhexamid. Chez B. pseudocinerea, la création de mutants isogéniques a montré que le fort polymorphisme observé dans le gène erg27 confère une résistance faible, avec un facteur de résistance inférieur à 10 (FR < 10). Les importants facteurs de résistance au fenhexamid chez cette espèce (FR >350 au stade mycélien) suggèrent un mécanisme de résistance additionnel.
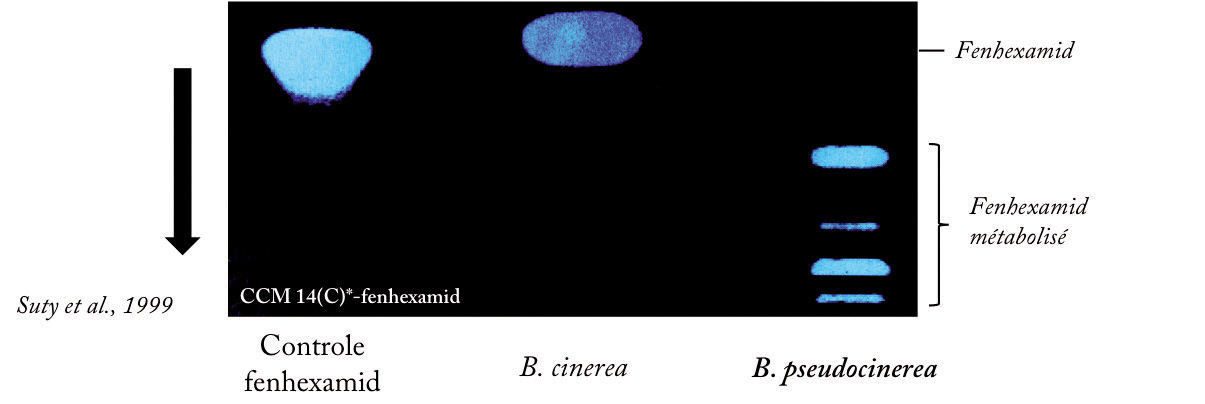
Par ailleurs, des études antérieures conduites par Bayer CropScience (Suty et al., 1999) et l'INRA (Leroux et al., 2002) chez B. pseudocinerea avaient montré, d'une part que le mycélium de cette espèce métabolise le fenhexamid (Figure 4) et d'autre part que les IDM induisent une synergie vis-à-vis du fenhexamid.
Des études d'expression génique sur plusieurs gènes codant plusieurs monooxygénases à cytochrome P450 ont permis d'observer la surexpression d'un gène nommé cyp68.4 chez B. pseudocinerea (Billard, 2011). La délétion de ce gène chez cette espèce engendre une forte diminution de la résistance caractéristique du fenhexamid, ainsi que la perte de métabolisation et de synergie (Billard, 2011).
Ces modifications démontrent le rôle de ce gène dans la métabolisation du fenhexamid et dans la résistance naturelle au fongicide.
Les phénomènes de résistance induits par la métabolisation d'un fongicide sont extrêmement rares, contrairement aux résistances envers les insecticides et les herbicides. Le cas de la métabolisation du fenhexamid par cyp68.4 est la première caractérisation génétique d'un tel processus chez un champignon phytopathogène.
Est-ce que l'acquisition de ces mécanismes engendre un impact sur la fitness ?
Ce qu'est la « fitness », et pourquoi elle est importante
Plusieurs facteurs peuvent moduler l'évolution de la résistance, et in fine l'efficacité des traitements. Parmi eux, la fitness d'un isolat correspond à sa capacité de survie comparativement à d'autres (notamment les types « sauvages »), dans les mêmes conditions.
Cette notion est très importante car, indépendamment des pressions sélectives exercées par les fongicides, elle participe à déterminer la persistance d'isolats résistants au sein de populations naturelles.
Acquérir une résistance coûteuse, c'est-à-dire ayant un fort impact négatif sur la fitness, engendrera un avantage certain pour la pérennité et l'efficacité du fongicide. Si on accompagne l'usage de ce produit de stratégies anti-résistance adaptées voire peu restrictives, les souches à fitness réduites, problématiques en théorie, seront facilement gérables.
À l'inverse, l'absence de coût pour l'acquisition d'une résistance à une molécule peut se révéler extrêmement problématique pour son efficacité pratique. Elle rendra moins efficaces des stratégies même très restrictives.
Le cas des souches HydR3+ : tests réalisés
Dans le cas du fenhexamid, il est donc important de détecter et de quantifier le coût éventuel des modifications génétiques observées chez le phénotype le plus résistant (HydR3+).
Afin de tester l'hypothèse d'un possible coût à l'acquisition de la résistance HydR3+, causée par les mutations F412 sur l'enzyme cible du fenhexamid, nous avons effectué au sein du laboratoire plusieurs analyses mesurant l'impact de ces différentes mutations sur la biologie du champignon. Ces analyses ont été faites sur nos trois types de mutants isogéniques de phénotype HydR3+ (F412S, F412I et F412V), afin de minimiser l'effet des fonds génétiques différents généralement rencontrés lors de l'analyse de souches venant du vignoble.
Nous avons volontairement choisi d'axer notre analyse sur l'effet des températures froides, de la limitation des ressources nutritives ainsi que sur la mesure de la principale forme de conservation hivernale du champignon que sont les sclérotes. En effet, il a été observé de fortes variations de fréquence du phénotype HydR3+ au sein de mêmes vignobles d'une année à l'autre. Cela suggérait que le coût possible de l'acquisition de la résistance surviendrait lors de la phase de conservation hivernale.
Et leurs résultats
Statistiquement, nous avons pu observer une baisse faible à forte, mais toujours significative, de plusieurs paramètres biologiques du cycle asexué du champignon, notamment de :
– la croissance mycélienne en conditions contraignantes (jusqu'à plus de 50 % dans certaines conditions),
– la production de macroconidies (5 à 10 %),
– la croissance mycélienne à partir de sclérotes ayant subi une phase longue de congélation (10 à 20 % selon les isolats),
– la production de sclérotes (Figure 5) (Billard et al. (a), sous presse).
En revanche, aucune modification n'a été relevée concernant le pouvoir pathogène de nos mutants isogéniques HydR3+ par rapport à la souche parentale sensible. Ceci souligne le fait que la phase de conservation du champignon pourrait être la principale étape affectée par la résistance (Billard et al. (a), sous presse).
Attention, il s'agit de tendances observées au laboratoire : seuls des mesures au vignoble et le suivi annuel de ces isolats dans les populations naturelles pourraient les confirmer.
Pour un suivi moléculaire des populations résistantes
Méthode biologique de suivi, nécessaire pour détecter toutes les résistances, mais coûteuse
La surveillance annuelle de la sensibilité d'un pathogène à un fongicide commence avant la commercialisation de ce dernier. Elle implique en premier lieu la mise au point d'une méthode biologique permettant d'évaluer la variabilité de sensibilité au sein des populations naturelles.
Dans une seconde étape, à l'aide éventuellement de doses discriminantes, le monitoring (= surveillance) est poursuivi après l'introduction du fongicide sur le marché, afin d'être en mesure de détecter la sélection des souches résistantes susceptibles de diminuer l'efficacité du produit.
Ces analyses, conduites soit sur des souches isolées soit sur des populations, sont chronophages, voire coûteuses, malgré une miniaturisation et une automatisation des lectures de croissance. Elles permettent cependant de détecter tout nouveau phénotype, sans a priori sur son mécanisme de résistance.
L'ASPPAA PCR, méthode moléculaire pour détection spécifique des HydR3+
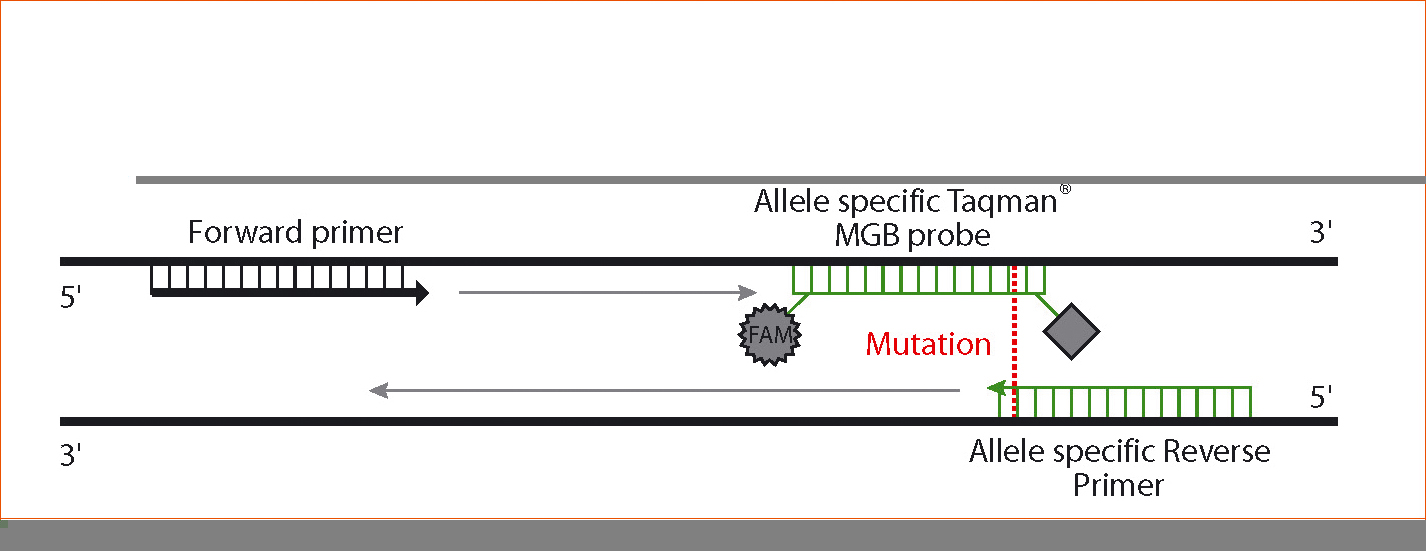
Une alternative permettant de déterminer spécifiquement les souches HydR3+, consiste à quantifier les SNP (Single Nucleotide Polymorphism = mutations ponctuelles) du gène erg27 déterminant ce phénotype. Comme leur résistance est déterminée par les substitutions F412S, F412I et F412V, nous avons mis au point une nouvelle technique de PCR quantitative nommée ASPPAA PCR (Allele Specific Probe and Primer Amplification Assay) permettant de quantifier quatre allèles simultanément de façon sensible au sein de pools d'ADN issus d'échantillons de conidies récoltées dans les vignobles (Figure 6).
Ces allèles sont distingués par les trinucléotides TTC (phénylalanine), TCC (serine), ATC (isoleucine) et GTC (valine), correspondant au génotype sensible et aux trois génotypes de résistance HydR3+. Cette méthode combine des sondes Taqman® et des primers (= amorces), allèles spécifiques judicieusement positionnés sur chacun des deux brins d'ADN où se situe le SNP ; ainsi les quatre différents allèles sont spécifiquement amplifiés.
La sensibilité de l'ASPPAA est inférieure à 1 % de quantification d'un allèle dans un pool d'ADN quand elle est pratiquée sur des ADN extraits de mélange de conidies de souches pures (Billard et al. (b), sous presse). Cette méthode pourrait être étendue et couplée à l'analyse d'autres SNP impliqués dans la résistance à d'autres fongicides anti-botrytis, comme les SDHI.
Des méthodes à coupler
Un désavantage majeur des méthodes moléculaires de quantification de la résistance est qu'elles ne permettent pas de détecter l'émergence de nouvelles résistances, contrairement aux méthodes biologiques.
Il est cependant possible de coupler les méthodes moléculaires comme l'ASPPAA PCR avec des techniques de détection de mutations ponctuelles, comme la HRM (High Resolution Melt) qui permet de détecter rapidement et sans séquençage la présence de mutations sur une région génique définie. La sélection par exemple de nouvelles mutations sur le gène erg27 serait alors détectée.
En revanche, la détection de mécanismes n'affectant pas la cible serait assurée grâce aux méthodes biologiques.
Conclusion sur l'évolution de la résistance et la durabilité de l'utilisation du fenhexamid
Au sein des populations fongiques responsables de la pourriture grise, plusieurs phénotypes présentant une résistance au fenhexamid ont été caractérisés au laboratoire.
Pour ceux dont la résistance est faiblement exprimée au niveau de l'élongation des tubes germinatifs émis par les conidies (phénotypes HydR2, MDR2 et MDR3), il a été montré par inoculations artificielles ou dans des essais au vignoble qu'ils avaient peu ou pas d'impact sur l'efficacité du fenhexamid (Petit et al., 2010).
De même pour l'espèce B. pseudocinerea, (HydR1) grâce à la surveillance commencée avant la commercialisation du fenhexamid, il a été montré que sa fréquence fluctuait au cours du temps mais que le fenhexamid ne la sélectionnait pas. Cette espèce possède probablement une adaptation écologique différente de celle de B. cinerea : elle se développe en début de saison, avant les traitements anti-botrytis, et est ensuite partiellement remplacée par B. cinerea sensu stricto qui semble plus agressif sur baies de raisin. B. pseudocinerea possède donc au final un impact modéré dans les épidémies de pourriture grise.
Quant au phénotype HydR3, il comporte des souches ayant des résistances modérées à fortes pour tous les stades de croissance, déterminées par des altérations de la cible.
Ce phénotype a été subdivisé en deux catégories : (1) HydR3-, peu fréquentes et les moins résistantes et (2) HydR3+, les plus fréquentes et les plus résistantes.
Ces dernières sont celles qui pourraient mettre en difficulté le fenhexamid dans ses conditions pratiques d'emploi. Ce phénotype HydR3+, détecté en 2003 à partir de souches prélevées dans le vignoble français et caractérisées au laboratoire, tend à progresser lentement dans plusieurs vignobles. Si les fréquences restent modérées (27 % en moyenne en Champagne en 2010), la distribution des souches au sein du parcellaire a fortement augmenté ces dernières années (88 % des parcelles en Champagne).
S'il est possible d'observer des fréquences supérieures à 50 % en fin de saison après un traitement fenhexamid, une surveillance pluriannuelle n'a pas permis à ce jour d'identifier des sites où de telles fréquences se soient maintenues pendant plusieurs années. Enfin, à notre connaissance, des pertes d'efficacité du fenhexamid attribuées à la présence de souches résistantes n'ont jamais été signalées à ce jour.
Au vu de ce bilan, plusieurs hypothèses peuvent expliquer cette progression lente des souches HydR3+ :
– la limitation d'emploi du fenhexamid (et plus généralement de chacune des classes d'antibotrytis) à un traitement par an ;
– le coût biologique de la résistance chez ces souches HydR3+ ;
– en Champagne surtout, la prépondérance des souches MDR (55 % en moyenne) ; en effet, rares sont les souches cumulant MDR et résistance spécifique au fenhexamid.
Pour compléter ces hypothèses, il est important de continuer le suivi de l'évolution des souches HydR3 dans les différents vignobles, en lien avec les pressions de sélection appliquées. Ceci permettrait de comprendre et préciser les facteurs favorisant leur sélection et ainsi optimiser la mise en œuvre des stratégies anti-résistance en pratique.
<p>* INRA UR 1290 BIOGER-CPP, Avenue Lucien-Brétignières, 78850 Thiverval-Grignon. billard.alexis@gmail.com daniele.debieu@versailles.inra.fr</p> <p>** Bayer SAS, Bayer CropScience, Research Center La Dargoire, 14, impasse Pierre-Baizet, 69009 Lyon.</p>
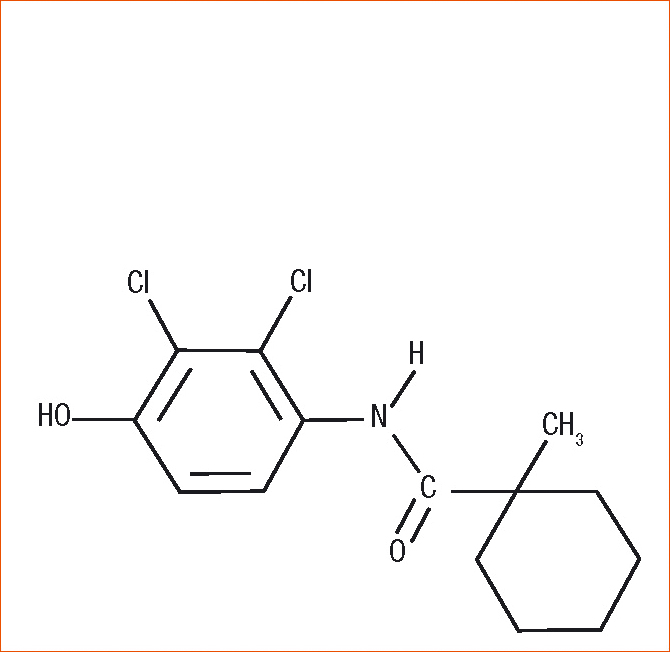
Figure 1 - Structure chimique du fenhexamid.
D'une structure relativement simple, le fenhexamid présente cependant une forte toxicité intrinsèque spécifique de Botrytis cinerea et des espèces phylogénétiquement proches.
Tableau 1 - Facteur de résistance et CI50 des différents phénotypes résistants au fenhexamid chez B. cinerea et chez l'espèce naturellement résistante B. pseudocinerea
(Leroux et al., 2002 ; Fillinger et al., 2008). N.B. : les souches MDR2 et MDR3 se distinguent par leur résistance croisée avec d'autres modes d'action.
Figure 2 - Principaux mécanismes moléculaires chez les bioagresseurs résistants aux pesticides.
Concernant les fongicides, la diminution de l'affinité de l'inhibiteur pour sa cible causée par une modification de la séquence ainsi que la modification du transport de la molécule sont les deux mécanismes les plus fréquemment rencontrés.
Figure 3 - Structure protéique et domaines fonctionnels de la 3-cétoréductase Erg27 de B. cinerea.
Le site actif catalysant la formation d'un groupement hydroxyle en position C3 des stérols se situe à proximité du domaine transmembranaire permettant l'ancrage de l'enzyme sur le réticulum endoplasmique. La position des mutations détectées chez les isolats résistants de type HydR3- et HydR3+ est indiquée par les flèches noires pour les isolats HydR3- et rouges pour les isolats HydR3+.
Figure 4 - Phénomènes de métabolisation du fenhexamid chez B. cinerea et B. pseudocinerea.
La métabolisation est analysée dans la phase organique extraite de cultures de champignons incubés avec du fenhexamid radio-marqué au carbone 14 par chromatographie couche mince. B. pseudocinerea possède la particularité de fortement métaboliser le fongicide (pattern de droite), induisant une résistance à celui-ci.
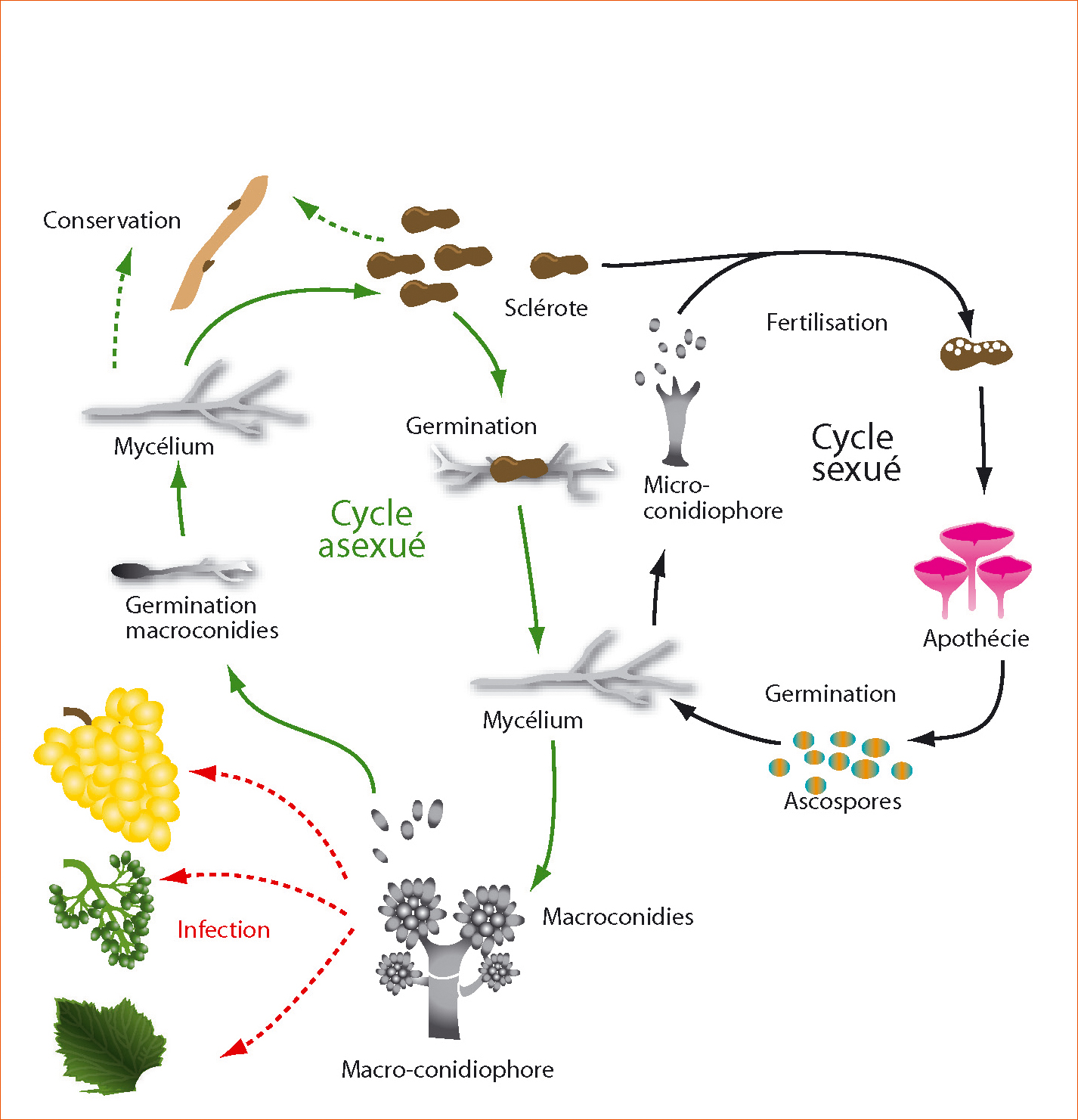
Figure 5 - Cycle de vie de Botrytis cinerea.
Au laboratoire, un impact de l'acquisition de la résistance de type HydR3+ a été observé sur différentes phases du cycle asexué (en vert) sur des mutants isogéniques de B. cinerea. Cependant, le pouvoir pathogène de nos mutants (en rouge), mesuré sur haricot, reste inchangé par rapport à la souche parentale sensible au fenhexamid.
Figure 6 - Principe moléculaire de l'ASPPAA PCR.
La haute capacité de quantification allélique de cette nouvelle méthode utilisant la PCR en temps réel est due à la fois à la spécificité d'amplification de la mutation par des sondes allèle spécifique et des amorces (primers) spécifiques présentes sur l'ensemble des deux brins d'ADN.
 Imprimer
Imprimer