Quelques exemples de cochenilles 2. Coccus hesperidum sur Citrus limon (parc Phoenix). 3. Diaspididae Aspidiotus nerii sur Strelitzia reginae en pot (Cream). 4. Larves de Ceroplastes sp. sur Citrus (Mouans-Sartoux - Alpes-Maritimes). 5. Planococcus citri sur Clerodendron (parc Phoenix). 6. Pseudococcus viburni sur Camellia (BHR). 7. Larves de Uhleria araucariae sur Araucaria columnaris (parc Phoenix).
Dans le cadre du projet Cochorti, piloté par l'UMT FioriMed(1), les équipes techniques de l'institut Astredhor ont échantillonné, dans leurs stations de recherche, en pépinières, parcs et jardins botaniques et jardins privés, plusieurs espèces de cochenilles attaquant de nombreuses plantes ornementales, ainsi que leurs ennemis naturels. Dans un premier volet, présenté ici, un travail d'identification des cochenilles sur des critères morphologiques et moléculaires a été réalisé. Un second volet a consisté à préciser les cortèges d'auxiliaires afin notamment d'évaluer les possibilités de lutte biologique(2). L'objectif du projet est de déterminer de potentiels leviers agroécologiques pour réduire l'usage des pesticides dans les systèmes de production horticoles.
Une problématique toujours d'actualité
Des dégâts dans toutes les filières
Les cochenilles (Hemiptera, Coccidomorpha) sont présentes dans toutes les filières agricoles, que ce soit en arboriculture fruitière (Kreiter et al., 2006 ; Siham & Kreiter 2009), dont l'olivier (Panis, 1999), en maraîchage (Kreiter et al., 2009), sur les arbres d'alignement (Audant et al., 2005), en viticulture (Pérez et al., 2008), sur des plantes ornementales (Kreiter et al., 2006) et sur des plantes à parfum (Germain et al., 2015).
Leurs dégâts, souvent corrélés avec l'intensité des populations, peuvent être d'ordre agronomique (spoliation de sève, limitation de la photosynthèse et de la photorespiration, parfois transmission de pathogènes tels que les trichovirus A et B (GVA, GVB) sur la vigne, ou économique (écarts de triages). En cultures ornementales, leur simple présence peut entraîner une dépréciation de la plante, déclarée alors impropre à la vente ; elles sont présentes dans toutes les sous-filières (fleurs coupées, plantes en pot, arbres d'alignement, buissons de jardins, arboriculture ornementale, fleurs comestibles...).
Échantillonner pour actualiser les connaissances
Depuis une vingtaine d'années, la diversité des cochenilles sur les cultures ornementales en serre a fait l'objet de plusieurs études (Picart et Matile-Ferrero 2000 & 2001 ; Germain et al., 2003 ; Matile-Ferrero et al., 2004 ; Germain et al., 2005 ; Foldi et Germain, 2018). Toutefois, devant la persistance du problème « cochenille », face au risque lié à l'arrivée d'espèces exotiques incluant des espèces de quarantaine (par exemple Unaspis citri ou des espèces du genre Margarodes) et compte tenu de certaines incertitudes relatives à leurs cortèges d'ennemis naturels, ce travail reste toujours d'actualité.
L'objectif de ce travail est de caractériser et d'actualiser l'identification des cochenilles dans plusieurs régions de France où les cultures de plantes ornementales représentent un réel intérêt économique et là où les stations du réseau Astredhor ont alerté, au travers d'une enquête préliminaire initiée par l'Inrae, d'un potentiel risque des cochenilles sur les cultures. Pour ce faire, deux méthodes d'analyse ont été utilisées afin d'établir des correspondances entre une méthode classique de détermination sur la base de caractères morphologiques et une méthode faisant appel à la biologie moléculaire. Enfin, dans un second temps, ce travail devra dresser une liste des parasitoïdes récoltés des différentes cochenilles inventoriées dans les différentes régions prospectées afin de déterminer si on peut disposer, dans un environnement proche, de nouveaux auxiliaires potentiellement utilisables en biocontrôle.
Identification morphologique et moléculaire des cochenilles
Le réseau piloté par Astredhor
Le réseau d'échantillonnage est en premier lieu composé de sept des dix stations d'expérimentation de l'institut technique de l'horticulture Astredhor réparties sur l'ensemble des régions continentales françaises(3) et d'un groupement de conseillers, le Bureau horticole régional (BHR) près d'Angers. Des prélèvements ont été réalisés par ces structures dans leurs cultures, mais aussi parfois dans des pépinières avoisinantes. En complément, de nombreux échantillons sont parvenus de deux jardins botaniques, celui du parc de la Tête d'or situé à Lyon et celui du parc Phoenix situé à Nice. Les deux dernières sources principales d'échantillons ont été la pépinière municipale de la ville de Nice et une propriété privée offrant une grande diversité de plantes ornementales dans les Alpes-Maritimes.
Organisation des prélèvements
Chaque rameau infesté est caractérisé par le nom du récolteur, le lieu (région, commune, lieu-dit), la date de récolte, la plante-hôte et, éventuellement, des conditions particulières de culture (serre chauffée, tunnel extérieur, pépinière, jardin, etc.). Une fois prélevés et mis en sacs avec un tampon de ouate humidifiée, les végétaux atteints sont expédiés à la station du Cream où les cochenilles seront triées et individualisées. La fréquence des envois peut varier d'une ou deux fois par mois à une fois par semaine, en fonction des populations de cochenilles. Une fois reçus, les échantillons de végétaux attaqués sont observés sous la loupe binoculaire, afin de faire un premier tri entre les différentes familles, voire espèces de cochenilles. Chaque cochenille ainsi triée est mise en tube Eppendorf (0,5 cc). Une partie des tubes est envoyée à l'Anses (Laboratoire d'entomologie et des plantes invasives) à Montpellier pour une analyse morphologique et une autre partie à l'institut Sophia Agrobiotech pour une détermination moléculaire. Il est à noter que l'identification morphologique ne peut être réalisée que sur le stade adulte des femelles. Les larves sont conservées pour l'analyse moléculaire.
Techniques de montage des cochenilles pour analyse morphologique
Les insectes sont placés dans un verre de montre contenant une solution d'hydroxyde de potassium (KOH, 1 mole/litre) chauffé mais sans ébullition, jusqu'à ce que les tissus internes soient complètement expulsés. Les insectes sont transférés dans de l'eau distillée pour éliminer l'excès de KOH. Par la suite, les cochenilles sont placées dans une solution de colorant, composée pour un tiers d'eau distillée, un tiers d'acide lactique et un tiers de glycérol puis saturée en fuchsine acide initialement sous forme de poudre. On laisse tremper les spécimens dans cette solution jusqu'à ce que les parties chitinisées soient colorées. Les individus colorés sont ensuite transvasés dans un bain d'acide acétique pour environ une heure de façon à fixer le colorant. Un dernier transfert dans un bain d'essence de lavande est réalisé, assurant une bonne miscibilité de la préparation dans le baume du Canada. Une goutte de ce baume est déposée au centre d'une lame et chaque individu y est déposé, face dorsale vers le haut. Une étiquette est collée sur la droite de la lame indiquant les informations transmises par le Cream : collecteur, date de capture, localité, plante-hôte et numéro d'identification. Après analyse, le nom de la cochenille, l'identificateur et la date d'identification sont indiqués sur l'étiquette de gauche. Les lames sont conservées horizontalement, puis une fois sèches verticalement et alimenteront les collections de l'Anses.
Caractérisation moléculaire des échantillons
Pour chaque individu, l'ADN est extrait à partir de kits commerciaux classiques. Une partie de la solution ainsi obtenue est prélevée pour réaliser l'étape de PCR (polymerase chain reaction). Cette réaction vise à multiplier en un très grand nombre de copies une petite portion de l'ADN initial, cette portion étant préalablement définie par le choix d'un couple d'amorces adapté aux taxons étudiés et au marqueur moléculaire privilégié. Concernant le marqueur moléculaire justement, le choix s'est notamment porté sur une portion du gène mitochondrial cytochrome oxydase I (COI), ce marqueur étant couramment utilisé pour étudier la diversité spécifique chez les insectes. Les produits issus de la PCR sont ensuite séquencés par une société spécialisée, ce qui permet de lire cette portion d'ADN, son alphabet reposant sur quatre lettres différentes (les bases A, C, G et T). Le travail suivant relève ensuite de la bio-informatique, puisqu'il s'agit de comparer les séquences obtenues entre elles ainsi qu'avec des séquences déjà disponibles au sein de Genbank, une base de données internationale.
Une diversité de cochenilles sur plantes d'ornement
Plus de cinquante espèces
Entre janvier 2017 et juin 2019, un total de 1 333 échantillons de cochenilles ont été collectés, répartis sur 67 familles botaniques et plus de 160 espèces végétales, certaines espèces végétales étant parfois représentées par plusieurs variétés ou clones (cas des agrumes en particulier) (Tableau 1).
De nouvelles espèces potentielles en France
À l'occasion de leur synthèse, Foldi et Germain (2018) avaient dénombré 408 espèces de cochenilles réparties en 159 genres et 21 familles dans toutes les filières agricoles en France. En filière ornementale, nos travaux sur sept régions françaises recensent 57 espèces, réparties sur 37 genres et six familles. Ce décompte témoigne de la diversité des cochenilles auxquelles doivent faire face les producteurs et conseillers techniques dans cette filière, ainsi que les gestionnaires d'espaces verts.
Parmi nos échantillons, le genre Unachionaspis (famille des Diaspididae) est nouveau pour la France, l'espèce n'ayant pas encore été identifiée. Vraisemblablement, il existe trois espèces dans ce genre, U. bambusae, U. signata et U. tenuis (hypothèse privilégiée par la biologie moléculaire), les trois espèces s'attaquant aux Poaceae du genre Bambusa. Parmi les nouvelles cochenilles de la famille des Diaspididae, on constate aussi, la présence d'Acutaspis umbonifera, sur Anthurium obtusilobum, au parc de la Tête d'or à Lyon.
Deux espèces de cochenilles farineuses pourraient être aussi nouvelles pour la France métropolitaine, Phenacoccus solenopsis observée sur du lierre (Hedera helix) prélevé dans une propriété privée dans les Alpes-Maritimes et Planococcus minor observée en Nouvelle-Aquitaine au GIE Fleurs et plantes à Villenave-d'Ornon sur Ademium. Une vérification par la biologie moléculaire doit être entreprise afin de confirmer ces résultats. Quant à Trionymus diminutus, il ne figure pas sur la liste de Foldi et Germain en 2018, mais a fait l'objet de son signalement en 2001 par Foldi et par Matile-Ferrero et al. en 2004.
Ceroplastes ceriferus pourrait aussi être nouveau pour la faune française, mais un seul individu a été prélevé sur un érable du Japon (Acer japonicum) en pépinière par la station du Ratho à Romans-sur-Isère. D'autres prélèvements devront être effectués afin de pouvoir confirmer l'espèce et sa présence en France.
Le risque « cochenilles » en cultures ornementales
Pseudococcus viburni, la plus rencontrée
S'il n'est évidemment pas exhaustif, le recensement mené permet de préciser certains aspects liés au risque cochenilles en cultures ornementales.
Au niveau géographique, le plus grand nombre d'espèces de cochenilles trouvées s'élève à 46 pour la région PACA. Il est toutefois difficile de savoir si cette situation est la conséquence de l'échantillonnage plus poussé et/ou de conditions écologiques ou climatiques favorables. Les nombres d'espèces pour les autres régions sont les suivants : onze en Bretagne, cinq en Nouvelle-Aquitaine, six en Grand-Est, dix en Auvergne Rhône-Alpes, cinq en Pays de la Loire, et une en Normandie. Les résultats doivent être pris avec précaution car les temps et les surfaces prospectées ne sont pas forcément comparables.
L'espèce de cochenille la plus rencontrée est Pseudococcus viburni, récoltée dans les différentes régions, excepté en Auvergne-Rhône-Alpes. Cette pseudococcine a fait l'objet de nombreux travaux en France en cultures maraîchères (Germain et al., 2003 ; Graille et al., 2003, Kreiter et al., 2005, Kreiter et al., 2006), et en arboriculture fruitières (Kreiter et al., 2006). Des stratégies de lutte biologique à l'aide d'auxiliaires locaux par lâchers inondatifs ou inoculatifs ont été entreprises et ont donné des résultats parfois mitigés d'une région à l'autre notamment en serre de tomates (Kreiter et al., 2005 ; Souriau et al., 2006). En revanche, en arboriculture fruitière, l'introduction dans les vergers d'Acerophagus flavidulus dans le sud de la France (Kreiter et al., 2006) a permis de contrôler les populations de P. viburni.
Des cochenilles polyphages et des plantes refuges
En termes de capacité d'exploitation de plantes ornementales, les espèces les plus polyphages sont : Planococcus citri (21 espèces végétales ; tous milieux, jardins, serre chauffée ou froide), Phenacoccus madeirensis, rencontrée sur quinze espèces végétales (très présente en serres) ; Pseudococcus longispinus (douze espèces végétales ; jardins, serres froides) ; Pseudococcus viburni (onze espèces ; jardins, serres froides et chauffées) ; Saissetia coffeae (onze espèces, serres chauffées, milieux souvent humides) ; Coccus hesperidum (dix espèces, jardins, serres de collections) ; Icerya purchasi (dix espèces) ; Aspidiotus nerii (neuf espèces jardins, serres froides et chauffées) ; Protopulvinaria pyriformis (neuf espèces, jardins, serres) ; Chrysomphalus aonidum (huit espèces, arbres d'alignements en pots, serres chauffées) ; Hemiberlesia lataniae (huit espèces ; serres froides) et Diaspis boisduvalii (six espèces ; serres chauffées).
Sur un plan écologique, cette plasticité à s'adapter à des végétaux parfois très différents augmente considérablement le potentiel de survie des cochenilles (exploitation de zones refuges, à l'abri de traitements physiques ou chimiques). Elle n'est toutefois pas forcément liée à sa dangerosité. Certaines cochenilles spécifiques de familles botaniques sont plus dangereuses économiquement que d'autres ayant une capacité d'exploitation beaucoup plus importante. C'est le cas par exemple d'Unaspis yanonensis, spécifique des agrumes, présente dans les jardins et les vergers en région PACA et en Corse, qui peut entraîner des pertes irréversibles pour la culture.
Dans les inventaires réalisés, certains végétaux sont plus enclins à héberger plusieurs espèces de cochenilles. En PACA, cinq espèces végétales hébergent le plus grand nombre d'espèces de cochenilles sont l'agrume (Citrus spp.) avec neuf espèces de cochenilles, le laurier sauce (Laurus nobilis), le strelitzia, le lierre (Hedera helix) et l'arum (Zantedeschia aethiopica) en hébergeant cinq espèces. Sur les autres végétaux, au maximum trois espèces de cochenilles ont été recensées. Pour les plantes ornementales où le « zéro défaut » de la plante ou de la fleur est souvent privilégié, cette donnée est importante pour identifier les plantes a priori plus susceptibles d'être endommagées. Il semble évident que le cumul des symptômes liés à la présence de plusieurs cochenilles augmente le risque d'écarts de triage.
De nouvelles plantes-hôtes !
De nouvelles associations plantes-cochenilles ont été observées. Nous avons dressé la liste des plantes nouvellement identifiées comme végétal-hôte en la comparant à la base de données Scalenet(4) et aux différents travaux notamment ceux de Matile-Ferrero et al. (2004) et de Germain et al. (2003) et Germain et Matile-Ferrero (2005) (Tableau 2).
Ces nouvelles associations cochenilles/plantes renforcent l'hypothèse que certaines cochenilles sont capables d'exploiter des hôtes végétaux très différents. C'est particulièrement le cas chez les Pseudococcidae. Cette plasticité complique évidemment la prévision du risque et la gestion de leurs populations.
Correspondance morphologie/ADN : quelques surprises
D'un point de vue taxonomique, ce travail a contribué à compléter le travail de mise en correspondance entre caractérisation morphologique et caractérisation moléculaire chez les cochenilles (Abd-Rabou et al., 2012 ; Beltra et al., 2012 ; Normak et al., 2019 ; Park et al., 2011 ; Sethusa et al., 2014 ; Wang et al., 2015). C'est un enjeu majeur dans la mesure où, comme pour de nombreux groupes de ravageurs ou d'auxiliaires des cultures, les experts en identification morphologique sont rares et souvent débordés par les demandes. Dans ce contexte, les méthodes moléculaires peuvent permettre non seulement d'accélérer le débit des identifications, mais également de traiter des stades qui ne sont pas identifiables morphologiquement (oeufs, larves, mâles adultes). D'une façon générale, les résultats obtenus ici sur les critères morphologiques et moléculaires se sont révélés cohérents. C'est finalement avec la famille des Diaspididae que la situation reste la plus complexe comme l'illustre l'encadré ci-dessus.
(1) https://www.umt-fiorimed.fr(2) Ce volet fera l'objet d'une prochaine publication dans Phytoma.(3) Arexhor Grand-Est (Grand-Est), Arexhor Seine-Manche (Normandie), Cream et Scradh (PACA), CATE (Bretagne), Ratho (Auvergne-Rhône-Alpes), GIE Fleurs et plantes (Nouvelle-Aquitaine).(4) http://scalenet.info/
RÉSUMÉ
CONTEXTE - Les plantes ornementales abritent et alimentent un grand nombre d'espèces de cochenilles, que ce soient dans les jardins/espaces verts, les collections botaniques ou les exploitations horticoles ornementales. C'est la raison pour laquelle les partenaires de l'UMT FioriMed ont piloté de janvier 2017 à décembre 2019, le projet Cochorti, financé par un programme CasDar « Recherche technologique ».
ÉTUDE - Des stations d'expérimentations d'Astredhor, Inrae et la chambre d'agriculture des Alpes-Maritimes ont échantillonné divers végétaux infestés par des cochenilles en cultures ornementales dans sept régions françaises. Les cochenilles ont ensuite été déterminées par l'Anses à partir de critères morphologiques et, parallèlement, par Inrae sur des bases moléculaires. Une liste des cochenilles a été dressée, comportant de nouvelles espèces en France, ainsi que les supports végétaux nouvellement recensés sur lesquels elles ont été prélevées.
RÉSULTATS - S'il ne peut prétendre à l'exhaustivité, l'échantillonnage réalisé a mis en évidence :
- une grande diversité d'espèces ;
- une quinzaine d'espèces de cochenilles particulièrement problématiques par leur large distribution géographique et/ou leur spectre d'hôtes étendus ;
- des plantes pouvant être des zones-refuges potentiellement problématiques pour d'autres filières agricoles comme le maraîchage ou l'arboriculture fruitière ;
- de nouvelles associations cochenilles/plantes qui jusqu'alors n'étaient pas référencées dans la littérature scientifique.
MOTS-CLÉS - Cochenilles, plantes ornementales, identifications, échantillonnage.
Caractérisation moléculaire des cochenilles de la famille des Diaspididae
L'identification des cochenilles sur des bases morphologiques reste une tâche complexe effectuée par un petit nombre de spécialistes. C'est pourquoi de nombreux efforts ont été consacrés depuis une quinzaine d'années à l'établissement d'une correspondance entre caractérisations morphologiques et moléculaires. Le projet Cochorti a participé à ce travail avec quelques limites mais aussi quelques surprises, principalement concentrées dans la famille des Diaspididae.
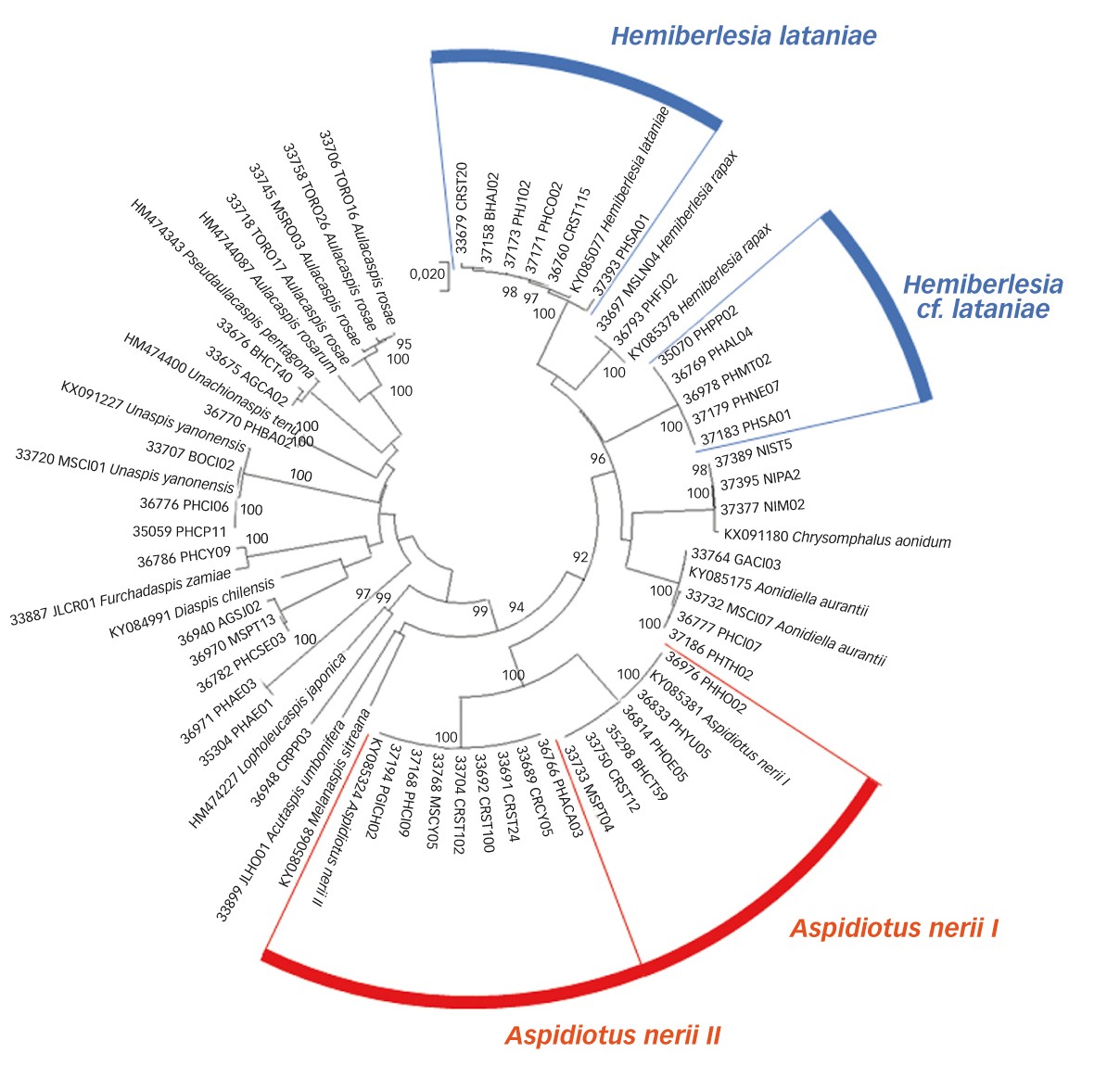
« L'arbre » ci-contre matérialise les distances moléculaires entre des individus issus du projet Cochorti (code à cinq chiffres propre aux activités moléculaires suivis d'un code propre à l'échantillon et, enfin, d'un nom de genre et d'espèces) parfois accompagné d'une identification morphologique et des individus caractérisés indépendamment (code Genbank commençant par deux majuscules).
Au registre des limites, on constate que le nombre d'espèces caractérisées sur des bases moléculaires (treize) reste encore bien inférieur au nombre d'espèces identifiées à partir des caractères morphologiques (vingt-quatre) (Tableau 1). Ceci s'explique, d'une part, parce que le processus de caractérisation moléculaire n'aboutit pas toujours et/ou, d'autre part, parce que l'identification morphologique a été privilégiée pour les spécimens a priori « rares ». Une autre limite est notre incapacité à donner un nom à l'un des groupes d'individus (« espèce non identifiée » sur l'arbre). Il s'agit probablement d'une espèce du genre Diaspis.
Au registre des surprises, le travail de caractérisation moléculaire a permis de mettre en évidence deux cas où il existe vraisemblablement une structuration invisible avec les caractères morphologiques jusque-là utilisés. Le premier cas concerne l'espèce Aspidiotus nerii qui apparaît subdivisée en deux sous-groupes distincts matérialisés par les deux secteurs rouges. En l'état, il est difficile de savoir s'il s'agit de variations à l'intérieur de l'espèce A. nerii ou de deux espèces-soeurs. Une situation comparable se retrouve avec l'espèce Hemiberlesia lataniae. Les individus correspondants se scindent en deux groupes matérialisés par les deux secteurs bleus. Ici, la divergence moléculaire entre les deux sites suggère plutôt l'existence de deux espèces.
POUR EN SAVOIR PLUS
CONTACTS : philippe.kreiter@inrae.fr
nicolas.ris@inrae.fr
valerie.balmes@anses.fr
Fabien.Robert@astredhor.fr
g.japoshvili@agruni.edu.ge
sgraverol@alpes-maritimes.chambagri.fr
bparis@alpes-maritimes.chambagri.fr
REMERCIEMENTS
Ces travaux ont pu être réalisés grâce à un financement du ministère de l'Agriculture dans le cadre d'un projet CasDar. Les auteurs remercient les stations de l'Institut Astredhor et le BHR qui ont participé à la collecte d'échantillons et nos contacts sur place notamment Mmes Notte et Lhoste-Drouineau, MM. Mary, Foucher, Gros et Déogratias. Nous remercions également tous les participant(e)s hors stations qui ont apporté leur contribution dans cette collecte de données : M. Le Sann (STH), M. Coche, producteur de violettes et de roses (Tourrettes-sur-Loup), M. Coutant (service Parc et jardin de la ville de Nice, CPHM), M. Bailet (parc Phoenix -Nice) ; Mme Mellet (parc de la Tête d'or-Lyon), M. Kreiter (Les jardins du Haut Pays) ; Mme et M. Dir (domaine de La Vignette-Mouans-Sartoux) ; M. Caporalino (coopérative agricole de Cagnes-sur-Mer) ; La Pépinière Lebas (Quettreville-sur-Sienne) ; la Pépinière Gautier (Muneville-sur-Mer) ; Mme Legoff, MM. Bazzano et Borowiec (Inrae).
HOMMAGE
Jean-François Germain, coauteur de ce travail, nous a quittés en mai 2019. Ses compétences en taxonomie des cochenilles et ses qualités humaines faisaient de lui un collaborateur particulièrement précieux et agréable. Nous tenions à lui rendre hommage à l'occasion de la parution de cet article.
 Imprimer
Imprimer