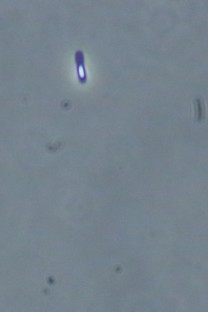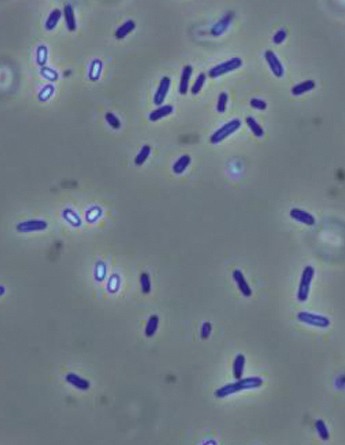
> 1. Cellules de Bacillus amyloliquefaciens subsp. plantarum souche D747 vues au microscope sous contraste de phase, mag. × 1 000. Les endospores apparaissent avec un centre blanc et les cellules végétatives en bleu foncé. > 2. Endospore en train de se former dans une cellule végétative.

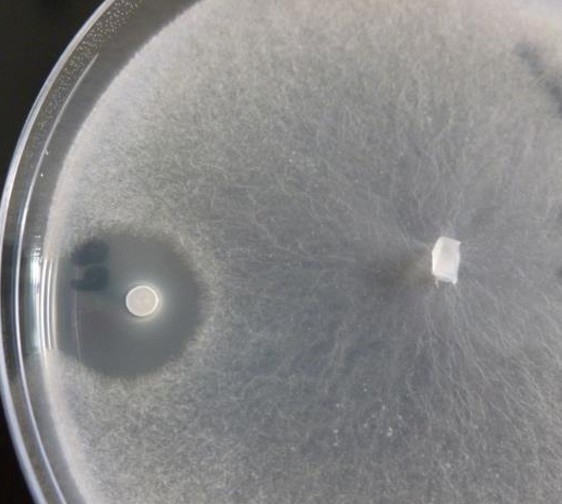
3, 4 et 5. Antibiose sur B. cinerea, S. sclerotiorum, et Monilinia spp. Zones d'inhibition visibles à droite de chaque image, autour de la colonie de B. amyloliquefaciens subsp. plantarum souche D747, causées par les lipopeptides qui diffusent dans l'agar et inhibent la croissance des champignons. 6. Développement de Botrytis sur fraises après application d'Amylo-X WG. 1 : témoin non inoculé ; 2 : témoin inoculé non traité ; 3 et 4 : Amylo-X WG ; 5 : Amylo-X WG autoclavé.
CARACTÉRISTIQUES TOXICOLOGIQUES ET ÉCOTOXICOLOGIQUES
Toxicologie
Bacillus amyloliquefaciens subsp. plantarum souche D747 ne possède pas de potentiel toxique, infectieux ou pathogène pour l'homme (Tableau 1).
La souche n'est pas inscrite sur la liste à l'annexe III de la directive 2000/54/CE du 18 septembre 2000 concernant la protection des travailleurs contre les risques liés à l'exposition à des agents biologiques au travail. Elle bénéficie du statut de présomption d'innocuité reconnue (Qualified Presumption of Safety - QPS) tel qu'établi par le comité scientifique de l'autorité européenne de sécurité des aliments (EFSA).
Écotoxicologie
Sur la base des études disponibles, Bacillus amyloliquefaciens subsp. plantarum souche D747 ne présente pas d'effets sur les oiseaux, ni sur les mammifères, ni sur les organismes aquatiques. Aucun signe de toxicité, infectiosité ou pathogénicité n'a été observé, ni aucun effet sur les vers de terre, les abeilles et autres arthropodes utiles (Tableau 2). L'application de cette souche D747, naturellement présente dans l'environnement, ne perturbe pas la microflore naturelle : elle correspond à une fluctuation de population bactérienne dans le biotope de l'agent pathogène ciblé.
Dans le sol, les endospores de Bacillus peuvent survivre sur une longue période. Mais les protozoaires, les prédateurs bactériens, les bactériophages et les rayons UV réduisent les populations de cellules végétatives et de spores et provoquent leur déclin constant jusqu'à ce que l'équilibre soit atteint, à un niveau n'excédant pas celui des populations naturellement présentes.
Dans l'eau, les endospores de Bacillus risquent peu de germer et former des cellules végétatives, vu la compétition pour les rares nutriments disponibles face à d'autres micro-organismes plus adaptés à ce milieu.
Dans l'air, les endospores de Bacillus peuvent se disperser sur des distances supérieures à 200 mètres selon la vitesse du vent. Mais la contamination de l'air se réduit rapidement du fait de la décantation des spores et de l'élimination des cellules végétatives par les rayons UV(Nicholson 1995).
PROPRIÉTÉS BIOLOGIQUES
Biologie
Bacillus amyloliquefaciens vit dans le sol. Il y trouve l'humidité qui lui convient ainsi que ses nutriments. Comme d'autres Bacillus, si les conditions de vie sont défavorables, il forme des endospores (alias spores). Celles-ci peuvent résister longtemps à la sécheresse, aux températures très élevées et très basses et aux UV. C'est sous cette forme que la bactérie est commercialisée. Si les conditions d'humidité, de température et de nourriture sont réunies, les spores germent et se transforment en cellules végétatives (actives) capables de se multiplier et former des colonies. Si les conditions se montrent à nouveau difficiles, chaque cellule redevient une endospore (photos 1 et 2).
Modes d'action : antagonisme
L'antagonisme direct est dû aux lipopeptides, molécules (composées d'un cycle peptidique lié à une chaîne d'acide gras) secrétées par les colonies microbiennes lorsqu'elles atteignent une taille suffisamment grande. Elles inhibent la croissance et/ou la germination d'un grand nombre de champignons pathogènes (photos 3, 4 et 5).
Appliqués lors d'un traitement avec le produit à base de la souche D747, les lipopeptides agissent sur les spores des pathogènes présents sur le feuillage à l'application ou y arrivant peu après. En revanche, ils n'ont pas d'effet sur un pathogène déjà entré dans le végétal.
Pour prouver l'effet des lipopeptides, le laboratoire biocontrôle Certis Europe a réalisé un test. Des fraises récoltées ont été stérilisées en surface puis traitées à l'Amylo-X WG. 24 heures après, elles ont été inoculées avec des spores de Botrytis. Dans un cas, le produit a été autoclavé, tuant les bactéries par la température et la pression mais conservant les lipopeptides, molécules très stables.
Après l'observation du développement de Botrytis sur les fraises traitées, l'efficacité du produit subsiste, preuve du rôle des lipopeptides (photo 6).
Stimulation des défenses
Au contraire des animaux, les plantes n'ont pas de cellules spécialisées dans la reconnaissance des pathogènes, mais toutes leurs cellules vivantes possèdent des récepteurs qui détectent les motifs moléculaires associés aux pathogènes. La plante prépare alors ses tissus à une attaque imminente. Les éliciteurs jouent le rôle de signalement, permettant à la plante de mettre en place ses mécanismes de défense avant l'attaque. Une fois appliqué sur les organes, l'éliciteur doit franchir la barrière hydrophobe que sont la cuticule et les cires afin d'atteindre les cellules, qui le perçoivent par des récepteurs internes ou situés dans leur membrane cellulaire.
La chute des pétales créant des blessures, ou bien les stades où la baie de raisin a une peau très fine sont des exemples de stades critiques d'infection. C'est à ces mêmes stades que les cellules sont atteignables par les éliciteurs. Il est donc impératif d'appliquer ces produits au tout début des périodes propices aux infections.
Un éliciteur sollicite la plante, d'où un coût énergétique. Le niveau de réponse dépend de l'état physiologique de la plante. Les impacts de son âge, de celui des feuilles et des facteurs externes (température, etc.) sont aujourd'hui mal connus.
Dans Amylo-X WG, ce sont majoritairement les lipopeptides qui font s'amorcer les mécanismes de défenses des plantes.
Via son laboratoire biocontrôle, Certis Europe a étudié la capacité de stimulation du produit sur salade in planta.
Dans cette étude, il a été appliqué sur le sol, puis les feuilles de laitue ont été inoculées par Sclerotinium sclerotiorum. Ainsi, le produit est appliqué dans un autre compartiment que le lieu d'infection.
On note dans ces conditions une bonne protection des laitues, indiquant que des molécules signal sont formées après l'application du produit et transportées de façon systémique dans la plante, qui a pu déclencher les réactions ayant abouti à la défense des parties aériennes (photos 7 à 10).
La compétition
En conditions favorables, les colonies se développent et forment un biofilm qui exclut la présence d'autres micro-organismes (compétition pour l'espace). De plus, elles consomment les nutriments (ex. : exsudats racinaires) dont les pathogènes ont besoin (compétition pour les nutriments).
Certis Europe a observé au microscope le comportement des bactéries après application foliaire : elles ne forment pas de colonies. En revanche, les spores peuvent se maintenir en masses jusqu'à une dizaine de jours. Ainsi, la compétition pour les nutriments est peu probable, et celle pour l'espace serait passive. Les masses de spores se rassemblent à la surface du végétal traité et forment une barrière physique dans les zones favorables aux pathogènes - par exemple à la base des trichomes (« poils » végétaux) et près des stomates.
Spectre d'activité
Les modes d'action étant non spécifiques, le produit possède un large spectre. Il est efficace notamment sur la pourriture grise, les monilioses sur fleurs et fruits, les maladies de conservation, les sclérotinioses, la bactérie Pseudomonas (PSA) sur kiwi et le feu bactérien sur poire.
RÉSULTATS EXPÉRIMENTAUX ET RECOMMANDATIONS D'EMPLOI
Efficacité, sélectivité
Le produit est parfaitement sélectif des cultures sur lesquelles il est autorisé. Les tests sur de nombreuses cultures n'ont décelé aucune phytotoxicité.
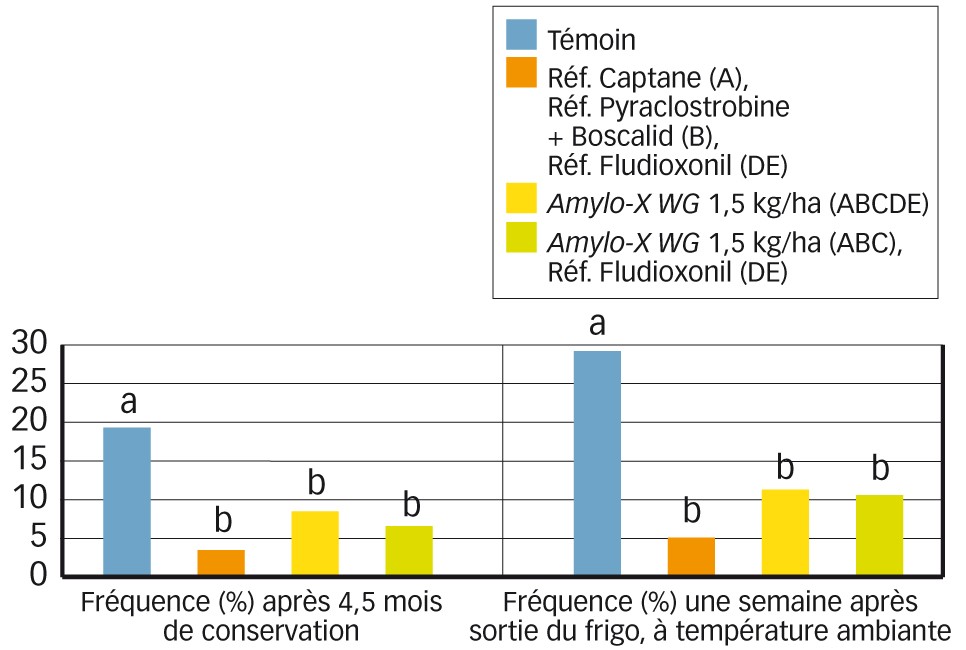
Pour l'efficacité, nous présentons ci-dessous des résultats sur des pommes. Dans cet essai, Amylo-X WG, appliqué à cinq reprises sur six semaines précédant la récolte 2017, est comparé à un programme à quatre traitements conventionnels. Le biofongicide permet une réduction très intéressante du nombre de fruits atteints par la gloeosporiose après la conservation puis à la sortie du frigo en 2018 (Figure 1).
Recommandations
Il existe des conditions optimales pour le développement des colonies bactériennes (T° 25-35 °C, pH 6-7, HR 100 %). Mais il est inutile de respecter ces conditions en application foliaire car il ne se forme pas de colonies. La compétition spatiale des masses de spores, la stimulation des défenses et l'antagonisme direct via les lipopeptides ne dépendent pas de ces facteurs.
L'action des lipopeptides et la compétition spatiale des spores sont des actions de contact. Seule la stimulation des défenses de la plante atteint d'autres organes que ceux traités. Pour les actions de contact, il est essentiel de couvrir de façon optimale toutes les parties du végétal à protéger. Certis Europe recommande donc de porter attention à la qualité de pulvérisation, avec un volume de bouillie permettant d'atteindre la limite du ruissellement.
Le produit, lessivable, doit être réappliqué si une pluie de 15 à 20 mm survient dans les trois jours après application. Les applications sont nécessairement préventives au début des stades sensibles aux infections. Il est intéressant d'appliquer le produit soit en début de cycle pour tirer parti de la stimulation des défenses, soit à la fin pour bénéficier de son profil sans LMR. Il est préférable d'alterner les applications avec d'autres produits plutôt qu'en mélange. Pour une efficacité optimale, il faut répéter les applications à intervalle de 7 à 10 jours. La dose peut en général être réduite à 1,5 kg/ha.
IDENTITÉ
Substance active
Nom scientifique : Bacillus amyloliquefaciens subsp. plantarum souche D747. Il s'agit d'une bactérie Gram-positive.
Genre, groupe et espèce : Elle appartient au groupe des B. subtilis(1). Les espèces B. amyloliquefaciens et B. subtilis, très proches, étaient toutes deux nommées B. subtilis avant d'être différenciées. Ce groupe se caractérise par une capacité de dégradation des glucides. D'ailleurs, le nom amyloliquefaciens vient du latin : « qui agit (faciens) en liquéfiant (lique) l'amidon (amylo) ». Les membres de l'espèce B. amyloliquefaciens sont naturellement présents dans l'environnement, notamment dans le sol et la rhizosphère. La littérature indique une aptitude supérieure de B. amyloliquefaciens par rapport à B. subtilis à coloniser les racines grâce à la formation de biofilm(2).
Sous-espèce : les sous-espèces plantarum et amyloliquefaciens ont été récemment distinguées. La première, celle de la souche D 747, a un mode de vie associé aux plantes(3).
Souche : approuvée depuis le 01/04/2015 (règlement [UE] n° 1316/2014), la souche D747 a été isolée pour la première fois au Japon en 2000 et différenciée sur la base de caractéristiques morphologiques et physiologiques, et par analyse moléculaire. Elle n'est pas génétiquement modifiée. Elle n'est pas classée pour la santé humaine et l'environnement au titre du règlement (CE) n° 1272/2008 (CLP). Elle a l'aspect d'une fine poudre de couleur beige.
Produit formulé
Nom : Amylo-X® WG - AMM n° 2160841.
Composition : 5 × 1010 UFC/g de B. amyloliquefaciens subsp. plantarum souche D747.
Formulation : granulé dispersable (WG), marron clair, conditionné en boîte de 1 kg.
Classement : non classé au titre du règlement CLP.
(1) L'autre groupe de Bacillus, celui des B. cereus, comprend des espèces pathogènes pour l'homme et une entomopathogène : B. thuringiensis.
(2) Efsa 2014.
(3) Zhang N & al., 2016.
Bibliographie
- EFSA, 2014, Conclusion on the peer review of the pesticide risk assessment of the active substance Bacillus amyloliquefaciens subsp. plantarum strain D747, EFSA Journal 2014;12(4):3624, 29 pp. doi:10.2903/j.efsa.2014.3624
- Nicholson W, 1995, Photoreactivation in the Genus Bacillus, Current microbiology, 1995; Vol. 31, pp. 362-364.
- Zhang N, Yang D, Kendall JRA et al., 2016, Comparative genomic analysis of Bacillus amyloliquefaciens and Bacillus subtilis reveals evolutional traits for adaptation to plant-associated habitats, Frontiers in Microbiology, 2016;7:2039. doi:10.3389/fmicb.2016.02039.

 Imprimer
Imprimer