L'enroulement chlorotique de l'abricotier (ECA) ou European stone fruit yellows (ESFY) inquiète la filière arboriculture fruitière, notamment en production d'abricots même si la maladie ne touche pas que ces derniers mais aussi d'autres fruits à noyau. Plusieurs synthèses récentes (5 ; 9 ; 10), notamment le chapitre consacré à l'ECA dans la Monographie de l'Abricot (CtiflEd., 2012), permettent d'avoir une vue d'ensemble des connaissances relatives à cette maladie. Nous souhaitons ici insister sur les résultats des recherches les plus récentes ayant des conséquences sur la gestion de l'ECA.
Identification de la maladie
Une histoire pour plusieurs noms
L'European stone fruit yellows (ES FY) est le nom générique des maladies responsables de dépérissements incurables des Prunus en Europe. En 1924, en France, Chabrolin signalait déjà des « dépérissements de l'abricotier par apoplexie ». Dix ans plus tard en Italie, Goidanich évoquait des symptômes de « leptonécrose » (nécrose des tissus phloémiens) sur prunier japonais.
Il faut attendre 1965 pour que Morvan et Castelain introduisent la dénomination « enroulement chlorotique de l'abricotier » (« apricot chlorotic leafroll » ou ACLR en anglais). Des symptômes de jaunissement (« peach yellowing ») ont également été associés à de forts déclins chez le pêcher (12).
D'autres termes existent dans la littérature pour désigner les mêmes dépérissements sur divers Prunus : « nectarine chlorotic leaf roll », « yellow disease of almond », « yellows disease of flowering cherry », « Italian rosette of peach », « dieback of apricot », etc.
Finalement, en 1994, toutes ces maladies ont été associées à un seul agent phytopathogène et le nom European stone fruit yellows a été adopté pour désigner la maladie associée (8).
Depuis une quinzaine d'années, l'amélioration d'outils moléculaires permettant de détecter puis de quantifier l'agent pathogène ont permis un progrès spectaculaire des connaissances sur cette maladie connue de longue date.
Phytoplasme responsable
L'ECA est causé par un phytoplasme nommé 'Candidatus Phytoplasma prunorum'.
Les phytoplasmes sont des bactéries sans paroi appartenant à la classe des Mollicutes. Ces parasites strictement intracellulaires colonisent les tubes criblés du phloème chez plus de 1 000 espèces végétales (13).
Ils n'ont jamais pu être mis en culture, ce qui rend aujourd'hui encore leur étude difficile. Observés par microscopie électronique en 1967, ils furent d'abord nommés « mycoplasma-like organisms » (MLO) vu leur ressemblance avec les mycoplasmes pathogènes d'origine animale. Le terme « phytoplasme » fut adopté en 1994 ; pour nommer les espèces, le terme générique 'Candidatus Phytoplasma' a été retenu provisoirement. La nomenclature distingue actuellement 18 groupes de phytoplasmes sur la base de l'homologie de séquence du gène de l'ARN ribosomique 16S, et de critères biologiques (6 ; 7 ; 14). 'Ca. Phytoplasma prunorum' appartient au groupe 16SrX, comme les phytoplasmes responsables de la prolifération du pommier (en anglais « apple proliferation » ou AP) et du dépérissement du poirier (« pear decline » ou PD) (15). Ces trois phytoplasmes phylogénétiquement apparentés sont transmis par des psylles du genre Cacopsylla.
'Ca. P. prunorum' a été identifié dans la plupart des pays d'Europe ainsi qu'en Turquie, Azerbaïdjan, Egypte et Tunisie. Une revue de la distribution de la maladie sera prochainement publiée (16).
Une maladie parfois difficile à caractériser
Les symptômes de l'ECA sont en général très caractéristiques, mais cette maladie est parfois difficile à identifier formellement visuellement.
Le symptôme le plus caractéristique est un débourrement précoce par feuillaison anticipée (photos A et D) dès janvier ou février voire plus tôt encore. On peut aussi constater des raccourcissement d'entre-nœuds (photo C). Mais la maladie ne se détecte parfois que par des symptômes plus tardifs : jaunissement des feuilles s'enroulant autour de la nervure principale (photos B et E), chute des fruits quelques jours avant leur maturité.
Le dépérissement conduit souvent à la mort de l'arbre.
Certains symptômes peuvent être confondus avec les effets d'altérations du système racinaire (pourridié, asphyxie) ou avec des flétrissements tardifs d'arbres entiers liés à une nécrose des tissus du tronc consécutive à une attaque de chancre bactérien.
Enfin, il s'écoule parfois plusieurs années entre le moment où un arbre a été infecté et celui où il exprimera des symptômes ; autrement dit en verger il peut exister des arbres dits « asymptomatiques ».
À l'heure actuelle il est difficile d'expliquer cette variabilité d'expression des symptômes. Il est probable que les conditions climatiques (hiver doux ou à l'inverse rigoureux, stress hydrique, etc.) et/ou le porte-greffe jouent un rôle important.
Un essai variétal multilocal (Vallée du Rhône/Pyrénées-Orientales) mis en place en 2006 a fourni récemment des exemples de cette variabilité des symptômes et confirmé que seule une analyse en laboratoire peut permettre l'identification sûre de la maladie et sa détection sur des arbres sans symptômes.
Identification du vecteur
Des psylles, pas des cicadelles
Longtemps recherché parmi les cicadelles, le vecteur de la maladie ne fut trouvé que tardivement par un chercheur italien qui démontra clairement que le psylle Cacopsylla pruni (Scopoli, 1763) était le vecteur naturel de 'Ca. P. prunorum' (2).
Le fait a été confirmé depuis par plusieurs autres équipes (4 ; 17). Quelques publications font état de la détection du phytoplasme dans des cicadelles (possible pour des insectes s'étant alimentés sur une plante infectée vu la sensibilité des outils actuels de détection), mais à ce jour aucune expérience biologique n'a démontré qu'elles étaient capables de transmettre 'Ca. P. prunorum'.
Compte tenu de la très forte spécificité de transmission des phytoplasmes du groupe 16SrX (les essais de transmission de l'un des trois phytoplasmes par les psylles vecteurs des deux autres sont restés infructueux), il serait surprenant que des insectes de familles différentes (cicadelles ou autres) puissent être vecteurs de 'Ca. P. prunorum'.
En fait, deux espèces sœurs
Nous avons récemment mis en évidence que C. pruni est en fait un complexe de deux espèces sœurs. Elles sont morphologiquement semblables mais présentent une importante différenciation génétique, et sont fortement isolées l'une de l'autre en termes de reproduction. Des échantillonnages menés depuis plusieurs années en France et en Europe montrent que les deux espèces n'ont pas la même répartition géographique, même si elles se chevauchent dans certaines zones comme la Salanque et la plaine de Valence.
Quelle que soit la région prospectée, nous trouvons des individus de l'une et/ou de l'autre espèce porteurs du phytoplasme dans des proportions de 1-3 %. La question de leur efficacité relative en tant que vecteurs de l'enroulement chlorotique de l'abricotier n'est pas encore tranchée, mais des transmissions du phytoplasme ont été obtenues à partir d'individus collectés dans des sites où chacune des deux espèces était respectivement majoritaire.
Pour le raisonnement des stratégies de lutte contre la maladie, on considérera pour l'instant les deux espèces comme une même entité nommée « C. pruni » par souci de cohérence avec les publications antérieures.
Il faudra d'autres expériences de transmission pour caractériser la capacité vectrice de chacune des espèces et affiner si nécessaire les préconisations de lutte.
Cycle de l'insecte et transmission
Une génération de psylle par an, sur Prunus et sur conifères
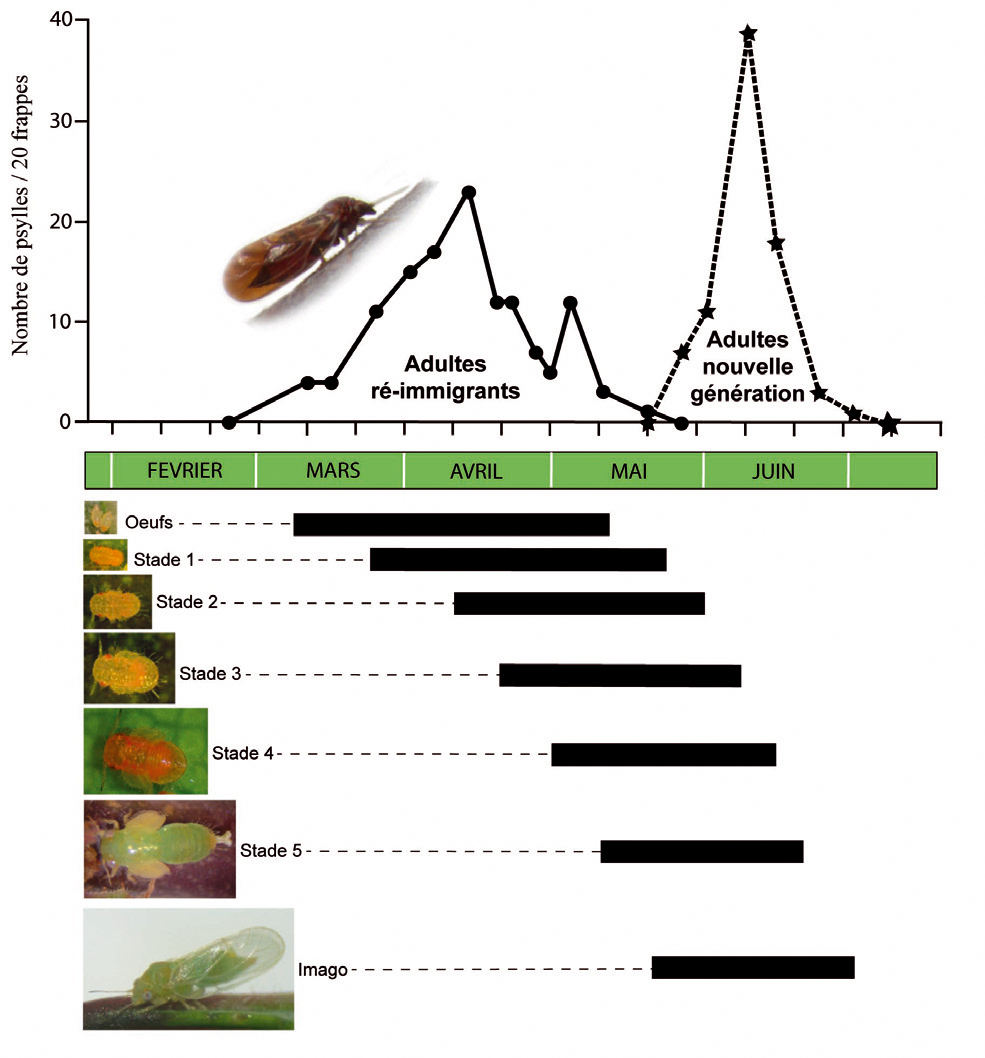
La dissémination naturelle du phytoplasme entre Prunus est étroitement associée au cycle biologique des insectes vecteurs. Nous avons reproduit expérimentalement le cycle, jusqu'alors hypothétique, de C. pruni (17) ; (Figure 2).
Cet insecte univoltin (une génération par an) vient se reproduire au printemps sur des Prunus et passe le reste de l'année sur des conifères (pins, sapins, épicéas). Selon les régions de France et les températures de fin d'hiver, les premiers psylles (ré-immigrants) sont observés généralement entre mi-février et début mars (Figures 1 & 2). Les premières pontes ont lieu rapidement et, après cinq stades larvaires, les jeunes adultes (imagos) émergent fin mai ou début juin et migrent aussitôt sur des conifères. Ils y restent environ 8 mois avant de migrer à nouveau vers les Prunus au printemps suivant.
C. pruni pond essentiellement sur des Prunus sauvages, en particulier les prunelliers (P. spinosa) et les myrobalans (P. cerasifera). Dans les vergers, ces psylles sont en général « introuvables » sur les arbres de Prunus cultivés (abricotiers, etc.), à l'exception des vergers de pruniers ou de pruniers japonais en production biologique. En revanche, les repousses de porte-greffe de type prunier sont très attractives.
Migration à l'échelle de la dizaine de kilomètres
Les connaissances actuelles permettent de dire qu'il y a deux mouvements migratoires (des sites de reproduction aux sites d'hivernage et vice-versa). Les distances de migration dépassent largement l'échelle d'une exploitation agricole. En effet, des prospections régulières ont montré que C. pruni se réfugie en nombre sur les conifères poussant en altitude, mais est introuvable dans la plaine du Languedoc sur les pins d'Alep proches de prunelliers (17) ; une situation identique a été décrite en République Tchèque (3).
En parallèle, l'étude de la structuration génétique des populations de C. pruni montre que des groupes d'individus distants de quelques dizaines de kilomètres n'appartiennent pas à une seule population panmictique. Cela signifie qu'à cette échelle les groupes d'individus ne se mélangent pas complètement. Ces deux résultats suggèrent que les migrations se déroulent à l'échelle de la dizaine de kilomètres. Par ailleurs, il n'y a pas de raison de penser qu'il existerait une association stricte entre un site d'hivernage et un site de reproduction donnés (migration aller-retour sensu stricto).
Transmission interannuelle, une latence record de 8 mois
Pour bien appréhender les modalités de la vection, il faut ajouter aux caractéristiques du cycle biologique de C. pruni une propriété remarquable de l'interaction entre le phytoplasme et son vecteur : une latence et une rétention longues dans l'insecte (Figure 2). Tous les stades sont capables d'acquérir le phytoplasme et de le multiplier en conditions expérimentales (18). On trouve ainsi des larves aux stades L3 ou L4 porteuses du phytoplasme en conditions naturelles. Mais une condition essentielle pour qu'il soit transmis est qu'il se soit suffisamment multiplié et accumulé dans les glandes salivaires de l'insecte : seuls les insectes porteurs de plusieurs millions de phytoplasmes parviennent à transmettre la maladie. Or, très rares sont les insectes qui, entre début mars et début juin, période de présence sur les Prunus en conditions naturelles, multiplient le phytoplasme à un niveau suffisant pour qu'il soit transmissible. Une transmission à un arbre cultivé par des imagos nés sur des Prunus sauvages infectés n'est pas impossible, mais ne peut qu'être rare.
En revanche, après leur départ des Prunus, les adultes ont le temps d'accumuler le phytoplasme. Ainsi, presque toutes les transmissions se font 8 mois après l'acquisition (un record chez les insectes vecteurs de phytopathogènes !), par des adultes réimmigrants ayant acquis le phytoplasme dans leur jeunesse.
Le phytoplasme étant transmis sur le mode persistant, les vecteurs restent infectieux jusqu'à la fin de leur vie : un même insecte peut donc infecter, dans un même verger, les différents arbres sur lesquels il se nourrit.
Un pathogène endémique
Afin d'évaluer la prévalence du phytoplasme dans ses différents hôtes (vecteurs, Prunus sauvages et cultivés), nous avons collecté des psylles dans plus de 400 localités réparties sur tout le territoire français. Nous avons également collecté des rameaux de prunelliers, myrobalans et abricotiers dans toutes les régions de production d'abricot.
Les tests réalisés sur l'ensemble de ces échantillons montrent que 'Ca. P. prunorum' est retrouvé partout en France dans les psylles ou les Prunus, dans les vergers et dans le milieu sauvage. Nous pouvons donc qualifier cette maladie d'endémique. C'est important pour la lutte : on ne peut pas l'envisager de la même manière pour un pathogène invasif et pour un pathogène endémique.
Dans le premier cas, une éradication est possible à condition de prendre des mesures très précocement. Dans le second cas, il faudra plutôt raisonner en termes de réduction des dégâts à un niveau économiquement acceptable, sans espérer d'éradication.
L'épineuse question des Prunus sauvages
Prunelliers et myrobalans, facteur important dans l'épidémiologie de l'ECA
Nos échantillonnages sur plusieurs années permettent de dresser deux constats sur la prévalence de la maladie dans l'environnement naturel.
Premièrement, les prunelliers et myrobalans sont très contaminés (50-100 % des échantillons collectés sur les massifs sont positifs en PCR) mais donnent une faible proportion de psylles ré-immigrants positifs en PCR (1-3 %). Cette contradiction apparente s'explique par le type d'échantillons analysés : la détection du phytoplasme dans les Prunus sauvages est faite sur la tige principale ou de grosses ramifications, mais les rameaux terminaux des mêmes plantes sont en général négatifs en PCR. Or les psylles se nourrissent sur les feuilles et les jeunes rameaux. On peut supposer que nous détectons des contaminations anciennes localisées dans la plante, mais que les plantes sources effectives sont bien moins nombreuses et que c'est d'elles que viennent les 3 % environ de psylles détectés positifs.
Deuxièmement, il n'y a pas de relation évidente entre les vergers et leur environnement proche. D'une part on détecte des Prunus sauvages contaminés hors zones de production fruitière et, d'autre part, il n'y a pas de corrélation entre l'intensité de contamination des Prunus sauvages et celle des vergers de Prunus alentour alors que tous sont hôtes du phytoplasme et des psylles (1).
Ces résultats s'expliquent par le fait que les psylles font deux mouvements migratoires (Figure 2), conduisant à une redistribution des insectes dans l'environnement. D'où une relative déconnection entre l'endroit où a été produit l'insecte infecté et celui où il transmettra la maladie.
Arracher massivement ?
Il est tentant de supposer qu'un moyen de limiter la dissémination de l'ECA serait d'arracher massivement les Prunus sauvages. Ce serait un mauvais choix pour au moins quatre raisons :
– faute de connaître l'échelle spatiale de redistribution des populations de psylles au cours de leurs mouvements migratoires, il est impossible de bien définir une zone d'élimination efficace ;
– la zone d'élimination devrait être étendue ; la difficulté pratique à localiser les Prunus risque d'entraîner une inefficacité (si les Prunus abondent ils seront impossibles à éliminer ; s'il y en a peu ils ne sont pas les principaux responsables des épidémies) et une incertitude : ces plantes drageonnent, repoussent avec vigueur et on ignore leur capacité à produire de jeunes pousses infectées par le phytoplasme ;
– si les Prunus sauvages disparaissaient de zones entières, il y a de fortes chances que les psylles ré-immigrant dans ces zones se rabattent sur les Prunus cultivés...
– les Prunus sauvages fournissent des services écologiques annexes : d'une part leur floraison précoce est utile aux pollinisateurs et, d'autre part, un psylle femelle pond plusieurs centaines d'œufs consommables par les populations de prédateurs généralistes régulant différents ravageurs dans les vergers.
Arracher en bordure de verger ?
Si l'arrachage des Prunus sauvages à grande échelle est indéniablement une mauvaise idée, une action localisée en bordure de vergers sur ces Prunus sauvages est envisageable. Mais faut-il les éliminer ou les protéger ?
À l'évidence, les Prunus sauvages proches des vergers ne sont pas les sources de contamination des arbres fruitiers voisins (les psylles contaminants viennent d'ailleurs et, réciproquement, ceux qui partent de ces plantes vont ailleurs). En revanche, ils attirent et maintiennent des psylles en plus grand nombre que les arbres fruitiers voisins. Sur la base de ces constats, deux options pourraient être envisagées.
La première consiste à parier sur le fait que les psylles atterrissent et restent sur les Prunus sauvages plutôt que dans les vergers : il y aurait alors une action protectrice (plante piège) à favoriser.
L'autre option est de parier que les Prunus sauvages risquent d'attirer des psylles plus nombreux ne distinguant pas toujours leur hôte préféré, ce qui pousse à éliminer les Prunus sauvages jouxtant les vergers.
En l'absence de données discriminantes entre les deux hypothèses, il semble préférable de privilégier la seconde ; une élimination très locale (bord de verger) limitera le risque et aura un effet négligeable sur le chaînon qu'est l'espèce prunellier dans l'ensemble des chaînes trophiques.
Dans les vergers, que faire ?
Éliminer les arbres infectés et les repousses de porte-greffe reste préférable
Certains éléments du raisonnement présenté ci-dessus s'appliquent aussi aux arbres cultivés : sont-ils des sources significatives de phytoplasme ? Ont-ils un impact sur l'état sanitaire des arbres voisins ?
La réponse à la première question dépend de l'espèce de Prunus cultivée et de la quantité de Prunus sauvages infectés à l'échelle régionale. En effet, seuls les bons hôtes de C. pruni (prunier, prunier japonais, myrobalans et repousses de porte-greffes de type prunier) sont, une fois infectés, des sources efficaces de psylles porteurs du phytoplasme. Encore faut-il que ces arbres se trouvent dans une région où le nombre total de Prunus infectés soit plus important dans les vergers que dans le compartiment sauvage ; sinon, leur contribution à la population de psylles infectés est négligeable. Dans les cas où toutes ces conditions sont réunies, il est souhaitable de réduire le nombre de vecteurs infectieux issus des vergers, en ciblant les derniers stades larvaires de C. pruni et en éliminant les vergers abandonnés et les arbres infectés dans la région considérée (dont il est difficile de définir les dimensions, comme déjà écrit...).
La seconde question concerne l'influence des arbres cultivés sur l'état sanitaire du verger. Comme pour les Prunus sauvages, le cycle épidémique ne permet pas la transmission entre arbres du même verger, mais l'état sanitaire du verger peut être influencé indirectement par l'attractivité de chaque arbre. En effet, les drageons et pousses de porte-greffe de type prunier attirent les psylles sur l'arbre voire ses voisins. Par ailleurs, les arbres infectés par les phytoplasmes pourraient avoir le même effet en émettant des composés odorants attractifs pour les psylles (11). Il faut donc supprimer les (re-)pousses de porte-greffe, et la prudence incite à se débarrasser aussi des arbres infectés.
Moyens de lutte complémentaires
Chaque vecteur infectieux peut se nourrir sur plusieurs arbres du verger et leur transmettre le phytoplasme. L'ECA est donc une maladie dont l'incidence en verger d'abricotiers ou de pruniers japonais peut être forte en l'absence de mesure de protection contre le vecteur, comme en agriculture biologique (AB).
Actuellement, outre les mesures prophylactiques préconisées, il est possible d'utiliser un traitement insecticide le plus spécifique possible lors de l'arrivée des vecteurs infectieux en fin d'hiver (avant floraison) ; ceci réduit le risque d'infection par l'ECA en empêchant les psylles d'infecter plusieurs arbres consécutivement. En revanche, pour protéger un verger donné, il est inutile de traiter contre les psylles émergeant en juin : ils partent en vacances loin des vergers !
En agriculture biologique, des essais en cours semblent montrer l'intérêt d'une barrière physique sur les arbres (pulvérisation d'argile) lors du retour des psylles (Koké, com. pers.).
Conclusion
Ce qu'on a déjà acquis
Le cycle de la transmission de l'ECA est aujourd'hui bien décrit. Ses caractéristiques (durée de latence, psylles vecteurs) font que le phytoplasme est transmis d'une année sur l'autre sur des distances assez grandes (à l'échelle régionale) mais, a contrario, rendent peu probables des transmissions entre arbres voisins.
On peut voir cette maladie comme un pathosystème naturel qui s'auto-entretient et touche accidentellement les espèces fruitières, notamment l'abricotier qui constitue pour lui un cul de sac épidémiologique.
Dans un tel contexte, il est illusoire d'espérer une éradication de la maladie à quelque échelle que ce soit (exploitation, bassin de production, France...).
Les moyens de lutte, outre l'évidente attention à accorder à la protection et à la surveillance stricte du matériel en pépinière, sont essentiellement en verger l'élimination des psylles à une période clé et l'élimination des arbres malades et des repousses de porte-greffe. L'arrachage permet de diminuer la prévalence (taux d'arbres malades à un moment donné) de la maladie dans la région où il est réalisé. Son effet sur l'évolution de l'incidence annuelle (taux d'arbres nouvellement malades sur un an) reste à mesurer. L'élimination des psylles lors de leur retour semble logique, son efficacité reste à mesurer.
Marges de progrès et circulation d'information
Nos connaissances doivent progresser sur certains points tels que la recherche de l'étendue de la zone de redistribution des psylles lors de leurs migrations et le rôle épidémiologique relatif des deux espèces sœurs de psylles. Il existe donc encore une marge de progression pour le contrôle de cette maladie.
Le cas de l'ECA illustre combien approfondir les connaissances sur le fonctionnement des pathosystèmes peut progressivement aider à affiner et faire évoluer la gestion des maladies, et combien la stratégie de gestion dépend du contexte écologique local.
Ainsi, le partage et la circulation d'informations entre les diverses structures impliquées, de la recherche aux pratiques en verger, sont essentiels pour améliorer la stratégie de lutte. C'est l'objet des réunions annuelles sur l'ECA organisées par le Ctifl, du BSV (Bulletin de santé du végétal), du Blogo Psylle (suivi hebdomadaire des populations de psylles sur 4 sites en France : http://cpruni.blogspot.fr/) et du Plan d'action ECA 2012 (prospection exhaustive des vergers d'abricotier pour la présence de l'ECA dans la Drôme, l'Ardèche et l'Isère : http://www.fredonra.com/).
Fig. 1 : C. pruni, vecteur de l'ECA se reproduit sur Prunus au printemps puis se réfugie sur conifères.
Courbes typiques (cas de l'année 2007) décrivant la dynamique des populations de Cacopsylla pruni dans la région de Montpellier sur prunelliers et périodes de présence des différents stades de développement de l'insecte.
 Imprimer
Imprimer