Les maladies du bois de la vigne, notamment l'esca, sont devenues très préoccupantes (Mugnai et al., 1999 ; Rumbos et Rumbou, 2001 ; Gimenez-Jaime et al., 2006 ; Bertsch et al., 2013). Plus aucun traitement chimique n'est autorisé contre l'esca, ce qui pousse à recourir aux méthodes alternatives.
L'une d'elles est la lutte biologique à l'aide de micro-organismes. Dans ce contexte, nous avons étudié l'action de Pythium oligandrum.
Prémisses de cette étude
Souches de Pythium oligandrum collectées et caractérisées
Le choix s'est porté sur P. oligandrum car cet oomycète est naturellement présent dans la rhizosphère des ceps de vigne de la région bordelaise (Gerbore et al., 2014). De plus, la littérature le décrit comme un agent de lutte biologique. Il peut exercer un effet direct sur les pathogènes ou indirect en stimulant les systèmes de défense de la plante. Cette induction peut être obtenue en appliquant des protéines élicitrices produites par P. oligandrum (l'oligandrine, POD1 et POD2) sur le végétal (Mohamed et al., 2006 ; Takenaka et al., 2006 ; Takenaka et Tamagake, 2009).
Nous avons isolé et purifié des souches de P. oligandrum à partir de racines de vigne prélevées dans le vignoble bordelais. Nous les avons caractérisées au niveau génétique (Gerbore et al., 2014). Toutes nos souches isolées de P. oligandrum produisent de l'oligandrine mais en quantités variables.
Choix de l'espèce pathogène
Nous avons ensuite analysé les réponses de la plante face à l'infection par Phaeomoniella chlamydospora (Pch) suite à la colonisation des racines par P. oligandrum. Le choix a porté sur Pch car c'est un des pionniers de l'esca. Son inoculation dans le bois permet de reproduire des lésions nécrotiques.
Les réponses de la vigne ont été étudiées au niveau moléculaire par analyse RT-qPCR de l'expression de vingt-deux gènes impliqués dans les mécanismes de défense de cette plante (Dufour et al., 2013).
Travail réalisé sous serre
Dispositif expérimental
Des boutures de cabernet sauvignon (greffons certifiés par la chambre d'agriculture de Gironde) âgées de 8 semaines ont été utilisées sous serre en conditions contrôlées. L'essai a été randomisé (trois répétitions, trente boutures/modalité). Les modalités correspondent à des plants :
- témoins non percés ;
- témoins percés au niveau de la tige ;
- infectés par le champignon pathogène Pch au niveau de la tige (après perçage) ;
- avec racines traitées par P. oligandrum sans infection par Pch ;
- infectés par Pch au niveau de la tige après traitement des racines par P. oligandrum.
Traitement par P. oligandrum
Les boutures ont été traitées avec une suspension d'oospores et de mycélium de P. oligandrum préparée par Biovitis SA (Saint-Étienne-de-Chomeil) à partir des souches CBS 118746 et cou59. Elle a été versée sur le sol au niveau des racines, d'abord au stade 7-8 feuilles puis trois jours plus tard.
Inoculation par le pathogène Pch
L'infection par Pch a été réalisée une semaine après la première inoculation par P. oligandrum. Un disque de mycélium de la souche SO37 de Pch (Inra-UMR Save collection, Bordeaux) était inséré dans la bouture préalablement percée à 4 mm de profondeur sous le premier bourgeon. Puis le trou était refermé avec de la paraffine.
Prélèvement des échantillons
Les prélèvements de tige ont été réalisés à trois dates différentes : T0 (deux heures après inoculation avec Pch), T+7 et T+14 jours, sur neuf boutures par modalité (trois plants/répétition) à chaque date.
Analyses moléculaire et statistique
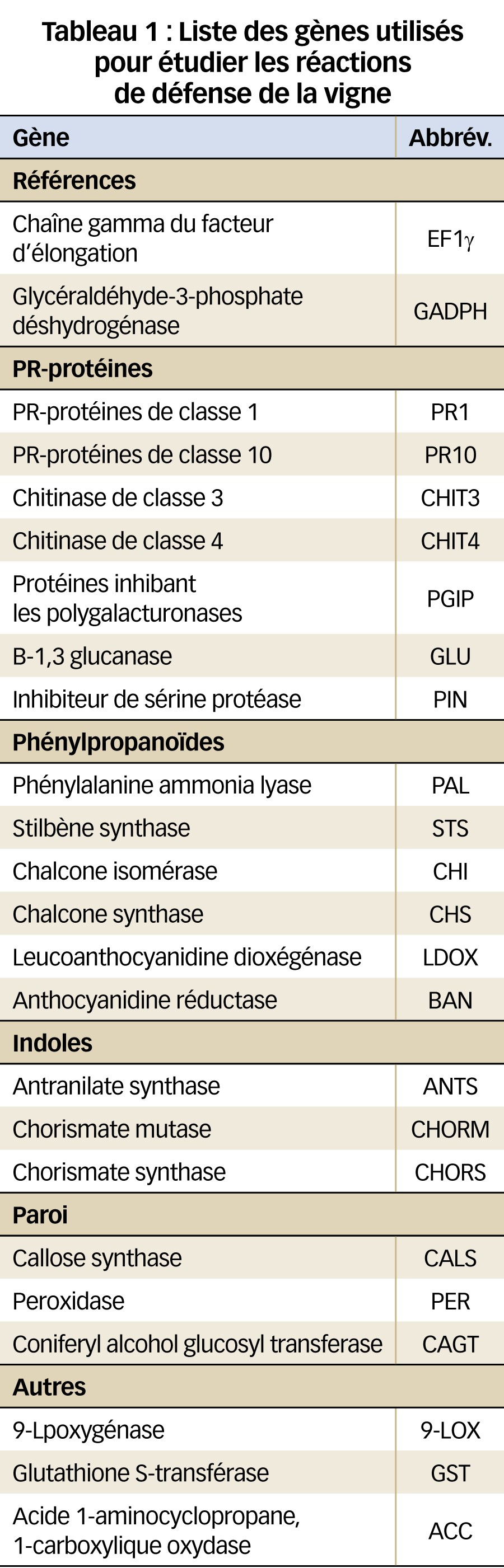
Le niveau d'expression de vingt-deux gènes liés aux défenses de la vigne (Dufour et al., 2013) a été quantifié par PCR quantitative en temps réel (RT-qPCR). Ces gènes codent pour des PR-protéines, des protéines de la synthèse de la paroi (Dufour, 2012) ou de la voie des phénylpropanoïdes, ou sont liés à la synthèse des oxylipines ou de l'éthylène (Tableau 1). Pour l'analyse statistique, le test de Kurskall-Wallis a été utilisé.
Résultats
État des plants de vigne
La taille des nécroses générées par Pch dans la tige des boutures a été mesurée. Chez les plants témoins (non percés et percés), aucune nécrose n'a été détectée.
Le niveau de nécroses dans les plants colonisés par P. oligandrum puis inoculés par Pch est environ la moitié de celui dans les plants seulement inoculés avec Pch.
Expression des gènes de défense de la vigne suite au « perçage » de tige
Pour évaluer l'effet du perçage des tiges, le niveau d'expression relative des gènes étudiés a été calculé par rapport aux plants témoins non percés.
Le perçage cause un stress mécanique : surexpression à T0 de douze gènes de défense de la plante représentant les cinq familles étudiées. Cela s'atténue rapidement.
Expression des gènes après inoculation de la tige par P. chlamydospora
Les réponses de la vigne suite à l'inoculation par l'agent pathogène Pch sont comparées à celle des « témoins percés », afin de soustraire « l'effet perçage » des résultats.
À T0 et T7, les plants répondent faiblement à l'infection. À T14, les gènes codant pour les PR-protéines montrent une surexpression significative. Parmi les gènes impliqués dans la voie des phénylpropanoïdes, peu ou pas exprimés à T0 et réprimés à T7, trois sont surexprimés à T14.
Le gène LOX est réprimé à T7 et surexprimé à T14. De même, l'enzyme de détoxification (GST) est très activée à T14. La voie de l'éthylène (ACC) reste inactive.
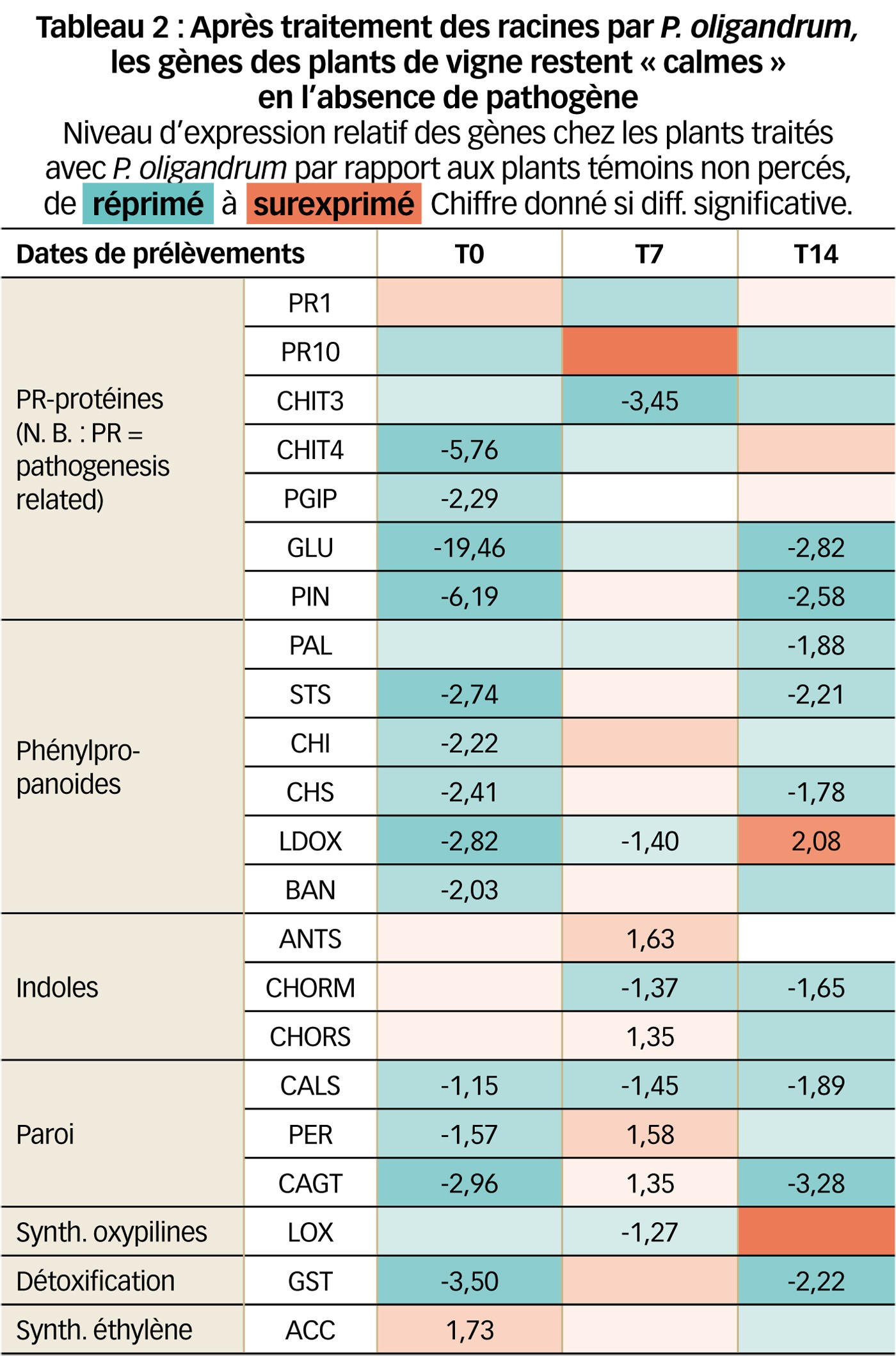
Expression après traitement des racines par P. oligandrum
Suite à l'introduction de P. oligandrum au niveau du système racinaire de la plante, le niveau d'expression relative a été calculé par rapport au témoin non percé.
De façon générale, l'expression des vingt-deux gènes étudiés est faible (Tableau 2).
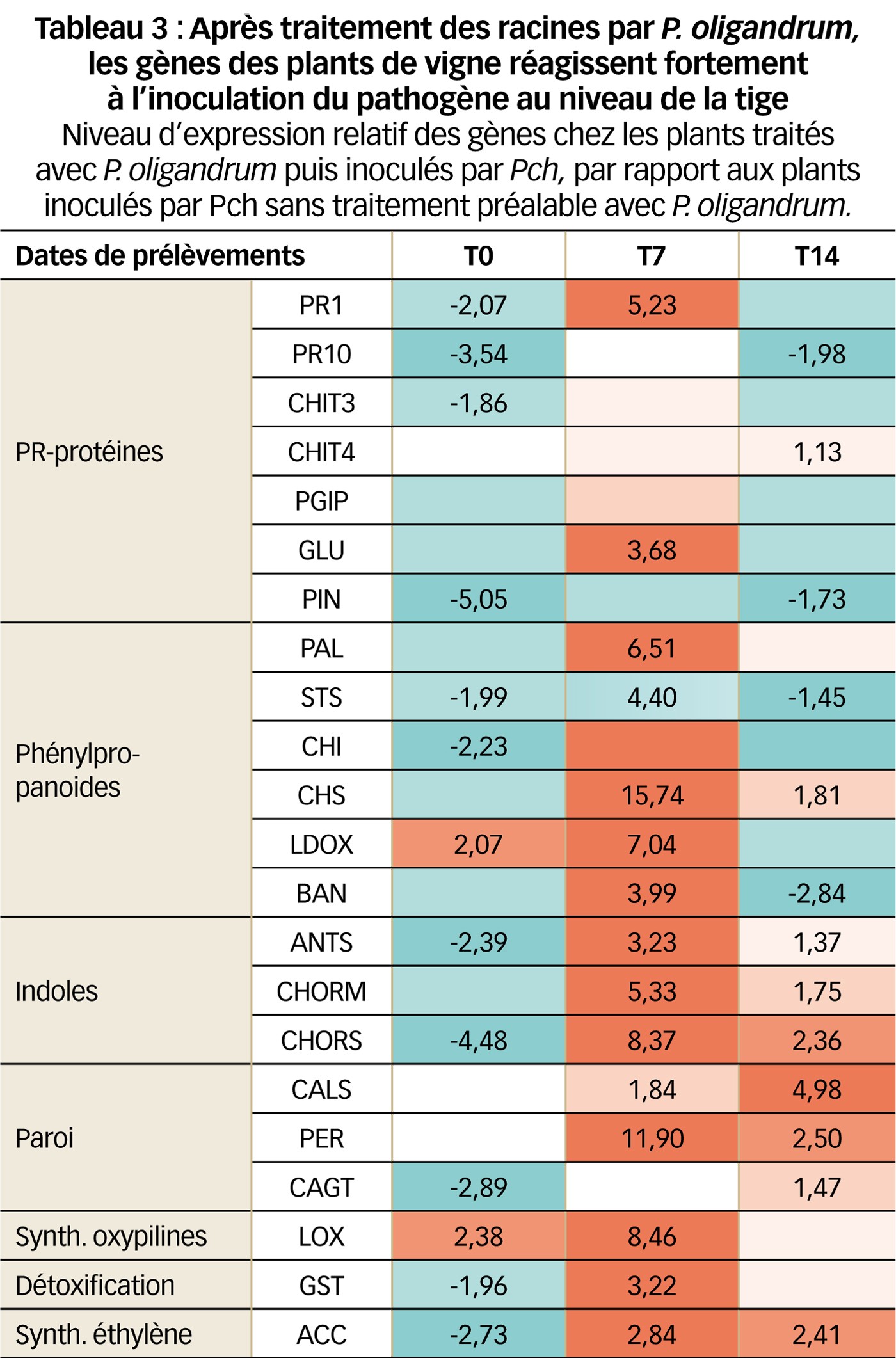
Après inoculation des racines par P. oligandrum puis des tiges par Pch
Les expressions relatives des gènes des plants de la modalité P. oligandrum + Pch ont été calculées par rapport aux plants infectés par Pch seul (Tableau 3).
À T0, deux gènes sont légèrement surexprimés et dix-sept faiblement réprimés.
Presque tous les gènes sont fortement surexprimés à T7. La surexpression est moins marquée chez les gènes codant pour les PR-protéines, qui sont les moins stimulés à deux exceptions près.
La stimulation continue à T14 pour les gènes liés au renforcement de la paroi, à la voie des indoles et celle de l'éthylène (ACC).
Ce qu'il faut retenir
Effet bénéfique du pythium
L'essai en serre a montré que des boutures de cabernet sauvignon infectées au niveau de la tige par Pch après colonisation au niveau du système racinaire par P. oligandrum avaient développé des nécroses réduites d'environ 50 % par rapport aux plants non colonisés.
La vigne répond au pathogène Pch
Par ailleurs, les niveaux d'expression de vingt-deux gènes des systèmes de défense de la vigne sont différents selon que la plante est colonisée par l'agent antagoniste P. oligandrum, le champignon pathogène Pch ou les deux micro-organismes.
La réponse de la vigne à l'attaque par Pch passe d'abord par une répression des gènes codant pour les PR-protéines sept jours après infection, puis par leur stimulation une semaine plus tard. Les autres gènes étudiés sont réprimés (sauf les stilbènes).
Ces résultats diffèrent pour partie de ceux de Rotter et al. (2009). Ils ont constaté, suite à l'infection de la vigne par Eutypa lata, agent de l'eutypiose, la surexpression de plusieurs protéines et de la voie des phénylpropanoïdes. La réponse de la vigne semble dépendre du pathogène, la plante adaptant son système de défense.
La vigne réagit au stress mécanique
La méthode d'inoculation de Pch (perçage de tige) induit un stress abiotique chez la plante. C'est ce qu'indique la surexpression, deux heures après perçage, de nombreux gènes, surtout ceux codant pour les PR-protéines. Elle s'atténue rapidement et a disparu quatorze jours après le perçage.
Ceci suggère que les PR-protéines seraient induites de façon peu spécifique face à des stress abiotiques (perçage) ou biotiques (infection par Pch, E. lata, etc.).
Pythium oligandrum avec ou sans Pch
La réponse de la vigne face à P. oligandrum seul est très différente de celle face à Pch seul et face aux deux organismes.
Quasiment aucune induction de gènes n'est notée si P. oligandrum est seul présent. Mais les plants prétraités par P. oligandrum répondent plus vite et fort à l'attaque de Pch que les plants non prétraités. Ils montrent une forte induction des gènes impliqués dans la voie de biosynthèse des phytoalexines, des enzymes de détoxification ainsi que des protéines de la paroi, sept jours après infection par Pch. Pour les PR-protéines, deux gènes sont surexprimés.
Ces résultats sont en accord avec Mohamed et al. (2006) montrant qu'après traitement des racines par P. oligandrum, les gènes codant pour les <03B2>-1,3-glucanase (GLU) et stilbène synthase (STS) sont surexprimés lors d'une attaque par Botrytis cinerea. Takenaka et al. (2011) ont montré qu'un traitement racinaire de plants de tomate par les protéines de la paroi cellulaire (CWP) de P. oligandrum entraîne une surexpression des gènes codant pour la PAL et certaines PR-protéines.
Effet sur les parois, effet croissance ?
Dans notre étude, au bout de quatorze jours, les plants colonisés par P. oligandrum et infectés par Pch voient s'exprimer fortement les gènes impliqués dans le renforcement de la paroi végétale et du tryptophane. La surexpression de gènes codant pour des molécules renforçant la paroi (callose et lignine) permettrait de limiter la pénétration du pathogène. La voie du tryptophane étant impliquée dans la synthèse de l'auxine, cela stimulerait la croissance de la plante.
Selon Takahashi et al. (2006) et Kawamura et al. (2009), l'application de P. oligandrum ou de ses protéines élicitrices active la voie de signalisation de l'acide jasmonique et celle de l'éthylène mais n'active pas celle de l'acide salicylique. Dans notre étude, la voie de l'éthylène est effectivement activée. Mais aucun gène étudié ici n'est impliqué dans les voies de l'acide jasmonique et de l'acide salicylique : un dosage de ces acides dans les tissus des plants serait utile.
Hypothèse « potentialisation »
La réponse de la vigne inoculée par P. oligandrum et celle de la vigne inoculée par P. oligandrum puis infectée par Pch montrent que les mécanismes de défense de la vigne ne sont induits par P. oligandrum qu'en cas d'infection par Pch. Cela suggère l'existence d'un effet potentialisateur ou « priming ».
La potentialisation est un état physiologique qui permet à la plante d'induire plus vite et plus intensément ses mécanismes de défense face à un stress (Conrath, 2009). Theocharis et al. (2010) ont montré, chez la vigne, qu'un traitement avec la souche PsJN de Burkholderia phytofirmans stimule les défenses des plants de vigne face à un stress (abiotique dans leur cas : le froid).
Potentialités à explorer
Notre étude a montré que P. oligandrum présente des potentialités intéressantes pour lutter contre un champignon impliqué dans l'esca. Ainsi P. oligandrum stimule les réactions de défense des plants de vigne et induit un niveau de protection de 50 % par rapport aux plants témoins infectés.
Ceci suggère d'explorer l'effet des molécules élicitrices de P. oligandrum, par exemple en traitant des jeunes ceps avec du filtrat de culture ou les molécules pures. L'étude d'autres gènes impliqués dans les voies de défense de la plante (acide salicylique, acide jasmonique, autres métabolites) informerait sur l'effet de P. oligandrum dans l'interaction avec la plante et le Pch.
REMERCIEMENTS
Travaux financés par le programme Casdar du ministère français chargé de l'Agriculture et le CNIV (projet V 1302), le ministère tunisien en charge de la Recherche, la Fondation Poupelain et Biovitis.
 Imprimer
Imprimer