Le troisième volet de ce point sur la flavescence dorée commence par l'évolution des méthodes de diagnostic. On verra que, parfois, la « biomol » (biologie moléculaire) peut être utile au terrain.
Détection et caractérisation du phytoplasme
Pour pouvoir doser, il faut cultiver
Le phytoplasme de la flavescence dorée fut un des premiers détectés par sérologie ou méthodologies de l'ADN.
Pour obtenir des anticorps ou pour accéder à l'ADN, il fallait disposer dans les années 1980 de relativement grandes quantités de phytoplasmes au moins partiellement purifiés. Or, jusqu'ici, les phytoplasmes n'étaient pas cultivables in vitro (N. B. : des avancées dans ce domaine ont été publiées récemment). Localisés dans les tubes criblés du liber des plantes ou dans certains organes des insectes vecteurs, ils sont très petits (moins de 1 <03BC>m), de taille hétérogène, et fragiles car dénués de paroi. Leur titre dans les plantes ligneuses peut être extrêmement faible.
Sur la fève et un autre insecte
Des sérums puis des anticorps monoclonaux ont été produits à l'Inra de Dijon grâce à la modélisation du cycle biologique de la flavescence dorée. Transféré à des plantes herbacées (la fève Vicia faba L.) à l'aide de cicadelles S. titanus récoltées en vignobles malades, le phytoplasme a été entretenu au laboratoire par transmission de fève à fève à l'aide d'une cicadelle sans diapause, Euscelidius variegatus Kbm.
Ce modèle mis en place en 1970 (Caudwell et al., 1970, 1972b) est utilisé de nos jours dans plusieurs laboratoires européens.
C'est à partir de ce matériel et par des systèmes « soustractifs » améliorant la spécificité que des sérums, puis des anticorps monoclonaux, ont été élaborés.
Ce même matériel a été utilisé pour obtenir des fractions d'ADN de plantes et de cicadelles infectées enrichies en ADN du phytoplasme. Ce dernier a été cloné et a fourni les premières sondes pour l'hybridation moléculaire (Daire et al., 1992), puis des amorces pour la PCR (Daire et al., 1997a).
Méthodes sérologiques
Des anticorps polyclonaux et monoclonaux dirigés contre les antigènes de la membrane du phytoplasme de la flavescence dorée (Boudon-Padieu et al., 1987 ; Seddas et al., 1996) permettent la détection des phytoplasmes dans les insectes vecteurs (Boudon-Padieu et al., 1989 ; Osler et al., 1992) et dans la vigne par méthode DAS-Elisa (Caudwell & Kuszala, 1992).
Le test DAS-Elisa, devenu méthode officielle, a été mis à disposition du Laboratoire national de protection des végétaux de Colmar, ainsi que les réactifs et extraits antigéniques de référence.
Plusieurs enquêtes nationales de détection de la flavescence dorée dans les échantillons de vigne de toutes origines ont été conduites dans ces conditions. Elles ont permis d'intervenir rapidement au début des années 1990 sur de nouveaux foyers et de mieux différencier la flavescence dorée du bois noir (même symptomatologie mais phytoplasmes et vecteurs différents).
Les contraintes de production de ces anticorps, du fait que seul notre laboratoire était à même de produire les sources d'antigènes, ont conduit à remplacer le diagnostic de routine en Elisa par la PCR à partir de 1996, dès que des sondes et amorces spécifiques ont été obtenues (voir ci-après). Toutefois les anticorps restent des outils précieux en recherche. Ils ont été utilisés pour marquer les phytoplasmes in situ dans les cellules infectées des insectes et des plantes (Lefol et al., 1994, Lherminier et al., 1990 ; 1994) en combinaison avec la microscopie et pour examiner la spécificité de reconnaissance entre l'insecte vecteur et le phytoplasme (Lefol et al., 1993).
Par ailleurs, des essais sérologiques de divers types ont montré l'existence d'isolats de flavescence dorée différents, ainsi que leur parenté avec d'autres phytoplasmes de la vigne en Allemagne et avec les phytoplasmes de l'orme.
Les anticorps sont des outils discriminants pour l'étude des interactions des phytoplasmes avec leurs hôtes. Ces études sont désormais facilitées par les progrès des méthodes de biologie moléculaire qui permettent d'identifier les protéines membranaires impliquées dans ces interactions.
Méthodes utilisant l'ADN
La détection des phytoplasmes par des méthodes basées sur la technologie de l'ADN a commencé à se développer à la fin des années 1980 (Kirckpatrick et al., 1987). Grâce au clonage de l'ADN de phytoplasmes de la flavescence dorée (voir ci-avant), des fragments spécifiques ont fourni des sondes (Daire et al., 1992) puis des amorces PCR (Maixner et al., 1995b ; Daire et al., 1997a) pour la détection dans les tissus de vigne et dans les vecteurs.
Des isolats de flavescence dorée et des phytoplasmes apparentés induisant la jaunisse de la vigne appelée palatinate grapevine yellows (PGY) ont été identifiés (Maixner et al., 1995b ; 2000).
Des moyens de détecter mais aussi de classer les phytoplasmes
D'autres outils dits « universels » pour la détection des phytoplasmes par PCR ciblent l'ADN ribosomique 16S, conservé au sein d'un même clade (Lee et al., 1993).
Les auteurs ont construit des arbres regroupant tous les phytoplasmes connus, au sein de nombreux groupes (numérotés 16Sr-I et suivants). Il a été confirmé que le phytoplasme de la flavescence dorée appartient au même groupe que les agents des jaunisses de l'orme, des Rubus, et de l'aulne, entre autres (16Sr-V), tandis que celui du bois noir appartient au groupe 16Sr-XII.
Ces méthodes très sensibles ont contribué à la compréhension de l'étiologie des jaunisses de la vigne dans le monde. Au cours des années 1990, ont été identifiés et cartographiés la flavescence dorée en France, Espagne et Italie et le bois noir dans ces mêmes pays, outre l'Allemagne et Israël (Daire et al., 1993 ; 1997b ; Batlle et al., 1997 ; Maixner 1995a ; Martini et al., 1999 ; Sforza et al., 1998 ). D'autres phytoplasmes de la vigne en Europe, Australie et aux États-Unis ont été caractérisés.
Depuis ces années pionnières, on a une vision fréquemment actualisée des phytoplasmes de la vigne présents en Europe.
Détection en France : PCR remplace Elisa depuis 1996
Pour les enquêtes nationales de détection, le test DAS-Elisa a été remplacé dès 1996 par deux tests PCR caractérisant la flavescence dorée et le bois noir, respectivement (Daire et al., 1997a).
Un protocole multiplex PCR niché pour la détection simultanée des deux maladies a ensuite été élaboré et adopté comme méthode officielle (Clair et al., 2003). Elle a à son tour été remplacée en 2010 par une méthode en PCR triplex avec témoin interne (Pelletier et al., 2009). Cette dernière est mise en oeuvre dans des laboratoires agréés.
L'approche moléculaire pour comprendre l'épidémiologie
Différencier les phytoplasmes
Connaître la diversité écologique et génétique des phytoplasmes peut aider à comprendre l'épidémiologie des maladies induites et à combattre leur diffusion. Ce chapitre cherche à comprendre les sources et la diffusion de la flavescence dorée, en partant de la comparaison des phytoplasmes associés avec des phytoplasmes apparentés appartenant au même groupe (16S rV).
Les phytoplasmes de la flavescence dorée sont biologiquement définis par l'induction de symptômes de jaunisse chez V. vinifera et leur transmission par la cicadelle S. titanus.
Le cas des aulnes en Palatinat
Les phytoplasmes PGY apparentés à la flavescence dorée, détectés dans des ceps de vigne du cultivar Scheurebe en Palatinat (Allemagne) où S. titanus ne vit pas (Maixner et al., 1995b), ne sont pas épidémiques. Ils sont inoculés de façon erratique à la vigne depuis des aulnes porteurs sains par des cicadelles de l'aulne, Oncopsis alni (Schrank), (Maixner et al., 2000).
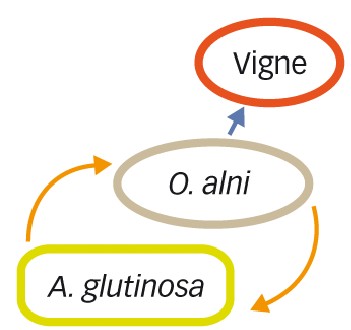
Dans le schéma illustrant cette situation, on voit que la vigne est un hôte « cul-de-sac » pour le phytoplasme (Figure 1).
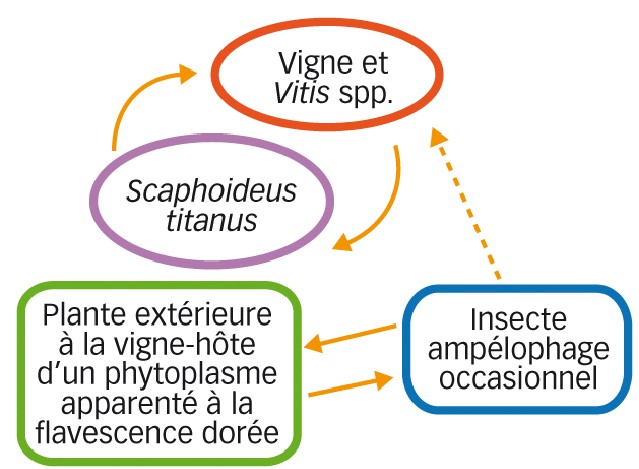
Caudwell (1983) avait fait l'hypothèse de l'émergence de jaunisses de la vigne par la rupture de cycles naturels établis sur d'autres plantes (Vitis sauvages, adventices) et l'introduction du phytoplasme à la vigne par un vecteur compétent. Il fallait donc savoir si la jaunisse PGY pourrait devenir épidémique si S. titanus s'installait en Palatinat (Figure 2).
Plusieurs essais au laboratoire, de transmission de vigne à vigne avec des S. titanus, ont échoué (Maixner & Boudon-Padieu, non publié ; Foissac, comm. pers.). Les phytoplasmes PGY ne sont donc pas des agents de la flavescence dorée sensu stricto.
Comparaison d'isolats trouvés en France, Italie et Allemagne
Angelini et al. (2001 ; 2003) ont comparé quatre isolats dont deux trouvés dans les vignes françaises (FD70, FD92) et deux dans des vignes italiennes (FD-C, FD-D) (Martini et al., 1999) avec trois isolats du Palatinat et quatre isolats de référence, dont ALY, provenant de l'aulne en Italie.
Des comparaisons menées en parallèle par plusieurs méthodes moléculaires ont montré l'identité dans tous les cas entre le FD92 de France et le FD-D d'Italie. FD70 n'a jamais été trouvée en Italie, mais appartient au même sous-groupe que le FD-C italien, tous deux proches de ALY. Ces quatre phytoplasmes FD sensu stricto ainsi qu'ALY appartenaient à un premier cluster.
En revanche, les phytoplasmes PGY d'Allemagne formaient un cluster distinct, distinct également de celui qui regroupait les phytoplasmes de la jaunisse de l'orme.
Clématites en Italie et Serbie
Des phytoplasmes du même sous-groupe que le FD-C ont été trouvés au nord de l'Italie et en Serbie dans des clématites (C. vitalba) à proximité de vignes malades de flavescence dorée (avec présence de S. titanus) (Angelini et al., 2004).
Mais S. titanus, naturellement infecté dans ces vignobles, ne s'est pas révélé capable d'acquérir le phytoplame sur la clématite. Par contre, certains spécimens de la cicadelle Dyctiophara europaea, récoltée en abondance dans les secteurs concernés, étaient porteurs du même phytoplasme ; d'autres spécimens élevés et nés sains l'ont acquis sur la clématite et l'ont transmis à la vigne (Filippin et al., 2009).
Nous sommes donc dans le cas de la Figure 2, représentant une introduction à la vigne, à partir du compartiment sauvage, de phytoplasmes transmis ensuite par S. titanus.
Lignées de phytoplasmes : définition
Tous ces résultats de typage moléculaire ont été confirmés et complétés par Arnaud et al., (2007) par l'analyse de séquence multilocus sur trois régions du génome des phytoplames du groupe 16Sr-V. Les auteurs ont défini trois lignées homogènes pour les phytoplasmes issus de la vigne.
L'une, dénommée FD2, regroupe des isolats dont les séquences de chacune des trois régions analysées sont strictement identiques entre isolats. Elle contient les isolats de référence FD92 (France) et FD-D (Italie), et la majorité (> 85 %) d'échantillons de vignes malades récoltés en France et en Italie, y compris des échantillons historiques récoltés dans toutes les régions de France depuis les années 1990.
La lignée dénommée FD1 contient des isolats proches de la souche FD70, isolée en 1970 dans le Gers. Elle contient 15-20 % des échantillons de France, récoltés en majorité dans le Sud-Ouest, ainsi que des échantillons d'Italie - Piémont et Lombardie exclusivement.
La lignée FD3 contient la FD-C d'Italie, et exclusivement des échantillons d'Italie, ces derniers transmis par S. titanus mais aussi par D. europaea.
Enfin, les phytoplasmes de l'aulne et PGY appartiennent au même sous-groupe que les phytoplasmes de la flavescence dorée. Ils ne sont pas transmis par S. titanus.
Origine du phytoplasme, donc des épidémies ?
L'hypothèse « vignes américaines »
Lors de la première manifestation de flavescence dorée pendant les années 1950-70, l'agent pathogène a été présumé d'origine américaine. L'hypothèse était basée sur l'origine de l'espèce vectrice et sur la plantation sur leurs propres racines, en Armagnac, d'hybrides américains producteurs directs, peu de temps avant la première observation de la flavescence dorée en France.
Au début des années 1990, Maixner et al. (1993) obtinrent des résultats suggérant que des cicadelles S. titanus, capturées dans des vignobles atteints de jaunisses dans l'État de New York, pouvaient transmettre à des plantes un phytoplasme reconnu par des anticorps spécifiques pour celui de la flavescence dorée. Toutefois, les méthodes utilisant l'ADN n'étant pas disponibles à l'époque, nous manquons de résultats confirmant la présence de phytoplasmes apparentés à la flavescence dorée dans cette région américaine.
Les données ne confirment pas mais n'excluent pas cette première explication de l'entrée de la flavescence dorée en Europe, qui serait entrée avec des bois américains.
L'hypothèse « source européenne extérieure à la vigne »
La démonstration que O. alni peut transmettre de façon occasionnelle depuis l'aulne vers la vigne un phytoplasme apparenté à la flavescence dorée fut la première à montrer le rôle possible d'une source extérieure à la vigne en Europe.
Le cas de l'introduction par D. europaea depuis la clématite en fut une deuxième démonstration, à laquelle s'ajoute la transmissibilité par S. titanus.
L'ensemble de ces travaux suggère que la flavescence dorée est apparue en Europe à partir de phytoplasmes extérieurs à la vigne, lors de trois événements distincts au moins, à l'origine des trois lignées FD1, FD2 et FD3 définies par Arnaud et al., (2007). Nous sommes alors dans le cas d'une origine européenne.
Dispersion par le matériel de plantation
Par ailleurs, la fréquence de la lignée clonale de phytoplasmes FD2 désigne la multiplication de matériel végétal porteur sain et sa large commercialisation à distance, comme les principales causes de la diffusion de la flavescence dorée au cours des dernières décennies.
Conclusions et perspectives
Trois mots d'ordre aujourd'hui
Que la flavescence dorée soit introduite dans le vignoble en provenance du compartiment extérieur ou par des plants porteurs sains, dans les deux cas, la présence ou l'absence de la cicadelle vectrice S. titanus sont des éléments décisifs : soit le foyer primaire sera actif, soit il s'éteindra.
La lutte préventive contre la cicadelle demeure donc le premier mot d'ordre.
Le deuxième mot d'ordre est de planter des plants assainis par traitement à l'eau chaude.
Le troisième est l'importance d'actions collectives pour la prophylaxie, la prospection et l'élimination des vecteurs. Si cette vigilance était généralisée, la flavescence dorée pourrait devenir une maladie banale avec laquelle les viticulteurs sauraient composer.
Des recherches pour demain
La recherche doit donc se poursuivre, voici quelques directions :
- rechercher des ennemis naturels et des insecticides biologiques capables d'éliminer les populations de S. titanus sans affecter la faune auxiliaire ;
- accroître les connaissances sur l'éthologie de S. titanus et l'existence de réservoirs cryptiques de phytoplasmes apparentés à la flavescence dorée ;
- améliorer l'évaluation de l'état sanitaire du germplasm : détection large et sensible et méthodes d'échantillonnage ;
- étudier les bases de la spécificité des interactions vecteur-phytoplasme ; comparer des isolats de phytoplasmes transmissibles ou non par S. titanus au niveau moléculaire et dans leurs interactions cellulaires avec des vecteurs ; ces travaux sont en cours (Malembic-Maher et al., non publié) ;
- analyser les réactions de la plante à la colonisation par les phytoplasmes, incluant les interactions greffon/porte-greffe conduisant à la maladie ou au rétablissement ;
- étudier la sensibilité des cépages, éliciter des réactions de défense lors de la colonisation par les phytoplasmes.
Fig. 1 : Vigne « cul-de-sac »
Introduction de phytoplasmes PGY à la vigne depuis l'aulne (A. glutinosa) par un vecteur accidentel. Le phytoplasme ne sort pas des plants de vigne infectés (Maixner et al., 2000).
Fig. 2 : Vigne foyer primaire
Proposition (théorique) pour un mécanisme d'introduction accidentelle d'un phytoplasme apparenté à la flavescence dorée dans la niche Vitis sp.-S. titanus. Le phytoplasme introduit dans la vigne par un vecteur accidentel passe sur S. titanus et, de là, initie une épidémie.
REMERCIEMENTS
Les travaux de longue haleine conduits à Dijon l'ont été alors que la réalité de la menace constituée par la flavescence dorée était niée à maints niveaux de responsabilité. Ils furent obtenus grâce à la cohésion d'une petite équipe de recherche renforcée d'étudiants, thésards et post-docs ; au soutien technique et financier d'organismes viticoles : Entav, Onivins, ITV, BIVB ; chambres d'agriculture et SRPV, en particulier de l'Aude et de Bourgogne ; au concours de nombreux techniciens de services viticoles au sein du groupe national de travail fondé en 1987 ; enfin par le soutien fidèle du conseil régional de Bourgogne.
 Imprimer
Imprimer