Les essais ont été menés sur une parcelle de merlot d'un domaine de pessac-léognan. Photo : Arysta LifeScience
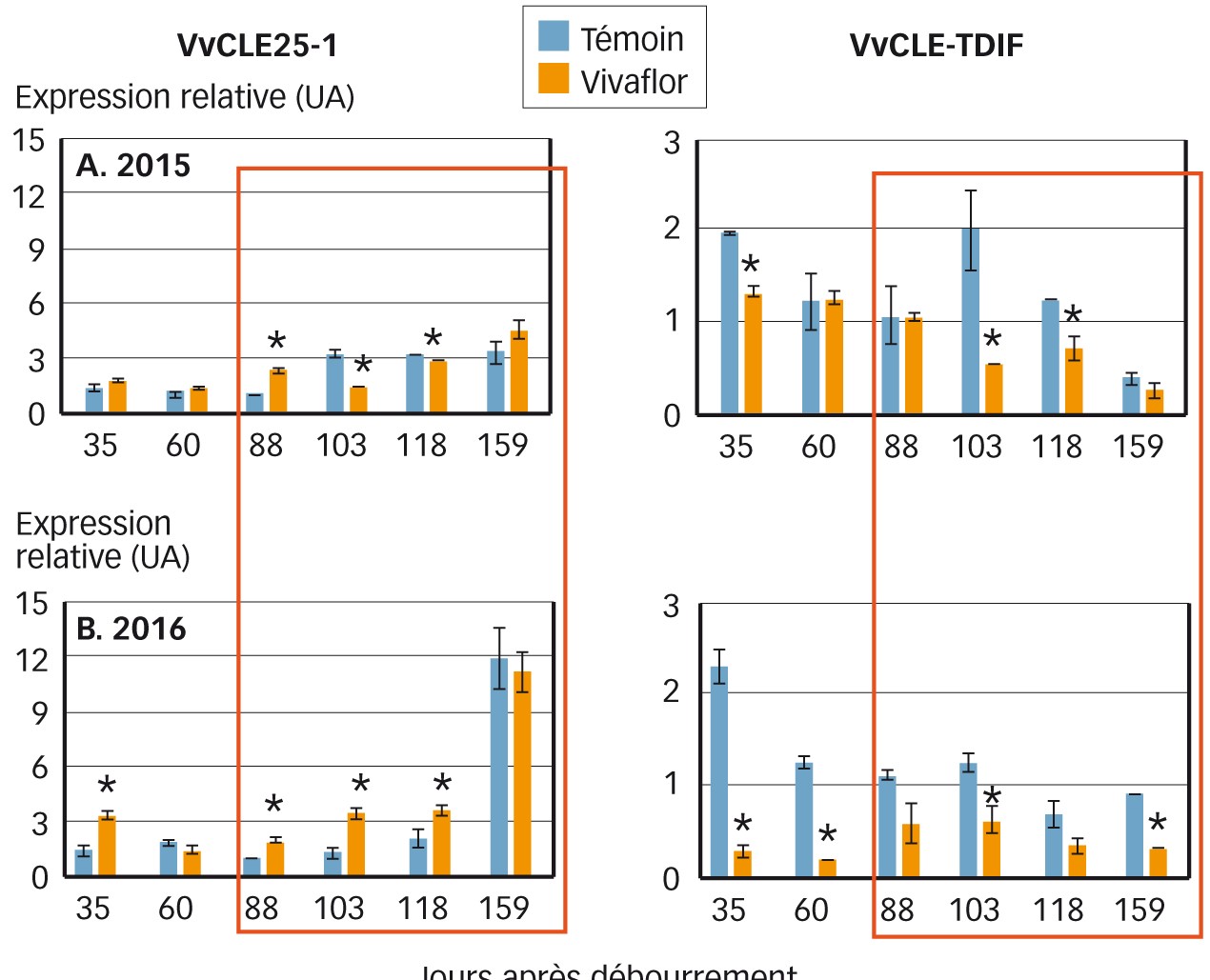
Fig. 1 : Évolution des niveaux d'expression relative des gènes VvCLE25-1 et VvCLE-TDIF dans le bourgeon latent Comparaison témoin (en bleu) et traité Vivaflor (en orange). Ce biostimulant a une action sur l'expression des gènes impliqués dans la méristémisation en favorisant la régulation positive de la ramification et la différenciation des PI.
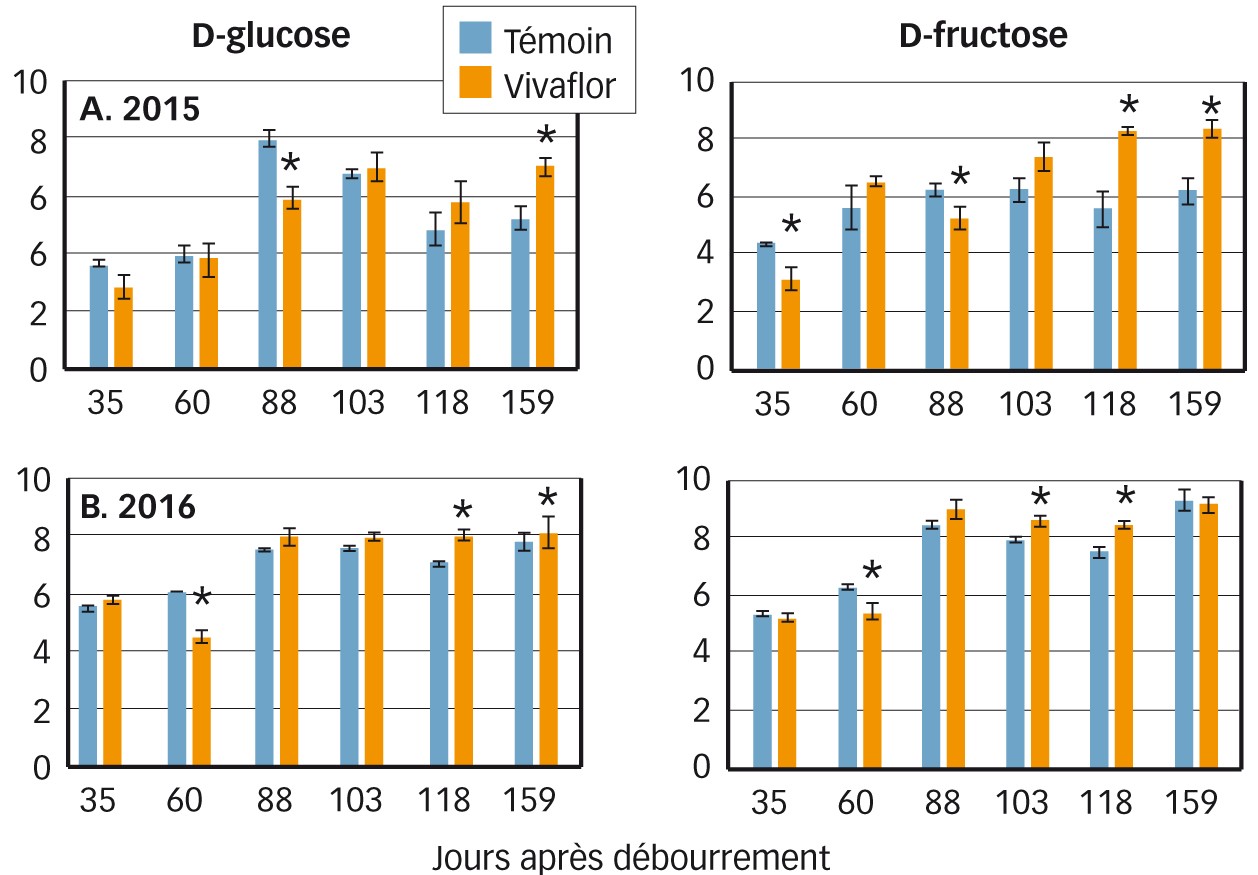
Fig. 2 : Évolution des teneurs en D-glucose et D-fructose dans le bourgeon latent Comparaison témoin (en bleu) et traité Vivaflor (en orange). Teneurs en mg/gMF.
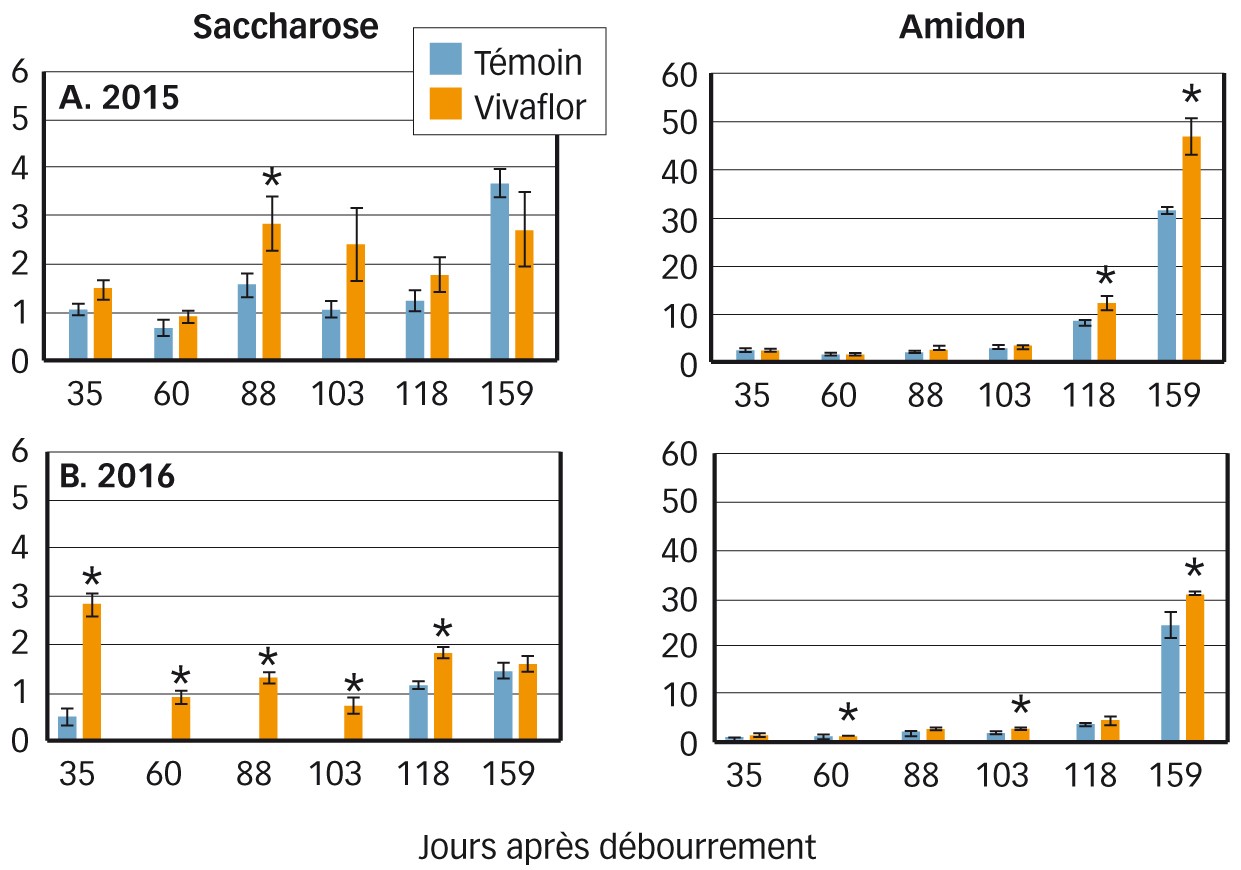
Fig. 3 : Évolution des teneurs en saccharose et en amidon dans le bourgeon latent Comparaison témoin (en bleu) et traité Vivaflor (en orange). Teneurs en mg/gMF.
Dans le domaine viticole, la constitution du rendement et le contrôle de ses variations présentent un intérêt majeur pour les viticulteurs qui cherchent à construire une vendange saine avec un équilibre entre la quantité et la qualité des grappes.
Plongeon dans les bourgeons
Toute grappe se fabrique en deux ans
La formation des grappes se déroule sur deux années consécutives. La première est celle de la formation des inflorescences (primordia inflorescentiels ou PI) dans le bourgeon. Cette phase détermine la fertilité potentielle de ces bourgeons latents. La deuxième année voit l'induction des pièces florales avant le débourrement, puis leur formation jusqu'à la floraison, la nouaison et la croissance des fruits (Bessis, 1965 ; Clingeleffer, 1984 ; Bramley, 2005).
Point important, la qualité de formation des inflorescences la première année est essentielle dans la constitution du rendement final l'année suivante. Elle expliquerait 60 % de la variation saisonnière du rendement en conditions chaudes et sèches (Dry, 2000 ; Dunn and Martin, 2007 ; Clingeleffer, 2001 et 2010 ; Guilpart et al., 2014).
Les « PI » des bourgeons latents
Des travaux initiés par l'ISVV (Institut des sciences de la vigne et du vin) ont redéfini la fertilité des bourgeons, décrit deux phases clés d'initiation et de différenciation des PI, leur degré de ramification, et identifié des marqueurs moléculaires, hormonaux et biochimiques (Li-Mallet, 2017).
Des gènes « inverses » se relaient
La régulation des étapes de formation du bourgeon est complexe. Elle fait intervenir un ensemble de gènes qui, successivement et de façon complémentaire, régulent dans le méristème apical (MAC) les phases de prolifération cellulaire, de différenciation des méristèmes végétatifs en méristèmes floraux et d'acquisition des caractères définitifs. L'analyse biochimique et génétique a également mis en évidence l'importance des hormones favorisant la communication entre cellules et tissus, assurant ainsi un développement harmonieux et défini.
Dans le bourgeon de vigne, parmi les gènes les plus importants (Li-Mallet et al., 2017), VvCLE25-1 et VvCLE-TDIF semblent particulièrement impliqués dans la régulation des mécanismes de prolifération cellulaire et de ramification des PI. L'évolution inverse de leur niveau d'expression au cours du cycle de formation des PI montre leurs rôles respectifs et complémentaires.
VvCLE-TDIF, qui inhibe la différenciation, est surexprimé en début de cycle, ce qui favorise la division des cellules en empêchant la différenciation cellulaire. Ensuite, VvCLE25-1, régulateur de la transition du méristème végétatif en méristème reproducteur, voit son expression naturellement augmenter lors des dernières phases de construction des PI (Li-Mallet et al., 2017).
Deux années d'essai
Un biostimulant testé
Vivaflor® contenant GoActiv®, filtrat d'Ascophyllum nodosum développé par Arysta Life-Science, est préconisé sur vigne afin de réduire le millerandage et la coulure, et pour améliorer la maturité des baies mûrissant l'année de son application (Bernardon-Mery et al., 2017). Vu la période d'application de ce biostimulant, on peut aussi lui supposer des effets sur le développement des bourgeons donnant fruit l'année suivante.
L'ISVV et Arysta ont donc mené un travail dans l'objectif d'évaluer les effets de ce produit sur la fertilité des bourgeons latents en lien avec les mécanismes d'initiation et de différenciation des PI.
Des bourgeons latents prélevés
L'essai a été conduit sur une parcelle de merlot d'un domaine de l'appellation pessac-léognan sur deux années consécutives (2015 et 2016). Le produit appliqué à trois stades (grappes séparées, pleine floraison et début nouaison) est comparé à un témoin non traité. Cinquante bourgeons latents par modalité et par an ont été prélevés tout au long de leur développement (35, 60, 88, 103, 118 et 159 jours après débourrement) pour l'analyse de divers marqueurs moléculaires, biochimiques et hormonaux.
Trois répétitions réalisées par modalité ont été analysées à l'aide du logiciel R après analyse de variance Anova et test post-hoc Tukey (HSD). Dans les Figures 1 à 5, la présence d'un astérisque signifie l'existence d'une différence statistique entre la modalité témoin et la modalité traitée.
Gènes, sucres et ABA examinés
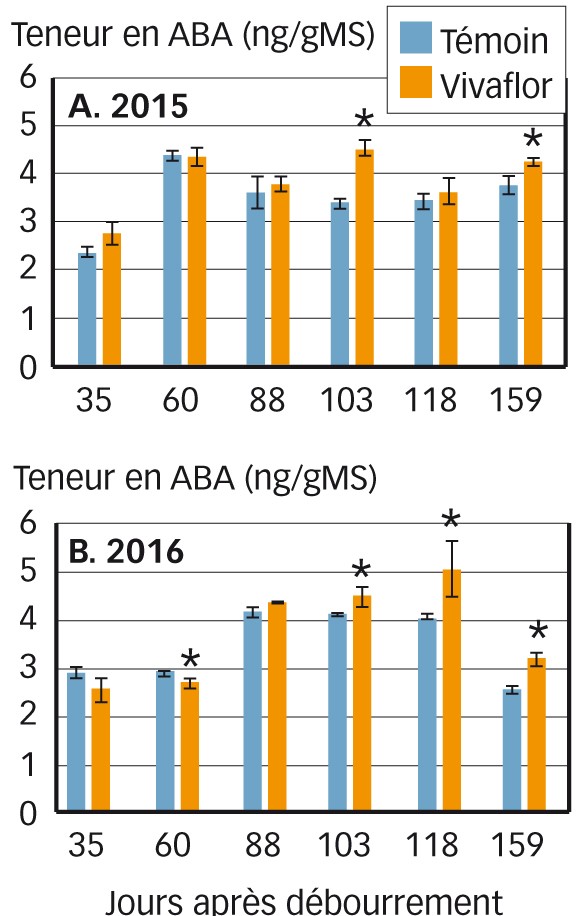
L'expression relative des gènes a été évaluée par RT-qPCR en temps réel. Les teneurs en sucres ont été mesurées par méthode enzymatique grâce aux kits de dosage R-Biopharm UV-method (USA). Le dosage de l'ABA (acide abscissique) a été réalisé en chromatographie en phase liquide à haute pression (Water Acquity ultra-performance liquid chromatograph) couplée à une spectrométrie de masse quadripolaire (Waters Xevo Trip quadrupole mass spectrometer TQS) (UPLC-ESI-MS/MS).
Des effets révélés
Expression des gènes
Dans les bourgeons « traités Vivaflor », le niveau d'expression des gènes est modifié. VvCLE25-1 est surexprimé pendant la phase de différenciation et de ramification, favorisant ainsi la transition du méristème végétatif en méristème reproducteur, alors que VvCLE-TDIF voit son niveau d'expression diminué, levant ainsi l'inhibition des phénomènes de différenciation (voir Figure 1). Ainsi, par le jeu des interactions génétiques, les mécanismes de différenciation et de ramification semblent plus précoces, favorisant la formation de PI déjà différenciés.
Sucres et régulation hormonale au cours de la formation des PI
Le fonctionnement cellulaire est fortement dépendant de la disponibilité en sucres et les glucides jouent un rôle central dans le contrôle du métabolisme, de la croissance et du développement.
Issus de la photosynthèse, les sucres présents dans les bourgeons sont soit utilisés directement par les cellules, soit stockés sous forme d'amidon pour un usage ultérieur. Ils sont transportés vers les différents organes de la plante sous forme de saccharose. Les sucres sont des molécules-signal importantes pour le développement des structures végétatives et reproductrices (Lebon et al., 2008).
La formation des PI est une période de forte activité cellulaire où la consommation de sucres solubles (D-glucose, D-fructose) est proportionnelle à l'activité (Clément et al., 1996 ; Lebon et al., 2006). Durant la phase d'organogenèse (35 à 88 JAD, jour après débourrement), l'activité cellulaire dans les méristèmes apicaux caulinaires (MAC) du bourgeon est très importante. Les teneurs en D-glucose et D-fructose restent alors relativement faibles en raison d'une consommation rapide de ces sucres assimilables pour assurer l'intense activité cellulaire dans les méristèmes (Li-Mallet, 2017). Plus l'activité est importante, plus la consommation est rapide.
Cette consommation se traduit également par de faibles teneurs en saccharose et en amidon qui ne peuvent alors s'accumuler. Au contraire, en fin de période de ramification des primordia inflorescentiels et à l'approche de l'entrée en dormance, le saccharose et surtout l'amidon s'accumulent sous l'influence de l'acide abscissique. Ceci traduit des mécanismes de mise en réserve nécessaires au bon déroulement du débourrement l'année suivante (Figure 2) (Koussa, 1998 - Lebon 2004, 2005).
Des teneurs modifiées
Dans la modalité Vivaflor, les teneurs en sucres solubles (D-glucose et D-fructose) sont plus faibles que dans le témoin en début de période, en lien probable avec de plus fortes activités cellulaires dans les bourgeons, traduisant une initiation et une différenciation des PI plus importantes sous l'effet du biostimulant (Figure 2).
En revanche, les teneurs en saccharose (Figure 3) augmentent, confortant l'hypothèse d'un transport facilité et plus efficace lié à l'activité cellulaire importante. En effet, chez plusieurs espèces, l'aptitude du bourgeon à se développer serait concomitante à sa capacité à importer du saccharose (Découleix et al., 2008).
Après la phase d'initiation (88 JAD), les teneurs en D-glucose et D-fructose se stabilisent en raison d'un ralentissement des activités cellulaires dans les MAC et des équilibres organes sources/puits (Li-Mallet, 2017), mais tendent à rester plus fortes chez les bourgeons traités (Figure 2). Cela peut traduire une accumulation plus rapide et une plus grande disponibilité de ces sucres à partir de la période d'équilibre.
La modification des teneurs en sucres assimilables est accompagnée par une modification des teneurs en saccharose et en amidon (Figure 3). Ces teneurs sont plus importantes dans la modalité traitée durant la phase d'ontogenèse (88 - 159 JAD).
Le ralentissement des activités cellulaires lié à la modification des équilibres hormonaux (plus forte accumulation d'ABA chez les traités) induit une hausse des teneurs en saccharose, provoquant l'entrée en dormance et l'accumulation d'amidon (Figure 4).
Dans le cas des vignes traitées, l'augmentation de la teneur en saccharose pourrait être liée à un transport plus important des sucres dans les bourgeons, ce qui augmenterait l'accumulation d'amidon. Le produit induit une augmentation des teneurs en amidon, améliorant ainsi la mise en réserve dans les bourgeons latents à l'entrée en dormance. Cela conférerait à la vigne l'avantage d'une meilleure résistance aux épisodes hivernaux, mais surtout favoriserait l'initiation précoce des PI juste après débourrement l'année suivante.
Quel impact sur le rendement ?
Il est donc établi que ce biostimulant modifie certains mécanismes et métabolismes dans le bourgeon latent au cours de la formation des PI : il stimule les mécanismes de différenciation cellulaire et de ramification des PI en favorisant la mise en réserve à l'approche de l'entrée en dormance. L'impact de ces modifications physiologiques a été évalué en mesurant le rendement l'année suivante.
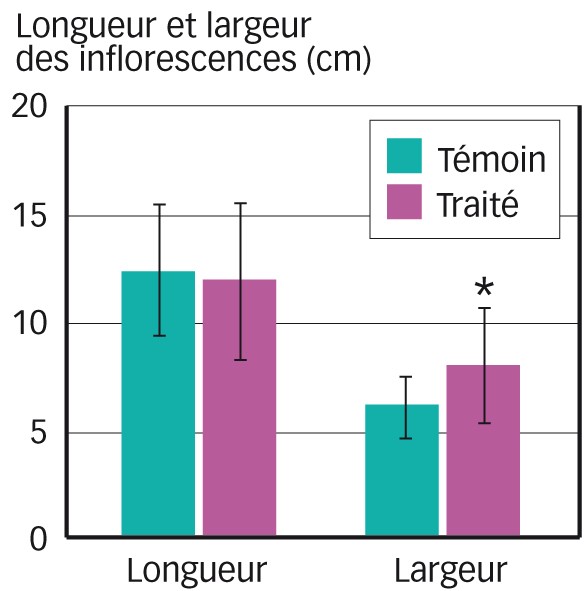
Pour les deux années étudiées, le nombre moyen de grappes n'est pas modifié par le traitement, mais le poids moyen de ces grappes augmente (voir tableau). Cela est principalement dû à une augmentation du volume des inflorescences (Figure 5) en lien direct avec les mécanismes de ramification des PI démontrés auparavant.
Conclusion
Trois approches convergentes
L'approche multidisciplinaire utilisée ici a permis de montrer l'impact positif de Vivaflor (GoActiv) sur l'expression des gènes impliqués dans les mécanismes, et également sur les mécanismes de régulation hormonale et le métabolisme des sucres favorisant la formation des PI dans les bourgeons latents de la vigne. Agissant à trois niveaux complémentaires, il favorise les étapes de ramification des PI en stimulant principalement les activités cellulaires de différenciation et le métabolisme glucidique.
Ainsi, le suivi des équilibres d'expression des gènes VvCLE25-1 et VvCLE-TDIF permet de démontrer que ce biostimulant a une action sur l'expression des gènes impliqués dans la méristémisation en favorisant la régulation positive de la ramification et la différenciation des PI. Ces conclusions sont confortées par les différences significatives observées sur les teneurs des différents sucres, indiquant que le produit améliore le métabolisme glucidique de la plante en favorisant la disponibilité en sucres pour les bourgeons. Ils voient leur activité cellulaire favorisée à la fois sur le plan nutritif et sur le plan signalétique, principalement lors des phases de ramification et de mise en réserve.
Enfin, l'approche hormonale a permis de démontrer une augmentation de la teneur en ABA au début de l'entrée en dormance, favorisant l'accumulation plus importante de saccharose et d'amidon, ce qui permettrait une meilleure mise en réserve des sucres insolubles et une meilleure distribution/utilisation des sucres solubles au printemps suivant, avec un effet cumulatif.
Mécanismes favorisés
L'ensemble de ces résultats convergent donc vers les mécanismes cellulaires communs et connus qui sont impliqués dans la ramification des organes. Ainsi, en stimulant l'ensemble de ces mécanismes, Vivaflor (GoActiv) favorise la phase de ramification des primordia inflorescentiels ainsi que la disponibilité en sucres, permettant d'augmenter la taille des grappes, donc leur poids.
RÉSUMÉ
CONTEXTE - Il est connu que les grappes de raisin sont issues d'un processus étalé sur deux années (formation de PI, primordia inflorescentiels, dans les bourgeons latents qui donneront des grappes l'année suivante). Cependant, la question est de savoir si des biostimulants améliorant la fructification de l'année ont un effet sur celle de l'année suivante.
TRAVAIL - L'université de Bordeaux a étudié les effets du bioformulant à base d'Ascophyllum nodosum nommé Vivaflor, de la société Arysta LifeScience :
- sur l'expression des gènes liés à la formation des PI ;
- sur les taux de sucres (glucose, fructose, saccharose, amidon) ;
- sur ceux de l'hormone ABA ;
- sur le rendement final.
RÉSULTATS - La plus forte expression des gènes menant à la différenciation et les taux de sucres et d'ABA montrent l'intensification des phénomènes menant à la mise à fruit. Le rendement augmente via la hausse du volume des grappes.
MOTS-CLÉS - Vigne, biostimulants, Vivaflor (GoActiv), PI (primordia inflorescentiels), gènes, sucres.
POUR EN SAVOIR PLUS
CONTACT : aude.bernardon-mery@arysta.com
 Imprimer
Imprimer