La bactériose vasculaire due à Xanthomonas hortorum pv. pelargonii (syn. X. campestris pv. pelargonii) est une des plus graves maladies du pélargonium. Elle déprécie fortement la qualité des plants et il n'y a guère de traitement curatif. Les producteurs essaient donc de la détecter avant l'apparition des premiers symptômes afin d'éliminer les plants porteurs qui, sinon, en contamineraient d'autres. Oui, mais quelle méthode de détection faut-il employer pour obtenir des résultats fiables sur la présence ou l'absence de la bactérie ? Pour le savoir, douze laboratoires ont comparé leurs méthodes de détection. Ce test comparatif (en anglais « ring test (1) ») permet d'en savoir plus sur l'intérêt des techniques ELISA, DIBA, IF et PCR. Pas d'inquiétude, les sigles sont expliqués dans l'article !
Les symptômes de bactériose vasculaire du pélargonium (photo en médaillon) peuvent survenir sur boutures. Celles-ci se dessèchent, avec la formation d'un cal au niveau de la coupe et un enracinement défectueux. On observe des nécroses sur tiges à l'extrémité des rameaux. Sur feuilles, des lésions huileuses suivies de flétrissement des feuilles et de nécrose internervaire apparaissent (Chittaranjan & Boer, 1997).
Dans le cadre d'une démarche pour assurer la qualité sanitaire des boutures de pélargonium et du règlement technique de certification de ces boutures, les producteurs de plants testent leur production pour détecter X. campestris pv. pelargonii avant l'apparition de ces symptômes. En cas de bouture positive, une procédure de destruction est mise en place.
Méthodes de détection de cette bactériose
Différentes méthodes de détection de la bactérie peuvent être employées, comme l'isolement sur milieu de culture (Schaad, 1988), l'immunofluorescence (IF), l'ELISA (Enzyme Linked Immunosorbent Assay) ou la PCR (Polymerase Chain Reaction) (Benedict et al., 1990 ; Sulzinski et al., 1997 ; Chittaranjan & Boer, 1997).
Selon les laboratoires, la technique utilisée est l'IF, l'ELISA ou le DIBA (dot immunobinding assay). Actuellement aucun laboratoire ne pratique en routine la détection par PCR de X. campestris pv. pelargonii sur boutures de pélargonium.
But du test interlaboratoires
21 entreprises fournisseuses de jeunes plants et obtenteurs de la filière plantes ornementales ont fondé un groupement, le GROPO (Groupement de recherche et d'obtentions pour les plantes ornementales) au sein de la FNPHP (Fédération nationale des producteurs horticulture et pépinières). Elles ont fait appel à l'Astredhor pour réaliser un projet concernant l'amélioration de la qualité sanitaire des jeunes plants.
Arexhor Ile-de-France-Haute-Normandie (station membre de l'Astredhor) a monté un programme d'actions visant à recenser les problèmes pathologiques des plantes ornementales et étudier la fiabilité des méthodes de diagnostic de X. campestris pv. pelargonii. Ce projet a été accepté par le CTPS.
Dans le cadre de ce projet, il a été décidé de comparer les méthodes de diagnostic de X. campestris pv. pelargonii utilisées par différentes entreprises productrices de plants et laboratoires, par le biais de tests inter laboratoires organisés par la SNES (Station nationale d'essais de semences). Le seuil de détection sur souches pures et la détection sur boutures ont été évalués. Douze laboratoires ont participé à cette étude.
Ce qu'ont fait les 12 laboratoires participants
Sept pour le seuil de détection en culture pure
Sept laboratoires participants ont reçu 3 échantillons d'une suspension de X. campestris pv. pelargonii à 107 cfu/ml, et ont réalisé 7 séries de dilution de 10 en 10 de chaque échantillon jusqu'à obtenir une suspension à 100 cfu/ml. Chaque laboratoire a ensuite analysé 3 répétitions de chaque concentration par sa propre technique (ELISA, DIBA ou IF) et ses propres serums (Agdia ou LCA). Chaque laboratoire a ainsi réalisé un total de 72 analyses comprenant 9 analyses par concentration bactérienne. Des témoins négatifs (tampon seul) et positifs (des kits) ont été inclus à l'analyse.
Afin de vérifier la concentration bactérienne des suspensions envoyées, la SNES a réalisé des étalements sur milieux de culture (LPGA). Un laboratoire a testé la détection par PCR.
Mise au point de la contamination artificielle des boutures
Afin de disposer de boutures artificiellement contaminées visuellement semblables à des boutures saines, on a testé plusieurs méthodes d'inoculation artificielle : infiltration de la suspension bactérienne avec une aiguille par une des sections de la bouture, infiltration sous vide des boutures, trempage dans une suspension bactérienne de boutures portant une feuille.
Les boutures artificiellement contaminées ont été laissées 2 jours à température ambiante pour mimer l'envoi par courrier prévu lors du circuit, et 10 boutures par méthode d'inoculation ont été analysées par ELISA.
Douze pour la détection sur boutures
Le test a été effectué à partir de boutures fraîches artificiellement contaminées par infiltration sous vide de X. campestris pv. pelargonii à 3 taux d'inoculum bactérien différents (102, 104, 106 cfu/ml). On a inclus des boutures infiltrées sous vide avec de l'eau comme boutures « non inoculées ».
30 échantillons codés ont été envoyés par courrier express aux 12 laboratoires partenaires. Chaque échantillon comprenait 5 boutures contaminées avec une suspension bactérienne à 106 cfu/ml, 10 boutures à 104 cfu/ml, 10 boutures à 102 cfu/ml et 5 boutures non inoculées. À réception, chaque laboratoire a traité séparément chaque bouture. Les extrémités de chaque bouture ont été coupées et un fragment de 400 mg pesé et prélevé.
Chaque laboratoire a analysé les échantillons reçus avec la méthode qu'il pratique en routine : DAS ELISA, DIBA ELISA, ou IF. Un laboratoire a testé la PCR. Le laboratoire 5 a testé deux origines de sérum. Chaque laboratoire a ajouté un témoin positif et un témoin négatif selon son protocole.
En parallèle, la SNES a analysé des boutures supplémentaires contaminées aux différentes concentrations (10 boutures par concentration) afin de vérifier que 100 % des boutures étaient contaminées.
Des résultats significatifs
Seuil de détection en culture pure
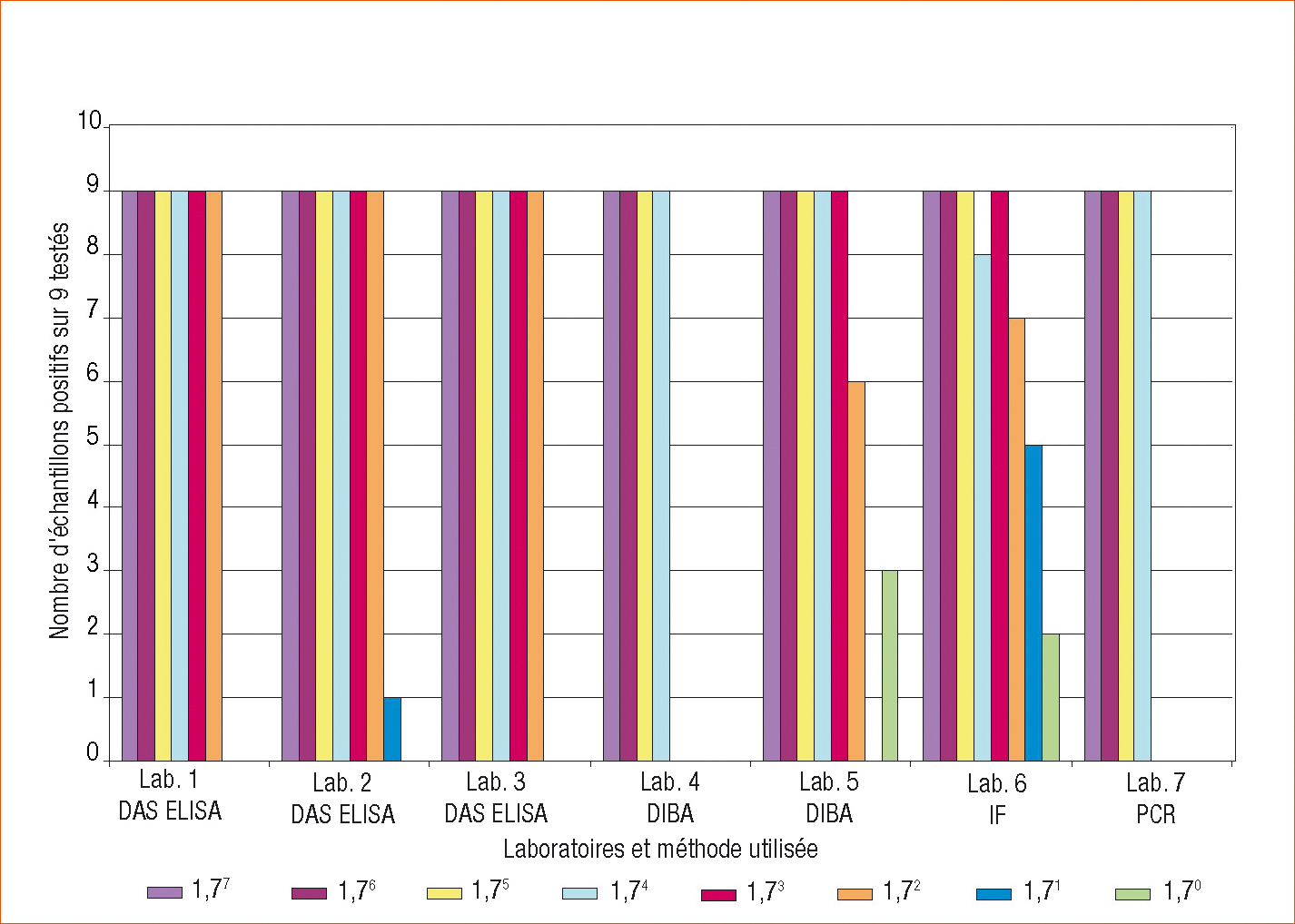
Les résultats sur la détection en culture pure sont présentés figure 1. Les concentrations bactériennes utilisées ont été vérifiées par isolements. Les témoins positifs et négatifs ont été conformes pour les 7 laboratoires.
En ELISA, le seuil de détection reproductible sur les 3 répétitions se situe à 1,7 102 cfu/ml pour les trois laboratoires. Les sérums différents utilisés (Agdia et LCA) permettent la détection de X. campestris pv. pelargonii avec un même seuil de détection.
En DIBA, on note une très forte hétérogénéité entre les laboratoires. Pour le laboratoire 4, le seuil se situe à 1,7 104 cfu/ml de façon reproductible. Pour le laboratoire 5, le seuil se situe de façon reproductible à 1,7 103 cfu/ml et une détection hétérogène est observée à 1,7 102 cfu/ml, mais avec un signal faible.
En PCR, le seuil de détection reproductible se situe à 1,7 104 cfu/ml. Ceci est comparable ou plus faible au seuil décrit dans la littérature pour certaines amorces spécifiques d'autres Xanthomonas (Fargier, 2007).
En IF, le seuil de détection se situe à 1,7 103 cfu/ml mais avec une très forte hétérogénéité des résultats : certains échantillons présentent un signal négatif dès 104 cfu/ml et d'autres un signal positif jusqu'à 1.7 100 cfu/ml. Le premier résultat pourrait être dû à une extinction de la fluorescence pour certaines lames suite au délai entre le dépôt des échantillons, la réaction antigène-anticorps et la lecture effectuée plus d'un mois après par le laboratoire. La détection dans les très faibles concentrations pourrait être due à une contamination croisée.
Le seuil de détection en culture pure a permis de caler les concentrations utilisées pour la suite du circuit sur boutures.
Mise au point de la contamination artificielle des boutures : l'infiltration sous vide retenue
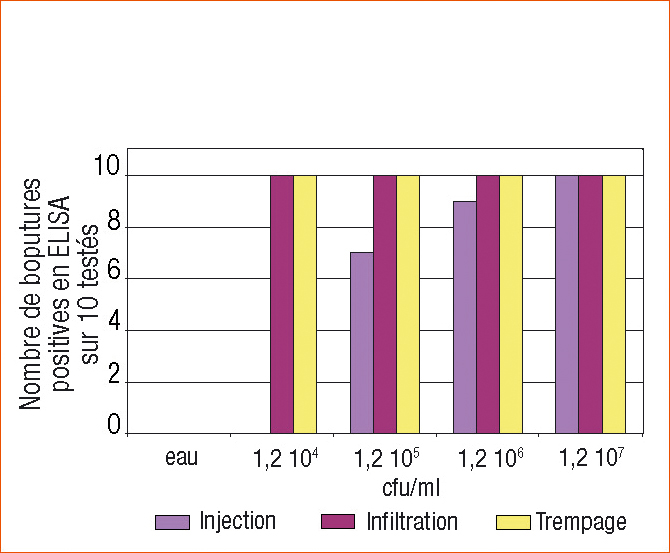
Les résultats sont présentés figure 2. Toutes les boutures avaient un aspect sain lors de l'analyse par ELISA.
La contamination artificielle par injection n'a pas donné des résultats homogènes aux concentrations inférieures à 1,2 107 cfu/ml.
Les contaminations artificielles par infiltration sous vide et trempage ont donné des résultats homogènes dès la première concentration testée (1,2 104 cfu/ml).
En raison de sa facilité de mise en œuvre, l'infiltration sous vide a été choisie.
Détection sur boutures
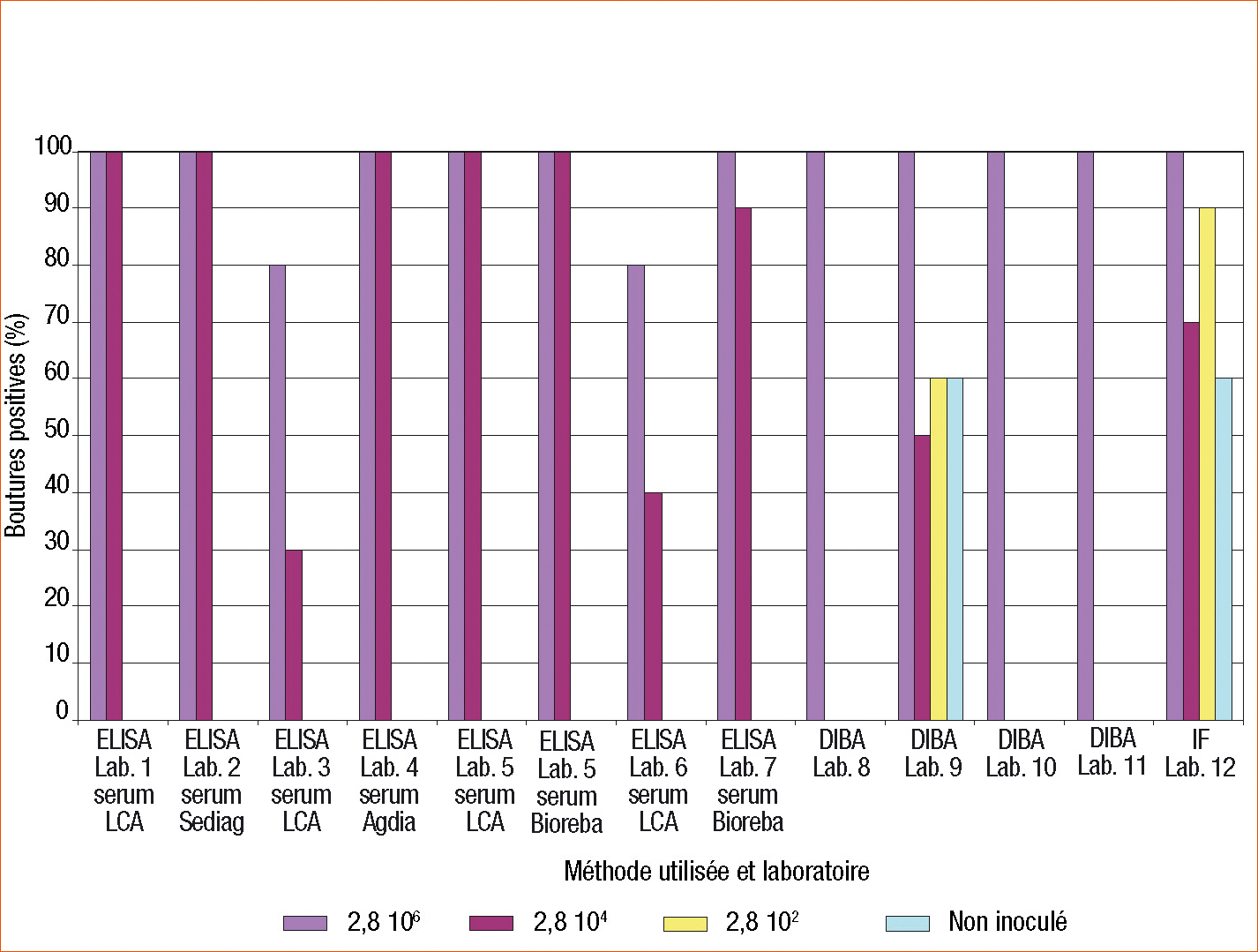
Les résultats sont présentés figure 3 p. 38. Les témoins positifs des différents laboratoires étaient conformes.
En DAS ELISA, les boutures analysées à la SNES ont montré une contamination homogène à partir de 2,8 104 cfu/ml et aucune détection de X. campestris pv. pelargonii en dessous de cette concentration (résultats non présentés). Aucune détection de X. campestris pv. pelargonii n'a été possible à 2,8 102 cfu/ml, résultat attendu avec la technique ELISA sur plante. Sur boutures de plantes, la figure 3 montre que X. campestris pv. pelargonii est détecté à partir de 2,8 104 cfu/ml. 5 laboratoires sur 8 ont présenté des résultats conformes à ce qui était attendu : détection de l'ensemble des boutures contaminées à 2,8 104 cfu/ml et 2,8 106 cfu/ml et aucun faux positif.
Les différents sérums utilisés (Agdia, Bioreba, Sediag et LCA) ont permis la détection de X. campestris pv. pelargonii avec un même seuil de détection.
Un laboratoire (n°7) a présenté un seul faux négatif à 2,8 104 cfu/ml. Du fait d'une défaillance de son lecteur ELISA, ce laboratoire a effectué une lecture visuelle de ses plaques, moins précise qu'une lecture de densité optique (Do).
2 laboratoires (n° 3 et 6) ont présenté de nombreux faux négatifs à 2,8 104 cfu/ml (respectivement 7/10 et 6/10) et 1 faux négatif à 2,8 106 cfu/ml. Le laboratoire 3 débutait ses analyses de X. campestris pv. pelargonii et a noté des valeurs de Do du témoin sain anormalement élevées. Le laboratoire 6 a eu des problèmes de disponibilité de personnel et de délai entre la réception et l'analyse des boutures qui peut expliquer son résultat.
En DIBA ELISA, comme pour la technique DAS ELISA, il n'y a pas eu de détection reproductible à 2,8 102 cfu/ml. Tous les laboratoires détectent X. campestris pv. pelargonii à 2,8 106 cfu/ml. Ceci situe le seuil de détection de X. campestris pv. pelargonii à 2,8 106 cfu/ml pour la technique DIBA. 3 laboratoires sur 4 (n° 8, 10 et 11) ne détectent pas les boutures contaminées à 2,8 104 cfu/ml. Le laboratoire 9 détecte la bactérie dans certaines boutures contaminées à 2,8 102 cfu/ml (6/10), à 2,8 104 cfu/ml (5/10)... mais aussi dans des boutures non inoculées (3/5) ! Ces faux positifs remettent en cause les résultats et posent la question de contaminations croisées.
Les résultats du laboratoire 12 ayant réalisé l'immunofluorescence (IF) montrent la détection de X. campestris pv. pelargonii à 2,8 106 cfu/ml pour toutes les boutures testées. La figure 3 montre aussi la présence de faux positifs (3/5 boutures non inoculées positives), des détections à 2,8 102 cfu/ml (9/10) et à 2,8 104 cfu/ml (7/10). Les détections en IF sont à prendre avec précaution vu la présence de faux positifs. Ici encore se pose la question de contaminations croisées ou de difficultés de lecture.
Aucune détection n'a été possible en PCR.
Conclusion
La méthode ELISA semble la plus efficace au vu des résultats de nos laboratoires pour détecter X. campestris pv. pelargonii sur culture pure et sur boutures : c'est la méthode la plus sensible et la plus reproductible entre laboratoires.
La méthode DIBA est moins sensible et moins reproductible : résultats hétérogènes entre laboratoires au niveau du seuil de détection et de la répétabilité de détection à une même concentration sur plusieurs échantillons.
La méthode IF donne des résultats aléatoires et nous avons mis en évidence des contaminations croisées avec cette technique. Comme elle n'a été testée que par un laboratoire, il est difficile de conclure sur sa reproductibilité. La répétabilité de détection sur plusieurs échantillons à une même concentration est mauvaise.
Pour assurer la fiabilité des résultats et diminuer le risque de faux négatifs, nous conseillerions d'utiliser la technique ELISA.
Le seuil de détection de la PCR est assez élevé par rapport aux autres techniques étudiées. Sulzinski et al. (1998) décrivent des seuils de détection de 1 à 120 cfu par bouture, avec recours à un enrichissement qui permettrait d'améliorer le seuil. Il est donc envisageable de diminuer le seuil de détection de X. campestris pv. pelargonii en améliorant la méthode PCR que nous avons utilisée lors de ces circuits.
Un second circuit est envisagé afin de comparer les méthodes d'extraction pour la PCR.
<p>* GEVES-SNES.</p> <p>** AREXHOR Ile-de-France-Haute-Normandie.</p> <p>(1) Traduction littérale : test en anneau, ou anneau de tests : chaque participant à un tel test inter-laboratoire ne teste pas toutes les méthodes mais les résultats de chacun sont liés à ceux des autres, comme les anneaux d'une chaîne.</p>
Figure 1 - Seuil de détection des différentes méthodes de détection de Xanthomonas campestris pv. pelargonii sur culture pure.

 Imprimer
Imprimer